Q H - = ∆ = Q
Q H - = ∆ = Q
4-. La combustion de 3g d'éthane fait élever de 500 C la température de 170g d'eau. Calcule la chaleur molaire de combustion de l'éthane C2H6. -3.6X105 J.
 Untitled
Untitled
Quelle est la chaleur molaire de combustion du méthane CH4 (g). Équation de la réaction: CH4 (g) + 2 O2 (g) ---> CO2 (g) +2 H2O (g) сни устана. C+02 соа. 21+2
 Exercices 3-1
Exercices 3-1
19- Quelle formule permet de trouver la chaleur molaire de combustion (ΔH) d'une substance ? 20- On introduit dans une bombe calorimétrique 1 mole de
 Le restaurant chinois
Le restaurant chinois
Définissez la chaleur molaire de combustion? Pour les questions 4 à 9 vous pouvez vous référer
 Exercices sur la chaleur molaire et la loi de Hess
Exercices sur la chaleur molaire et la loi de Hess
9 nov. 2014 Vérifier si la somme des équations dont on connait la chaleur donne l'équation inconnue. 4. 1- L'équation suivante représente la combustion du ...
 00_chapitre 13_AD_Combustion alcools developpement
00_chapitre 13_AD_Combustion alcools developpement
La chaleur molaire de combustion de l'éthanol est de −1250 kJ/mol. On retrouve la valeur donnée dans les tables : PCmol (éthanol) = 1330 kJ/mol (voir table ci-
 Energie thermique dégagée par la combustion de la paraffine
Energie thermique dégagée par la combustion de la paraffine
On suppose que la bougie est constituée uniquement de paraffine hydrocarbure de formule. C25 H32 . On veut déterminer la chaleur molaire de combustion de la
 Untitled
Untitled
1 met x -2312 kJ. 0
 Alberta Education
Alberta Education
Chaleur (f) molaire de combustion. Molar heat of combustion. Chaleur (f) molaire de fusion. Molar heat of fusion. Changement (m) de phase. Phase change.
 [PDF] Exercices sur la chaleur molaire et la loi de Hess
[PDF] Exercices sur la chaleur molaire et la loi de Hess
9 nov 2014 · Vérifier si la somme des équations dont on connait la chaleur donne l'équation inconnue 4 1- L'équation suivante représente la combustion du
 [PDF] LES COMBUSTIBLES ALTERNATIFS CHALEUR DE COMBUSTION
[PDF] LES COMBUSTIBLES ALTERNATIFS CHALEUR DE COMBUSTION
La chaleur de combustion d'un composé chimie est la quantité d'énergie dégagée par En conclusion si on veut calculer l'enthalpie molaire (?H) on doit
 [PDF] ch5CORRIGEnotesdecoursunse
[PDF] ch5CORRIGEnotesdecoursunse
5 Chaleur molaire d'une réaction 4-Chaleur molaire :(chaleur pour une mole : règle de 3!) Calculez la chaleur de combustion du propane C3H8
 [PDF] CHAPITRE 5 : LA CHALEUR MOLAIRE DUNE RÉACTION
[PDF] CHAPITRE 5 : LA CHALEUR MOLAIRE DUNE RÉACTION
L'eau dégage de l'énergie dégagée par la dissolution du nitrate de sodium 2 Lors de la combustion de 100 g d'acétylène (C2H2) un calorimètre absorbe 500 kJ
 [PDF] Chaleur de réaction de la combustion du magnésium (loi de Hess)
[PDF] Chaleur de réaction de la combustion du magnésium (loi de Hess)
La combustion du magnésium est rapide et libère de la lumière et de l'énergie comme vous l'avez vu dans Chimie 521 Cette réaction est représentée par l'
 [PDF] Application du premier principe à la réaction chimique
[PDF] Application du premier principe à la réaction chimique
Cp(A) Cp(B) Cp(C) et Cp(D) sont les chaleurs molaires à pression constante de constituants L'enthalpie molaire de combustion de méthane à 25°C et P = 1bar
 [PDF] CHAPITRE 2 THERMOCHIMIE cours combustion M1 En
[PDF] CHAPITRE 2 THERMOCHIMIE cours combustion M1 En
de la quantité chaleur transférée et le travail effectué au système Exemple : Déterminer la fraction molaire et massique du combustible dans le mélange
 [PDF] p-11-13-combustion-paraffinepdf - Sites ENSFEA
[PDF] p-11-13-combustion-paraffinepdf - Sites ENSFEA
On suppose que la bougie est constituée uniquement de paraffine hydrocarbure de formule C25 H32 On veut déterminer la chaleur molaire de combustion de la
 [PDF] Combustion-EMSEpdf
[PDF] Combustion-EMSEpdf
comburant + combustible ? produits + chaleur » Du fait du dégagement de chaleur Fraction molaire ( ) Masse molaire (g/mol) Fraction massique ( )
 [PDF] Mesure dune chaleur de combustion
[PDF] Mesure dune chaleur de combustion
Mesure de la chaleur de combustion de l'éthanol TP 4 L'éthanol a pour formule C2H6O Calculer la masse molaire et la quantité de
 TP-cours A9 : Pouvoir calorifique d'un combustible
TP-cours A9 : Pouvoir calorifique d'un combustible
L'énergie molaire de combustion du méthane est de – 804 kJ mol–1 Remarque 2 : Pouvoir calorique PC et énergie molaire de réaction E sont liés par la relation : E = – PC x M avec E en (J mol – 1 ) ; PC en (J kg –1 ) et M : masse molaire en ( kg mol –1 )
 Energie thermique dégagée par la combustion de la paraffine
Energie thermique dégagée par la combustion de la paraffine
On veut déterminer la chaleur molaire de combustion de la paraffine 2 Montage Stratégie expérimentale : • On choisit l'aluminium car ce métal conduit mieux la chaleur que l'acier • La température initiale de l'eau est prise à + 10 °C environ et la température finale (arrêt de la chauffe) à + 30 °C environ de manière à ce que
 Searches related to chaleur molaire de combustion PDF
Searches related to chaleur molaire de combustion PDF
La chaleur de combustion d’un composé chimie est la quantité d’énergie dégagée par la combustion d’une mole de ce composé à la t empérature de référence choisie (de 0°C à 25°C ) La réaction chimique de combustion ne peut se produire que si on réunit trois éléments : un
Qu'est-ce que la chaleur de combustion ?
La chaleur de combustion d’un composé chimie est la quantité d’énergie dégagée par la combustion d’une mole de ce composé à la température de référence choisie (de 0°C à 25°C.) La réaction chimique de combustion ne peut se produire que si on réunit trois éléments : un combustible, un comburant, une énergie d’activation.
Comment mesurer la réaction de combustion ?
Arrêter l’acquisition des données en mettant l’interrupteur en position « arrêt ». Le thermogramme que vous venez d’enregistrer devrait apparaître dans la partie droite de l’écran. On peut évaluer approximativement le ?T de la réaction de combustion à l’aide des deux curseurs (noir et rouge).
Comment fonctionne la combustion d’un composé azoté ?
La combustion d’un composé azoté produit normalement du N2, mais dans les conditions de la bombe calorimétrique, une partie de ce N2 (ou de l’azote atmosphérique) est transformée en acide nitrique. Des titrages (acido-basiques et d’ions sulfate) sur les résidus de combustion permettent d’appliquer rigoureusement ces corrections.
Comment mesurer l’élévation de température lors d’une combustion ?
la méthode la plus classique consiste à mesurer l’élévation de température lors de la combustion d’une substance dont la chaleur de combustion est connue, habituellement l’acide benzoïque.
CPH 405 1 RZ 2011
LES COMBUSTIBLES ALTERNATIFS
CHALEUR DE COMBUSTION
INTRODUCTION
le calorimètre à glace de Laplace et Lavoisier. Les deux scientifiques suivaient les idées de
Joseph Black (1728-1789) et surent tirer parti des progrès réalisés à cette époque en matière de
pesée. des réactions chimiques et au fil des ans des transformations de phase.La réaction chimique de combustion ne peut se produire que si on réunit trois éléments : un
Le combustible peut être :
" un liquide ou solide liquéfiabl " un tiré deCPH 405 2 RZ 2011
(ou autres combustibles) chaleur de combustion, et on définit : " le pouvoir calorifique supérieur (PCS) e par la combustion complète récupérée " le pouvoir calorifique inférieur (PCI) : quantité d complète de combustible, la vapeur et la chaleur non récupérer. quantité de vapeur produite. Pour mesurer le pouvoir calorifique déterminer la chaleur dégagée par " Complète pour éviter les corrections difficiles à calculer si une consumée" Rapide pour éviter les déperditions de chaleur inévitables même si le système est isolé
et " Unique pour que des réactions secondaires ne viennent pas perturber la mesure. La mesure de de combustion revêt à la fois une importance fondamentale et une importance pratique considérables : un point de vue fondamental, lde combustion donne accès, avec un haut degré de libre o aire de la loi de Hess, les enthalpies de combustion peuvent être énergie de combustibles, de produits alimentaires, de sous-produits industriels utilisés pourénergie (résidus forestiers
CPH 405 3 RZ 2011
BUT Les buts de cette expérience sont les suivants : " de vous familiariser avec une des méthodes les plus classiques de déterminer la chaleur de combustion, soit la méthode de la " bombe calorimétrique » dans laquelle la combustion se fait à volume constant en prése " de comparer le pouvoir calorifique de différents combustibles utilisés à tous les jours.THÉORIE
LA CALORIMÉTRIE
Le calorimètre
calor, chaleur et du grec metron, mesure)Il existe trois types de calorimètres;
1) adiabatique, dans lequel le transfert de chaleur entre le système et son environnement est
empêché2) isopéribole, dans lequel un faible échange contrôlé de chaleur est permis et
3) isotherme, dans lequel une quantité de chaleur ou de travail peut être utilisée pour
maintenir la température du système constanteLe calorimètre utilisé dans cette expérience pour mesurer la chaleur de combustion est illustré à
la Figure 1 ci-dessous. commercial de type isopéribole en particulier la bombe calorimétrique de la compagnie Parr.Figure 1. Schéma
CPH 405 4 RZ 2011
Il est constitué
D(10) dans laquelle la réaction procède. Cette bombe calorimétrique possède desparois épaisses en acier inoxydable pour supporter les hautes pressions. La bombe est reliée à
un système élect dans laquelle plonge
la bombe calorimétrique et le détecteur de température (11). Un agitateur (7) assure
eau dans ce réservoir. Celui-ci est plaqué de chrome pour diminuer ntérieur du réservoir et le milieu extérieur.Une thermistance est un élément semi-conducteur dont la résistance diminue de façon
donné, la fonction qui relie la résistance à la température est connue. La thermistance est connectée dans un pont de Wheatstone, tel que montré à la Figure 2.Ce pont transforme la variation de résistance
en variation de potentiel pouvant être lue par une interface A/D. Cette variation de potentiel est étalonnée pour correspondre à une variation de températureFigure 2. Schéma du pont de Wheatstone.
Analyse thermodynamique
Bien que seules les équations finales soient nécessaires afin de calculer les résultats, une
compréhension de la thermodynamique permet de mieux saisir leurs origines et leurs utilités.calorimétrique si on veut étudier le phénomène à pression constante. Dans ces conditions
expérimentales la chaleur mise en jeu est égale à la vaU, énergie interne du système et par conséquent ne dépend plus de la manière de procéder.interne des produits moins celle des réactifs à une même température : le U est donc donnée
pour une transformation isotherme. Analysons ce procédé en deux étapes (voir la figure2).CPH 405 5 RZ 2011
Figure 2. Analyse thermodynamiq
Selon la loi de Hess :
U (réaction globale) = U1 (étape 1) + U2 (étape 2) (1) - U1 = 0 - U = U2 = Qv. Remarque usystème = - Umilieu, ou dans notre cas milieu = calorimètre et ibre, soit à pressionH) que
U). Le passage est possible si on applique la première loi de la thermodynamique forme de travail (w), donc :U = Q + w (2)
ou pour un changement infinitésimal dU = dQ + dw (3) dans un système fermé et pour un processus réversible dw = -P*dVP = pression
dV = variation du volume au cours du processus. H = U + PV donc dH = dU + d(PV) (4) H = U + PV =Qp (5)CPH 405 6 RZ 2011
devient : dH = dU + d(nRT) = dU + R(Tdn + ndT + dndT) = dU + R(Tdn + ndT) (6) et puisque ndT<< Tdn, donc dH = dU + RTdn ou H = U + RT'n = Qv +RT'ngaz (7) n = la variation du nombre de moles de gaz entre les produits et les réactifs. R = la constante universelle des gaz (8,314 J mol-1 K-1)T = la température (K)
Pour déterminer le ngaz
de combustion. ue, réactif universellement utilisé pour étalonner une bombe calorimétrique, correspond à la réaction suivante à 25°C :C6H5CO2H (s) +
2 15O2 (g) 7 CO2 (g) + 3 H2O (8)
nthalpie molaire (H ou de compression des gaz. Le Hconditions standard puisque la combustion est effectué sous une pression de 20 ou 25 at.
pour 1 atm est possible si des résultats très précis sont nécessaires, mais la
correction est habituellement très petite. NOTE étant dans leur état standard (i.e. P = 1 atm) à une température définie (ex.En analysant attentivement la figure 2 on
système (produits En pratique nous (constante du calorimètre) .CPH 405 7 RZ 2011
Combustion
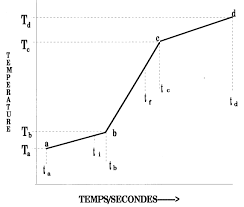
Le thermogramme
Un thermogramme est un graphique qui
représente la variation de la température en fonction du temps. combustion dans une bombe calorimétrique est illustrée à la Figure 3.Figure 3. Schéma du thermogramme
Différentes parties peuvent être identifiées sur ce thermogramme :La période de pré-combustion
La partie " a-b » représente la période de précombustion, Au cours de cette période, la
température devrait être stable, ou varier faiblement de façon linéaire en fonction du temps.
Plusieurs phénomènes peuvent contribuer à la variation de la température : o le transfert de chaleur par radiation et/ou par convection entre le calorimètre etLa période de combustion
La partie " b-c » représente la période de réaction. Cette partie du thermogramme représente la
par la réaction de combustion de , en plus des échangesLe point " b » correspond au début de la réaction de combustion. Dans la bombe, la combustion
peut être considérée comme instantanée; la température augmentant momentanément de
quelques centaines de chaleur, diminue en fonction du temps.CPH 405 8 RZ 2011
La période post-combustion
La partie " c-d » représente la période post-combustion. Lorsque température en fonction du temps mécanique, de et des échanges par convection et par La partie " c-d » du thermogramme devrait être à nouveau une droite. Détermination de la variation de la température T Les lignes de pré et de post-combustion (A,B) sont extrapolées vers un point commun sur l'axedu temps; ces lignes sont parallèles pour le calorimètre adiabatique mais pas pour le calorimètre
isopéribole (cas de la Fig.2). Une ligne verticale est tracée de manière à ce que les surfaces
hachurées du graphique soient approximativement égales; elle sert à calculer la variation de
température (T). Ces surfaces hachurées (une positive et une négative) sont proportionnelles
aux fuites de chaleur. En rendant ces surfaces égales, on compense pour les fuites de chaleur, cequi permet d'évaluer une variation de température égale à celle d'un processus adiabatique. La
température moyenne de la mesure est prise au croisement (C) du thermogramme.Au laboratoire on évaluera le
CPH 405 9 RZ 2011
Étalonnage
Il existe deux méthodes ombustion :
est disponible dans le commerce (note U) est indiquée sur la bouteille). lméthode consiste à faire passer une quantité connue de courant (I) dans une
résistance (R) t précis (étalonnage électrique aussi appelé " par effet Joule »). thermique dégagée par la résistance (Qe) est calculée par une des relations suivantes :Qe = V I t (9)
Qe = énergie thermique fournie au calorimètre en JouleV = la différen
I = courant en Ampère
t = temps de passage du courant en secondesétalonnage
e T Qe (10) est représentée sur laFigure 5.
CPH 405 10 RZ 2011
Figure 5. T par effet Joule.
CaT respectifs déterminés, le calcul de
quotesdbs_dbs35.pdfusesText_40[PDF] mots croisés passé composé ? imprimer
[PDF] mots croisés passé composé cm2
[PDF] mots croisés conjugaison passé composé
[PDF] mots croisés conjugaison ce2 ? imprimer
[PDF] mots croisés conjugaison cycle 3 ? imprimer
[PDF] conjugaison ekladata
[PDF] mots croisés participe passé
[PDF] réaction inflammatoire phases
[PDF] réaction inflammatoire animation
[PDF] exemple liquide ionique
[PDF] les liquides ioniques pdf
[PDF] utilisation des liquides ioniques
[PDF] liquides ioniques chimie verte
[PDF] liquide ionique liste