 Chapitre 4 Équations chimiques
Chapitre 4 Équations chimiques
Dans toute réaction chimique la masse totale des réactifs est égale à la masse totale des produits. Donc
 I. Définition de léquation chimique
I. Définition de léquation chimique
ZnCℓ2 + H2. Page 3. V. Formules chimiques et équations chimiques. 123. Remarque : - Certains métaux peuvent réagir avec des acides dilués et donnent du
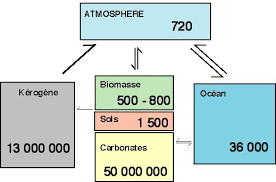 5 Équations chimiques et biochimiques du cycle du carbone 5.1.Les
5 Équations chimiques et biochimiques du cycle du carbone 5.1.Les
En combinant (1.2) et (1.1) on obtient l'équation 1. 2. CH2O + O2 --> CO2 + H2O. Écriture des demi-réactions d'oxydo-réduction. CH2O + H2O --
 Fiche Méthode Bilan chimique 1 : les équations chimiques
Fiche Méthode Bilan chimique 1 : les équations chimiques
FMch-1a bilan chimique 1/ STL Lycée Borde Basse. Page 1/1. Fiche. Méthode. Bilan chimique 1 : les équations chimiques. Signification d'une équation bilan.
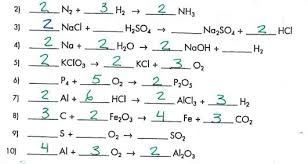 Exercices supplémentaires sur le balancement déquations
Exercices supplémentaires sur le balancement déquations
Exercices supplémentaires sur le balancement d'équations chimiques. 1- Balance les équations suivantes : FeS + O2. Fe2O3 + SO2. C3H8 + O2. CO2. + H2O. K2CrO4 +
 Calculs à partir des équations chimiques
Calculs à partir des équations chimiques
Significations de l'équation chimique: 1. L'alcool éthylique (ordinaire) brûle suivant l'équation non équilibrée: C2H6O + O2. CO2 + H2O.
 Comment choisir un logiciel permettant dapprendre à équilibrer les
Comment choisir un logiciel permettant dapprendre à équilibrer les
La réaction chimique : bilan conservation de la masse et des atomes. Technique opératoire de l'équation-bilan d'une réaction chimique déjà étudiée en classe.
 Le balancement déquations chimiques
Le balancement déquations chimiques
Complétez la phrase suivante. Le balancement d'équations chimiques se fait par l'ajout d'un devant la formule chimique de certains des et de certains des.
 Feuille de TD -Équations chimiques 1
Feuille de TD -Équations chimiques 1
Les équations chimiques nous permettent de modéliser la transformation des molécules et atomes dans une réaction chimique. Par exemple l'équation chimique.
 Règlements pour écrire les équations chimiques équilibrées
Règlements pour écrire les équations chimiques équilibrées
la droite d'une équation chimique. *Trucs pour équilibrer des équations chimiques : 1. Si un ion polyatomique existe à la gauche et à la droite de la flèche
 Exercices supplémentaires sur le balancement déquations
Exercices supplémentaires sur le balancement déquations
Exercices supplémentaires sur le balancement d'équations chimiques. 1- Balance les équations suivantes : FeS + O2. Fe2O3 + SO2. C3H8 + O2.
 Calculs à partir des équations chimiques
Calculs à partir des équations chimiques
Significations de l'équation chimique: 1. L'alcool éthylique (ordinaire) brûle suivant l'équation non équilibrée: C2H6O + O2. CO2 + H2O.
 Chapitre 4 Équations chimiques
Chapitre 4 Équations chimiques
Donc l'équation ionique nette est l'équation ionique totale à laquelle on a enlevé les ions spectateurs. Page 16. Ch4. 16. 2013. Équations ioniques (suite).
 5 Équations chimiques et biochimiques du cycle du carbone 5.1.Les
5 Équations chimiques et biochimiques du cycle du carbone 5.1.Les
En combinant (1.2) et (1.1) on obtient l'équation 1. 2. CH2O + O2 --> CO2 + H2O. Écriture des demi-réactions d'oxydo-réduction. CH2O + H2O --
 Écrire des équations chimiques équilibrées
Écrire des équations chimiques équilibrées
Pourquoi Équilibrer les équations? La théorie atomique: les atomes ne peuvent pas être crée ni détruit dans une réaction chimique ordinaire. La loi de la
 Chapitre 4 Ce sont les Chinois qui ont inventé les feux dartifice.
Chapitre 4 Ce sont les Chinois qui ont inventé les feux dartifice.
des réactifs et des produits est modifiée. d. Lors d'une transformation chimique seules les liaisons entre les atomes qui participent à une réaction chimique
 Feuille de TD -Équations chimiques 1
Feuille de TD -Équations chimiques 1
Les équations chimiques nous permettent de modéliser la transformation des molécules et atomes dans une réaction chimique. Par exemple l'équation chimique.
 Chapitre 4 Équations chimiques
Chapitre 4 Équations chimiques
Dans toute réaction chimique la masse totale des réactifs est égale à la masse totale des produits. Donc
 Le balancement déquations chimiques
Le balancement déquations chimiques
Complétez la phrase suivante. Le balancement d'équations chimiques se fait par l'ajout d'un devant la formule chimique de certains des et de certains des.
 Equilibrer les équations suivantes : a) b) c) d) ? 5 CO2 + 4 H2O e
Equilibrer les équations suivantes : a) b) c) d) ? 5 CO2 + 4 H2O e
Exercices : équation-bilan. I- Equilibrer les équations suivantes : Ajuster les nombres stœchiométriques des équations chimiques ci-dessous.
Une équation chimique
· Une façon simple de réprésenter une réaction chimique sur papier.· Format générale:
Le(s) substance(s) du côté gauche de léquation se nomment réactif(s). Le(s) substance(s) à la droite de léquation se nomment produit(s).· Voici une équation chimique typique:
2H 2 + O 2à 2H
2 OPourquoi Équilibrer les équations?
La théorie atomique: les atomes ne peuvent pas être crée ni détruit dans une réaction chimique ordinaire. La loi de la conservation de la masse: la masse totale des produits est toujours égaleà la masse totale des réactifs.
· Donc, il doit y avoir la même quantité de chaque type délément à la gauche et à
la droite dune équation chimique.Les chiffres dans les équations chimiques
o souscrits les petits numéros à la droite des symboles chimiques. Ils représentent le nombre datomes de chaque élément dans le molécule. o coéfficients les grands numéros en avant des formules chimiques. Ils représentent le nombre de molécules de la substance dans la réaction. · Vous pouvez changer les coéfficients dans une réaction chimique. · Vous ne pouvez pas changer les souscrits dans une réaction chimique. Règlements pour écrire les équations chimiques balancées :1. Écris une équation nominative (les noms des substances)
2. Écris léquation squelette (les formules des substances)
3. Écris léquation équilibrée (ajouter les états quand nécéssaire)
Exemple:
Équation nominative
sodium + eau ® hydroxyde de sodium + hydrogèneÉquation non-équilibrée
Na + H
2O ® NaOH + H
2 * Noubliez pas que les molécules diatomiques Équation équilibrée HOBrFINCl sont toujours 22Na + 2H
2O ® 2NaOH + H
2Équation équilibrée avec états:
2Na (s) + 2H 2 O (l)® 2NaOH
(aq) + H 2(g) *Trucs pour écrire des équations chimiques balancées1. Si un ion polyatomique existe à la gauche et à la droite de la flèche, balancez les.
2. Balancez les métals.
3. Balancez les non-métals (sauf hydrogène et oxygène).
4. Balancez loxygène.
5. Balancez lhydrogène.
6. Vérifiez votre travail en comptant les atomes.
7. Si vous pouvez réduire CHAQUE coéfficient, faites-le.
o Une équation nest pas balancé correctement si les coefficients nont pas la ratio correcte le plus bas.8. *Rapelle: les éléments suivants existent seulement sous forme de molécule
diatomique! dihydrogène, H2(g), diazote, N2(g), dioxygène, O2(g), le difluor, F2(g), le dichlore, Cl2(g), le dibrome, Br2(l ), et ldiiode, I2(s). Pratique: Équilibre les équations chimiques suivantes: (exemple à la page 132)1. ___ AgNO3 + ___ NaBr ® ___ NaNO3 + ___ AgBr
2. ___ KClO3 ® ___ KCl + ___ O2
3. ___ H2O ® ___ H2 + ___ O2
4. ___ HgO ® ___ Hg + ___ O2
5. ___ KI + ___ Pb(NO3)2 ® ___ PbI2 + ___ KNO3
6. ___ Al + ___ O2 ® ___ Al2O3
7. ___ MgCl2 + ___ NH4NO3 ® ___ Mg(NO3)2 + ___ NH4Cl
8. ___ FeCl3 + ___ NH4OH ® ___ Fe(OH)3 + ___ NH4Cl
9. ___ Na2O2 + ___ H2O ® ___ NaOH + ___ O2
quotesdbs_dbs2.pdfusesText_2[PDF] Les équations de 4°
[PDF] Les équations de dissolution
[PDF] Les équations de doite
[PDF] Les équations de droite
[PDF] Les équations de droites
[PDF] Les equations DE MATHS
[PDF] les équations de maxwell dans un milieu diélectrique
[PDF] Les équations de niveau quatrième
[PDF] Les équations de vecteurs
[PDF] Les Equations du 1er degres
[PDF] les equations du premier decré à une inconnue
[PDF] Les équations du premier degrés
[PDF] Les équations du second degré
[PDF] Les équations et inéquations
