 1- PRESENTATION Dans le domaine de chimie il y a des méthodes
1- PRESENTATION Dans le domaine de chimie il y a des méthodes
TP 1 Chimie 1. 1 ére année TCM. (2019/2020). REGLE DE TRAVAIL ET DE SECURITE ET PRESENTATION DE La note de TP = note du compte-rendu + note de contrôle TP. 6.
 Polycopie-TP-Chimie-1.pdf
Polycopie-TP-Chimie-1.pdf
compte-rendu qui sera évalué au fur et à mesure des séances. - Une absence ... UHBChlef - S1 Licence LMD -ST- Polycopie TP Chimie 1 - Dr. Malika OUAGUED. Page ...
 TP Chimie n° 1
TP Chimie n° 1
Donner quelques règles de sécurité et la méthode de travail dans le laboratoire de chimie. • Présentation de matériel. 3 La méthode de travail dans un
 Comment rédiger un compte-rendu de TP scientifique
Comment rédiger un compte-rendu de TP scientifique
Page 1. Les utilitaires de la chimie. Comment rédiger un compte rendu de TP. Un compte rendu est une histoire ! S'il est bien fait toute personne le lisant
 TP N°01 Le port de la blouse en coton blanche et assez longue est
TP N°01 Le port de la blouse en coton blanche et assez longue est
- Pour chaque TP vous devez rendre en fin de séance un compte-rendu qui sera 1ére année LMD ST/SM. Département de Chimie. TP de Chimie 1. 16. La solution ...
 tp chimie1
tp chimie1
→ Reporter les résultats de vos mesures expérimentales dans la feuille du compte rendu. Deuxième manipulation : 1. Préparation d'une solution par dilution d'
 TP Chimie n° 3
TP Chimie n° 3
Dosage acido-basique en présence d'indicateurs colorés. (Dosage de l'acide acétique contenu dans le vinaigre). 1 Introduction. Le vinaigre de vin est un produit
 TRAVAUX PRATIQUES DE CHIMIE ORGANIQUE
TRAVAUX PRATIQUES DE CHIMIE ORGANIQUE
Rédaction des comptes rendus en toute rigueur scientifique. Ce polycopié de travaux pratiques de chimie organique est destiné aux étudiants de troisième année
 TRAVAUX PRATIQUES DE CHIMIE DES SOLUTIONS
TRAVAUX PRATIQUES DE CHIMIE DES SOLUTIONS
A la fin d'année les étudiants doivent restituer ces polycopiés. Page 3. Sommaire. TP N°1 : DOSAGE ACIDE FORT - BASE FORTE PAR
 TP N° 2 : Préparation dune solution par dissolution ou par dilution.
TP N° 2 : Préparation dune solution par dissolution ou par dilution.
En chimie une solution est un mélange homogène résultant de la dissolution 2)- Compte-rendu : L'alcool à brûler commercial contient principalement de l ...
 TP CHIMIE-1 & TP CHIMIE-2
TP CHIMIE-1 & TP CHIMIE-2
1. Instructions pour la rédaction du compte rendu de TP . Pour les travaux pratiques en chimie un fascicule de TP est distribué aux étudiants dans.
 FACULTE DES SCIENCES EXACTES ET APPLIQUEES Compte
FACULTE DES SCIENCES EXACTES ET APPLIQUEES Compte
1. FACULTE DES SCIENCES EXACTES ET APPLIQUEES. Compte rendu de T P CHIMIE II N°2 L1. Détermination de l'équivalent mécanique de la chaleur (J). ST.
 Comment rédiger un compte-rendu de TP scientifique
Comment rédiger un compte-rendu de TP scientifique
de la chimie Son compte rendu doit présenter les différentes ... rendu. • Il doit comporter les parties suivantes : 1) Titre du TP. 2) Présentation.
 Les Travaux Pratiques De Réactivité chimique
Les Travaux Pratiques De Réactivité chimique
Afin de montrer à l'étudiant ce que doit contenir un compte rendu Au cours des séances de TP de chimie de l'année
 TP Chimie I
TP Chimie I
TP Chimie I. Brochure de Travaux Pratique 1er année Science de la matière Explication sur les exigences du contenu et la présentation d'un compte-rendu.
 TRAVAUX PRATIQUES DE CHIMIE DES SOLUTIONS
TRAVAUX PRATIQUES DE CHIMIE DES SOLUTIONS
Les comptes rendus devront être transmis à la prochaine séance à l'enseignant. TP N°1 : DOSAGE ACIDE FORT - BASE FORTE PAR PH-METRIE ET. CONDUCTIMETRIE.
 Fiche méthode : Le compte rendu de TP. Introduction : Le compte
Fiche méthode : Le compte rendu de TP. Introduction : Le compte
Introduction : Le compte rendu de TP est un travail écrit. A ce titre il doit être rédigé rigoureusement et débuter par une introduction.
 TP1 chimie.pdf
TP1 chimie.pdf
CHIMIE 2018-2019. 1. TP Chimie n° 1. Règles de travail et de sécurité - Présentation de matériel. 1 PRESENTATION. Dans chaque domaine de travail il y a des
 Polycopie-TP-Chimie-1.pdf
Polycopie-TP-Chimie-1.pdf
UHBChlef - S1 Licence LMD -ST- Polycopie TP Chimie 1 - Dr. Malika OUAGUED Pour chaque TP vous devrez rendre en fin de séance un compte-rendu qui sera ...
 1- PRESENTATION Dans le domaine de chimie il y a des méthodes
1- PRESENTATION Dans le domaine de chimie il y a des méthodes
A. Consignes de sécurité à respecter en TP de Chimie TP 1 Chimie 1. 1 ére année TCM. (2019/2020) ... Compte-rendu (entre 6 -8 pages):.
Page - 0 -
UNIVERSITE HASSAN II Casablanca
F.S.T Mohammedia
Département de Chimie
Les Travaux Pratiques
De Réactivité chimique
MIP / BCG
Année universitaire 2020/2021
Page - 1 -
Table de matière pages
Recommandations générales 2
Rappel de quelques notions générales en chimie en solutionI - principe générale de la volumétrie
I-1 généralités :
I-2 définitions des différents titres normales, massiques et molaires:I-3 le titrage volumétrique :
I-4 dilution
II- matériel employé en volumétrie
Matériel de précision
III- évaluation de la précision du dosage et calcul d'incertitude 4 TP1 : Préparation de solutions et dosage acide base1) Préparation une solution d'acide chlorhydrique 0.1 mol/l.
2) dosage de la solution de soude (hydroxyde de sodium) (solution B)
TP3 : Les dosages d'odžydorĠduction
Dosage de permanganate de potassium par le sulfate ferreux compte rend du TP1 compte rend du TP2Page - 2 -
RECOMMANDATIONS G E N E R A L E S
1) O b j e c t i f s d e s t r a v a u x p r a t i q u e s ( T P )
Acquérir une habilité manuelle permettant de manipuler de façon efficace et précise. La durée des séances des travaux pratiques est largement suffisante pour permettre d'effectuer avec soin le travail expérimental si vous avez prĠparĠ ă l'aǀance votre manipulation du jour et le compte rendu. Toute séance non rattrapée entraine automatiquement une note de 0/20.2) Restrictions concernant les TP
Les séances des travaux pratiques sont obligatoires. Toute absence doit être justifiée dans un délai de 72 h. Le port de blouse en coton est obligatoire, faute de quoi l'étudiant ne sera pas accepté en salle de TP. Les horaires et les groupes sont à respecter. Aucun changement de groupe ne sera autorisé. (Consulter le planning)3) C o n s i d é r a t i o n s g é n é r a l e s
* La façon de travailler est de contribuer efficacement à la sécurité, Il faut travailler calmement, éviter les gestes brusques ainsi que le déplacement inutile ou précipité. Le travail sur une paillasse propre et dégagé de tous les objets inutiles à la manipulation en cours est plus agréable et plus sur de même que l'emploi de verrerie bien nettoyée.* Le matériel mis à votre disposition est fragile et coûteux, il doit être manipulé avec
précaution. Tout bris ou défectuosité de ce matériel par négligence sera sévèrement
sanctionné lors de l'attribution de la note. * Avant de quitter la salle vérifier que : le matériel est parfaitement propre et bien rangé comme indiqué. Les éviers et la paillasse sont propres.Page - 3 -
4) C o n t r ô l e d e c o n n a i s s a n c e
¾ Chaque séance de TP débute avec un contrôle portant sur les connaissances requises pour effectuer le TP. ¾ Un rapport est à rendre à la fin de chaque séance de TP c'est une synthèse de travail réalisé au cours du TP. Il doit présenter clairement les principes utilisés et les résultats des manipulations ainsi que leur interprétation.Il doit mettre les évidences suivantes :
9 L'objectif des TP.
9 Le mode opératoire suivi en précisant la verrerie utilisée.
9 Les équations des réactions chimiques.
9 Les grandeurs mesurées avec les incertitudes sur celles-ci.
9 Les calculs effectués pour trouver la grandeur recherchée.
9 Une conclusion.
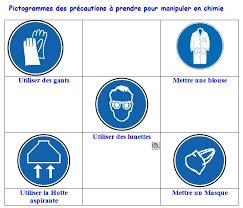
5) S é c u r i t é
Au laboratoire de chimie les principaux risques encourus sont :0 Les brûlures.
Les atteintes oculaires.
] Les coupures.1 Les intoxications.
Dès la première séance, on repérera l'emplacement des extincteurs et douches de sécurité. Le port de lunettes de protection est obligatoire pour certaines manipulations. Il faut pipeter les acides et les bases concentrĠs ă l'aide d'une propipette. Il faut toujours manipuler les acides et les bases concentrés sous la hotte. Il est strictement interdit de fumer dans les salles de TP.Il ne faut jamais manger ou boire au laboratoire.
Page - 4 -
R A P P E L D E Q U E L Q U E S N O T I O N S G é N é R AL E SE N C H I M I E EN S O LUTI ON
I - PR I N C I P E G E N E R A L E D E L A V O L U M E T R I EI-1 GENERALITES :
Le but de dosage est de déterminer le titre NB d'un composé B dans une solution inconnue SB .il consiste à ajouter progressivement un volume VA, d'une solution SA de titre connu, à un volume précis VB de la solution SB. Le titrant peut être un acide, une base, un oxydant, un réducteur, un agent complexant, un composé donnant une réaction exothermique ou un réactif donnant une coloration. a)-Réaction acide base acide1 + H20 ֖ base2 + H20 ֖ (pka2-pka1)Bilan :
acide1 + base2 ֖ (réaction on totale)Par exemples:
CH3COOH + H20 ֖
NaOH Na+ + HO- pka2 (H2O / HO-) =14
CH3COOH + HO-
CH3COO- + H2O K = 10 14 - 4,75 = 10 9.25 > 104
(réaction totale) b)- réaction d'oxydoréduction réduite Ox1 d'un couple redox (Red1/Ox1) vers la forme Red2 d'un autre couple redox (Red2/Ox2). oxydant 1 + n1 e- ֖ réducteur 2 ֖ n2.ox 1 + n1.réd2 ֖Page - 5
Par exemple on veut écrire l'équation de l'oxydation des ions fer (II) par les ions permanganate en milieu acide. On écrira :MnO4- + 5 e - + 8H+ ֖
(Fe2+ ֖MnO4- + 8H+ + 5Fe2+ ֖
c)- réaction de précipitationRéaction au cours de laquelle le mélange de deux solutions aqueuses donnent un composé solide
appelé un précipité. (Ag+, NO3-) + (Na+, Cl-) ֖Ou simplement Ag+ + Cl- ֖
d)- réaction de complexationL : les ligands
Formation d'un complexe facilement détectable.
Cu2+ + 2NH3 ֖
I- 2 D E F I N I T I O N S :
La concentration ou le titre peut s'edžprimer de diffĠrentes faĕons. a) Concentration molaire ou molarité Une solution molaire signifie que C= 1mol/L. Une solution décimolaire C=0,1mol/L. b) Concentration massique ou titre pondéral c) NormalitéPage - 6
4 Exemple : solution normale : N = 1 N solution déci normale : N = 0,1 NSolution cent normale : N = 10-2 N
Equivalent
HCL + H20 Cl - + H30+ p=1 et N = C
Ba(OH)2 Ba2+ + 2OH- p=2 et N = 2C
H3PO4 + 3H2O ֖
MnO4- + 5 e¯ + 8H+ ֖
I-3 TITRAGE :
Pour déterminer le point d'équivalence dans un dosage ou titrage acide-base, deux méthodes sont employées principalement : l'emploi d'indicateurs colorés : colorimétrie ou volumétrie La mesure potentiométrique du pH lors du titrage : pHmétrie.NA. VA = NB. VB
La concentration molaire : CA = ఽ
La concentration massique : CA' = M. CA
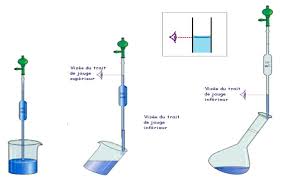
I-4 DILUTION
On peut être conduit à diminuer la normalité initiale Ni d'une solution, par addition d'eaupure : on ajuste la solution à une nouvelle normalité Nf le volume initiale prélevé Vi est
complété à Vf mais le nombre d'équivalents-gramme ne varie pas ; on retrouvera la relation : Ni. Vi = Nf. Vf Ci. Vi = Cf. Vf C'i. Vi с C'f. Vf Vi et Vf étant exprimés avec la même unité.Page - 7
Exemple
préparer 500 mL de solution 0, 02 mol/l de HCl. Réponse : HCl est un monoacide, il libère un seul proton H3O+ (p=1) donc N=CGg = quotesdbs_dbs14.pdfusesText_20
[PDF] compte rendu tp n 2 biologie cellulaire s1 snv
[PDF] compte rendu tp optique geometrique
[PDF] compte rendu tp solution tampon
[PDF] compte service equilibre credit agricole sud rhone alpes
[PDF] compte-rendu de manganimétrie
[PDF] comptoir refrigere avec support de 6 bac
[PDF] compus france maroc
[PDF] compus manar
[PDF] computer math programs
[PDF] conabex ankadifotsy
[PDF] conabex madagascar 2017
[PDF] conabex madagascar 2018
[PDF] concentration massique et molaire
[PDF] concentration molaire calcul
