 Module 4.3 : Déplacement déquilibre
Module 4.3 : Déplacement déquilibre
2CHDF – Correction des exercices. 4. Équilibre chimique. Module 4.3 Stratégie : utiliser la loi de Le Chatelier (le système s'oppose à la modification).
 «EXERCICES ET PROBLEMES CORRIGES DE
«EXERCICES ET PROBLEMES CORRIGES DE
Enfin le Chapitre III est consacré aux équilibres chimiques. Il permettra aux étudiants d'approfondir leurs connaissances notamment sur la loi de le. Chatelier
 Équilibre – le Chatelier
Équilibre – le Chatelier
Équilibre – le Chatelier. 1. L'eau bout dans une bouilloire à 100°C. Le système est-il à l'équilibre ? 2. De l'eau est enfermée dans un récipient clos. L'eau
 Module 5 Équilibre chimique Cahier de lélève
Module 5 Équilibre chimique Cahier de lélève
exercices. - Application du principe de Le Châtelier (Procédé industriel Haber). La principale méthode de fabrication industrielle de l'ammoniac NH3(g)
 Untitled
Untitled
Jumelée au principe de Le Chatelier la loi d'action de masse a des implications étonnantes. mes
 Travail dirigé 9 : Léquilibre chimique
Travail dirigé 9 : Léquilibre chimique
Principe de Le Chatelier. Si on impose une modification (température Cloots ULG
 G. EXERCICES BILAN
G. EXERCICES BILAN
Exercice 1 : Analogie entre équilibres acido-basiques et équilibres de complexation (Application du. Principe de Le Châtelier).
 Lexercice de lautorité parentale dans le cadre du placement
Lexercice de lautorité parentale dans le cadre du placement
• Brigitte ChaTelIer responsable placement familial
 Table des matières
Table des matières
2 - 6 - 2 - Loi de Le Châtelier 7 - 4 - Exercices ..................................................................................................... 255. 7 ...
 Correction exercices évolution
Correction exercices évolution
- car les ions Pb2+ (aq ) ajoutés à l'équilibre ont tendance à être consommés d'après le loi de Le Châtelier. Exercice 17 P216 : 1.- a) CH3COOH (aq) + HCO3.
 Module 5 Équilibre chimique Cahier de lélève
Module 5 Équilibre chimique Cahier de lélève
-Exercices 5-1. Application du principe de Le Châtelier (Procédé industriel Haber) . ... -Loi de l'équilibre chimique ou Loi d'action de masse .
 Les équilibres- exercices supplémentaire avec correction -2017
Les équilibres- exercices supplémentaire avec correction -2017
A 448°C on introduit une demi mole de H2 et 0
 «EXERCICES ET PROBLEMES CORRIGES DE
«EXERCICES ET PROBLEMES CORRIGES DE
exercices d'application concernant la loi du gaz parfait le premier et le second Chatelier
 Module 4.3 : Déplacement déquilibre
Module 4.3 : Déplacement déquilibre
2CHDF – Correction des exercices. 4. Équilibre chimique Stratégie : utiliser la loi de Le Chatelier (le système s'oppose à la modification). Réponses :.
 Équilibre chimique
Équilibre chimique
16 oct. 2021 Exercice 1 : Production industrielle de chaux vive ... vez également utiliser le principe de modération de le Châtelier pour justifier ...
 Travail dirigé 9 : Léquilibre chimique
Travail dirigé 9 : Léquilibre chimique
Loi d'Avogadro et loi de Dalton. - principe de Le Châtelier. - la notion de rendement de réaction. Exercices : 1. Expression Kc Kp et lien avec Q.
 CORRIGES
CORRIGES
Exercices pour s'entraîner 1.1 La loi de conservation de la matière – Loi de Lavoisier ... 1.4 Déplacement d'un équilibre : principe de Le Chatelier.
 Déplacement de léquilibre chimique A) Introduction Lammoniac est
Déplacement de léquilibre chimique A) Introduction Lammoniac est
Ce nouvel état d'équilibre est caractérisé par une concentration plus grande en produit NH3. 3. augmenter la pression. En vertu du principe de Le Chatelier si
 CHAPITRE 7 : LÉTUDE QUALITATIVE DE LÉTAT DÉQUILIBRE
CHAPITRE 7 : LÉTUDE QUALITATIVE DE LÉTAT DÉQUILIBRE
Lequel des énoncés suivants est en accord avec le principe de Le Chatelier ? A. Lorsqu'on augmente la concentration d'un réactif la réaction directe est
 Exercices dentraînement à loral – Corrections –
Exercices dentraînement à loral – Corrections –
La correction de certains des exercices est disponible sur le site de la classe. Concernant u : u et i sont toujours reliés par la loi d'Ohm ...
2CHDF - Correction des exercices4. Équilibre chimique
Module 4.3 : Déplacement d'équilibre
4.3.1.Dans un récipient chauffé à 783 K, on met de l'hydrogène, de l'iode et de l'iodure
d'hydrogène, tous trois à concentration de 2 . 10-3 M. La réaction observée dans le réacteur est : H2 (g) + I2 (g)HI (g) avec K = 46. Indiquez si la quantité d'iodure d'hydrogène aura tendance à augmenter ou non (justification par un calcul).Stratégie : Calculer Q et comparer à K
Réponse : Q=[HI]2
[H2]⋅[I2]=(2⋅103)2(2⋅103)⋅(2⋅103)=1 plus petit que K => HI augmentera encore
4.3.2.La réaction de dissociation de l'acide fluorhydrique (HF) est réversible. Donnez
l'équation de cette réaction et expliquez ce que deviendront les concentrations des réactifs et produits si l'on ajoute à cette solution du NaF ? (réponse qualitative)HFH+ + F-
Comme NaF en solution se dissociera et libérera des ions F-, la concentration en F- augmentera. L'équilibre se déplacera de façon à diminuer la quantité de F- pour rétablir l'équilibre donc il sera déplacé vers la gauche.4.3.3.Prévoir l'effet produit sur l'équilibre des réactions suivantes par
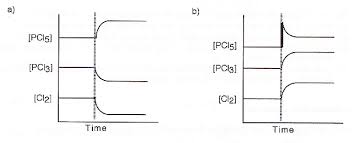
a) une augmentation de température, b) une augmentation de pression.1) PCl5 (g)PCl3 (g) + Cl2 (g)→ réaction endothermique
2) CO (g) + H2O (g)CO2 (g) + H2 (g) → réaction exothermique
3) CaCO3 (s)+ DECaO (s) + CO2 (g)
4) 4 HCl (g) + O2 (g)1 H2O (g) + 2 Cl2 (g) + DE
5) N2 (g) + O2 (g) 2 NO (g)→ réaction endothermique
Stratégie : utiliser la loi de Le Chatelier (le système s'oppose à la modification)Réponses :
1a →1b ←
2a ←2b rien
3a →3b ←
4a ←4b →
5a →5b →
6/72CHDF - Correction des exercices4. Équilibre chimique
4.3.4.L'analyse d'un mélange réactionnel montre qu'il contient exactement au moment où
t = 0.417 mol/L de N2, 0.524 mol/L de H2 et 0.122 mol/L de NH3 à 800 K, température à laquelle K = 0.278 mol-2L2 pour la réaction N2 (g) + 3 H2 (g)2 NH3 (g).Calculez le quotient réactionnel, dites si le mélange réactionnel est à l'équilibre et si
non, précisez si des réactifs ou des produits auront encore tendance à se former.Q=[NH3]2
[H2]3⋅[N2]=(0,122mol/L)2(0,524mol/L)3⋅(0,417mol/L)=0,248mol-2L2 légerement plus petit que K => NH3 augmentera encore légèrement.
4.3.5.Trois gaz sont contenus dans un récipient à une température déterminée et un
équilibre s'est établi selon l'équation suivante :2 NO (g) + O2 (g)2 NO2 (g) → réaction exothermique
De quelle manière les quantités de chacune de ces substances à l'équilibre seront- elles affectées par : Stratégie : utiliser la loi de Le Chatelier (le système s'oppose à la modification) a) une élévation de température, ← b) une extraction de NO du récipient, ← c) une addition de catalyseur,rien (↑ vitesse des 2 réactions) d) une addition de O2,→ e) une réduction de volume du récipient ?→ 7/7quotesdbs_dbs47.pdfusesText_47[PDF] Loi de Mariotte
[PDF] Loi de Newton
[PDF] Loi de Newton : DM pour demain, s'il vous plaît
[PDF] loi de pareto exercice
[PDF] loi de pareto exercice corrigé
[PDF] loi de pareto exercice corrigé pdf
[PDF] loi de poisson cours
[PDF] loi de poisson exercices corrigés pdf
[PDF] loi de poisson probabilité exercice corrigé
[PDF] loi de probabilité 1ere es
[PDF] loi de probabilité 1ere s
[PDF] Loi de probabilité arbre pondéré
[PDF] loi de probabilité binomiale
[PDF] loi de probabilité continue exercices corrigés
