 Chapitre 1 Structure et propriétés de latome - Classification
Chapitre 1 Structure et propriétés de latome - Classification
Il y a 7 couches électroniques connues à l'état fondamental. La couche externe est aussi appelée « couche de valence ». ℓ: nombre quantique orbitalaire ou
 SEMICONDUCTEURS
SEMICONDUCTEURS
La dernière couche appelée couche de valence
 Chapitre I – Structure des atomes
Chapitre I – Structure des atomes
Par exemple pour le chrome (24Cr) : couche externe 4s couche de valence 3d
 Lélément Cobalt
Lélément Cobalt
Préciser le remplissage des sous-couches de valence en le justifiant à l'aide du modèle des cases Cases quantiques de la couche de valence. II-2) Utiliser la ...
 CONFIGURATION ELECTRONIQUE ET TABLEAU PERIODIQUE
CONFIGURATION ELECTRONIQUE ET TABLEAU PERIODIQUE
Li : 1 électron de valence (couche externe n = 2). O : 6 électrons de valence (couche - le numéro de la couche de valence (n° de couche le plus grand) qui ...
 Sans titre
Sans titre
Une liaison covalente est une liaison chimique dans laquelle chacun des atomes liés met en commun un électron d'une de ses couches de valence afin de former un
 15 1. La forte réactivité du sodium est due à sa couche de valence
15 1. La forte réactivité du sodium est due à sa couche de valence
La forte réactivité du sodium est due à sa couche de valence qui n'est pas pleine (1s2 2s2 2p6 3s1). 2. L'atome de sodium Na doit perdre un électron pour
 Introduction aux semi-conducteurs La jonction PN
Introduction aux semi-conducteurs La jonction PN
classification périodique 5 e- sur la couche de valence) en lieu et place d'atomes de Si
 Diapositive 1
Diapositive 1
la couche de valence de l'atome = La couche la plus externe de l'atome fixe les propriétés chimiques (c'est la couche la plus importante). Les couches de
 Proposition de corrige – e preuve de chimie 2019
Proposition de corrige – e preuve de chimie 2019
D'après la règle de Hund le remplissage de la sous-couche 3d est le suivant : 2. Les électrons de valence d'un atome sont ceux occupant les sous-couches de
 LA LIAISON CHIMIQUE 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
LA LIAISON CHIMIQUE 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
dans sa couche interne et 1 e. - sur sa couche externe ou couche de valence; la perte d'un électron laisserait le lithium avec une couche externe complète
 Chapitre I – Structure des atomes
Chapitre I – Structure des atomes
Par exemple pour le chrome (24Cr) : couche externe 4s couche de valence 3d
 Schéma de Lewis
Schéma de Lewis
Il s'agit de la règle de l'octet réduit. Il manque donc 2 électrons de valence (lacune) à ces éléments pour avoir 8 électrons dans leur couche de valence. Une
 Lélément Cobalt
Lélément Cobalt
Le cobalt fait partie des éléments de transition ( couche d en cours d' élaboration). Cases quantiques de la couche de valence.
 SEANCE DE T.D N°3 Exercice 1 : On donne une représentation de
SEANCE DE T.D N°3 Exercice 1 : On donne une représentation de
Le Gallium Ga appartient au même groupe que l'Aluminium Al sa couche de valence est similaire
 Chapitre III : Structure électronique de latome
Chapitre III : Structure électronique de latome
d'une même colonne possèdent des couches de valence (couche externe) identique. Les 18 colonnes de la classification périodique sont réparties en 9 groupes.
 Représenter les couples acide-base
Représenter les couples acide-base
valence (couche externe) des atomes qui la constituent. ? Le schéma de Lewis d'une molécule consiste à représenter tous les doublets.
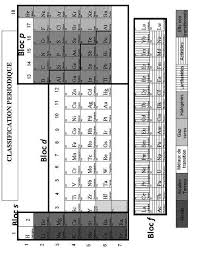
 La classification périodique des éléments
La classification périodique des éléments
de n (couches K L
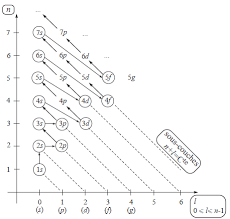
 I. Configuration électronique
I. Configuration électronique
D. Couches de valence et de cœur. Couche de valence : couche la plus externe elle regroupe les OA qui se trouvent à droite de la.
 LA CHIMIE DE LINDIUM
LA CHIMIE DE LINDIUM
le nombre d'électrons de valence est :2 + 6 = 8 a. Éléments dont les orbitales atomiques d sont partiellement remplies. La couche externe présente (au
I. Configuration électronique
sur les orbitales atomiques (OA) de l'atome.A. Règle de Hund
La règle de Hund indique la façon dont les électrons sont distribués dans des cases quantiques
dégénérées.Cette règle énonce que les électrons occupent les cases quantiques avec des valeurs de spin qui
vont maximiser la valeur du spin total.spin identiques, parallèles, tout en respectant la règle de Pauli. Puis on place les électrons de
spin opposé.Remplissage correct : puis
Non respect de la règle de Hund :
Non respect de la règle de Pauli :
B. Règle de remplissage des OA
La hiérarchie des OA est dictée par la règle du " n + l minimum » :Les OA sont classées par valeur croissante de la somme de leur nombre quantique " n » et " l ».
faible. De cette règle découle le diagramme de Klechkowski : Ainsi on trouve la hiérarchie suivante : 1s 2s 2p 3s 3p 4s 3d 4p 5s...Ex : Pour l'Oxygène (Z=8) : [O] = 1s2 2s2 2p4
Pour le Chlore (Z=17) : [Cl] = 1s2 2s2 2p6 3s2 3p5 ss ps ps dps dps fdps fdpsPuis on numérote :
- à partir de 1 pour l'orbitale s - à partir de 2 pour l'orbitale p - à partir de 3 pour l'orbitale d - à partir de 4 pour l'orbitale f1. Le cas des ions
Pour les cations, on Ġcrit d'abord toute la configuration électronique puis on enlève les derniers
électrons écrits.
Attention ͗ les Ġlectrons de l'orbitale 4s seront enleǀĠs aǀant ceudž de l'orbitale 3d
Pour les anions, on rajoute des électrons à la suite de la configuration électronique. Ex : Pour l'ion chlorure : [Cl-] = 1s2 2s2 2p6 3s2 3p6 Pour l'ion sodium, on Ġcrit d'abord la configuration électronique du sodium (Z=11) : [Na] = 1s2 2s2 2p6 3s1Puis on enlève le dernier électron situé sur la couche la plus externe : [Na+] = 1s2 2s2 2p6
UE 1 - Chimie Générale Tut'rentrĠe - Atomistique - Partie 2 Tutorat Chimie G - H2O et Socca (Merci aux précédents tuteurs) Le tutorat est gratuit. Toute reproduction ou vente est interdite. 2 C. Exceptions dans la configuration électroniquey Si l'OA de type d est remplie ou à demie remplie à 1 électron près (d9 ou d4), on force son
remplissage en prenant un Ġlectron de l'OA prĠcĠdente. Ex : Pour le Chrome (Z=24) : [Cr] = 1s2 2s2 2p6 3s2 3p6 4s1 3d5 y Si l'OA de type " d » est totalement remplie (d10), elle passe aǀant l'OA de type " s » précédente. Ex : Pour le Cuivre (Z=29) : [Cu] = 1s2 2s2 2p6 3s2 3p6 3d10 4s1y Les cations formĠs ă partir d'atomes dont les configurations se finissent par 4s2 3dx et 5s2 4dx
voient leurs électrons des OA de type " s » arrachés avant ceux des OA de type d. Ex : Pour le Fer (Z=26) : [Fe] = 1s2 2s2 2p6 3s2 3p6 4s2 3d6 -> [Fe2+] = 1s2 2s2 2p6 3s2 3p6 3d6 Couche de valence : couche la plus externe, elle regroupe les OA qui se trouvent à droite de la première OA portant le " n » le plus élevé. Ex : Pour le Fer (Z=26) : [Fe] = 1s2 2s2 2p6 3s2 3p6 4s2 3d6 Électrons de valence : électrons de la couche de valence.Ex : [Fe] = 8 électrons de valence
Ex : [Fe] = 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Electron célibataire : électron seul dans son OA. nombre d'Ġlectrons. La couche de valence reste écrite normalement.Ex : 26Fe = 18Ar 4s2 3d6
E. Propriétés magnétiques des atomes
On distingue 2 types d'atomes :
Diamagnétiques : ils possèdent autant d'Ġlectrons de spin que de spin െ. Ils ne possğdent donc pas d'Ġlectron cĠlibataire. Diamagnétique -> 2 électrons par case quantiqueParamagnétiques : ils ont un nombre différent d'Ġlectrons de spin et de spin െ.
Ils possèdent donc un ou plusieurs électrons célibataires. Attention : un atome possĠdant un nombre pair d'Ġlectrons n'est pas toujours diamagnétique.Ex : Pour le Carbone [6C] : 1s2 2s2 2p2
Ce qui donne avec les cases quantiques :
-> Le Carbone est paramagnétique. II. Classification des éléments et Tableau périodiqueLes éléments sont classés dans le tableau périodique (ou tableau de Mendéléiev) selon leurs
propriétés chimiques. Ces propriétés chimiques sont directement dictées par leurs électrons de valence. ) Les éléments dont les électrons de valence se trouvent dans les OA de nombre quantique " n » se regroupent dans la ligne N° " n ». Ex : [8O] 1s2 2s2 2p4 -> n=2 -> 2ème ligne du tableau périodique.) Les éléments qui ont " x » électrons de valence se regroupent dans la colonne N° " x ».
Ex : [8O] -> 6 électrons de valence -> 6ème colonne du tableau périodique. possède 2 électrons de valence). Remarque : pour les 2 premières lignes, on considère que la colonne 13 (sur le tableau) correspond à la colonne 3 (pour correspondre à la deuxième règle)2s 2p
UE 1 - Chimie Générale Tut'rentrĠe - Atomistique - Partie 2 Tutorat Chimie G - H2O et Socca (Merci aux précédents tuteurs) Le tutorat est gratuit. Toute reproduction ou vente est interdite. 3On peut alors regrouper les éléments par blocs qui correspondent au type d'OA reprĠsentatiǀes
de leurs électrons de valence.A. Familles d'ĠlĠments
1. Eléments alcalins
Configuration électronique : de type " ns1 » avec n 21ère colonne du tableau périodique (sauf hydrogène)
2. Eléments alcalino-terreux
Configuration électronique : de type " ns2 » avec n 22ème colonne du tableau périodique
3. Eléments halogènes
Configuration électronique : de type " ns2 np5 » avec n 217ème colonne du tableau périodique (avant dernière colonne)
4. Gaz rares ou Gaz nobles
Configuration électronique : de type " ns2 np6 » avec n 118ème colonne du tableau périodique (dernière colonne)
Ces éléments sont très stables car ils ont leur couche de valence totalement remplie.5. Métaux de transition
Configuration électronique : de type " ns2 (n-1)dx » avec n 4 Bloc d (4e, 5e, 6e ligne et de la 3e à la 12e colonne)A connaître : les 3 premières lignes
н la premiğre, l'aǀant derniğre et la derniğre colonne.Moyens mnémotechniques :
2ème ligne : Lili Bésa Bien Chez Notre Oncle Florentin Nestor
1ère colonne : Homme Libre Naît Kelques fois Robuste c'est le Cas en France
17ème colonne : Florentin Claqua Brutalement Irène A terre
18ème colonne : Hercule Négligea d'Arracher le Korsage de Xéna et Ronfla
Astuce pour retrouver facilement le numéro atomique : On peut retrouver facilement les numéros atomiques (qui nous donnent le nombre d'Ġlectrons) en connaissant ceux des gaz rares. En effet, on peut soustraire ou additionner au nombre atomique du gaz rare le nombre de case en bas et de gauche à droite). Ex : le Brome se trouve 1 case avant le Krypton (numéro atomique = 36)Numéro atomique du Brome : 36 - 1 = 35
quotesdbs_dbs11.pdfusesText_17[PDF] council of europe language policy
[PDF] counter in unity pro xl
[PDF] countries grouped by time zone
[PDF] countries sorted by time zone
[PDF] countries that do not believe in god
[PDF] countries that don't believe in christmas
[PDF] countries that don't believe in marriage
[PDF] countries time zone difference
[PDF] countries time zone gmt
[PDF] countries time zones half hour
[PDF] countries with best climate change policies
[PDF] countries with electronic health records
[PDF] country code 33
[PDF] country code 44
