 Modélisation de loxydation catalytique du glucose dans un réacteur
Modélisation de loxydation catalytique du glucose dans un réacteur
Réacteur gaz-liquide-solide fluidisation
 DIPLÔME NATIONAL DE DOCTORAT
DIPLÔME NATIONAL DE DOCTORAT
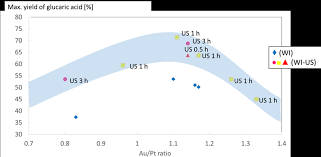
10 mars 2020 L'oxydation aérobie du glucose en acide gluconique a été bien étudiée avec de très bons rendements. Par contre l'oxydation consécutive ...
 dacide gluconique avec un modele
dacide gluconique avec un modele
Cet exemple de biotechnologie blanche traite de la fermentation du glucose en acide gluconique ce qui implique l'oxydation du groupe aldéhyde du sucre en
 Chimie PC
Chimie PC
2 mars 2016 L'enzyme glucose oxydase catalyse l'oxydation par le dioxygène du D-glucose en acide D-gluconique appelés par la suite glucose et acide ...
 SUPPLÉMENT TECHNIQUE /
SUPPLÉMENT TECHNIQUE /
l'acide gluconique d appelé encore acide dex- tronique ou acide maltonique
 SIMULATION DE LA PRODUCTION BATCH DACIDE GLUCONIQUE
SIMULATION DE LA PRODUCTION BATCH DACIDE GLUCONIQUE
L'enzyme qui catalyse l'oxydation du glucose est une déshydrogénase capable de transformer le glucose en gluconolactone. L'acide gluconique est produit par
 Première activité: Notion denzyme.
Première activité: Notion denzyme.
Cette oxydation produit du gluconolactone (qui se transforme spontanément en acide Gluconique) et de l'eau oxygénée. D-Glucose. +O2 +H2O-------G.O.D-------->
 Propriétés antibiotiques naturelles du miel
Propriétés antibiotiques naturelles du miel
L'eau oxygénée et l'acide gluconique résultent de l'oxydation de l'eau et du glucose. Cette oxydation est provoquée par la glucose-oxydase. La glucose-.
 CONCLUSIONS
CONCLUSIONS
7 févr. 2007 ... glucose-oxydase / peroxydase. La glucose-oxydase catalyse l'oxydation du glucose en acide gluconique et peroxyde d'hydrogène. La peroxydase ...
 Électrodes enzymatiques à base dhydrogels rédox en vue de l
Électrodes enzymatiques à base dhydrogels rédox en vue de l
17 mai 2011 LES ENZYMES EMPLOYEES POUR L'OXYDATION DU GLUCOSE.…….………10. 1.1 ... des acides organiques (acide lactique gluconique
 Modélisation de loxydation catalytique du glucose dans un réacteur
Modélisation de loxydation catalytique du glucose dans un réacteur
Reçu le 27 octobre 1999 accepté le 21 janvier 2000. L'oxydation catalytique du glucose permet d'obtenir de l'acide gluconique et d'autres acides. La réaction
 DIPLÔME NATIONAL DE DOCTORAT
DIPLÔME NATIONAL DE DOCTORAT
10 mar. 2020 aérobie du glucose en acide gluconique a été bien étudiée avec de très ... l'oxydation consécutive beaucoup plus lente de la fonction alcool ...
 LES GLUCIDES
LES GLUCIDES
Ainsi le glucose donne l'acide gluconique
 Exemple Application
Exemple Application
Cet exemple de biotechnologie blanche traite de la fermentation du glucose en acide gluconique ce qui implique l'oxydation du groupe aldéhyde du sucre en
 Chimie PC
Chimie PC
2 mar. 2016 L'enzyme glucose oxydase catalyse l'oxydation par le dioxygène du D-glucose en acide D-gluconique appelés par la suite glucose et acide ...
 DS2 Chimie des solutions (15 h) I. Préparation dune solution
DS2 Chimie des solutions (15 h) I. Préparation dune solution
2 déc. 2016 acide gluconique ou en ion gluconate selon le pH de la solution. ... Ecrire la demi-équation correspondant à l'oxydation du glucose à pH = 0 ...
 Le corrigé
Le corrigé
L'enzyme glucose oxydase catalyse l'oxydation par le dioxygène du D-glucose en acide D-gluconique appelés par la suite glucose et acide gluconique.
 CONCLUSIONS
CONCLUSIONS
7 fév. 2007 La glucose-oxydase catalyse l'oxydation du glucose en acide gluconique et peroxyde d'hydrogène. La peroxydase catalyse l'oxydation d'un ...
 Glucose-TR
Glucose-TR
13 sept. 2013 Le glucose oxydase (GOD) catalyse l'oxydation du glucose en acide gluconique. Le peroxyde d'hydrogène (H2O2) produit se détache au.
 EMPLOIS DE LACIDE GLUCONIQUE DANS LINDUSTRIE LAITIÈRE
EMPLOIS DE LACIDE GLUCONIQUE DANS LINDUSTRIE LAITIÈRE
l'acide levogyre et l'acide racémique; les deux premiers correspon- dant à l'oxydation du d-glucose et du l-glucose et le troisième.
1 PCSI Devoir Surveillé 2 Jeudi22novembre2018 Cinétiqueformelle&MécanismesréactionnelsLecorrigéL'usagedescalculatricesestautorisé.Ledevoirdure2h.PREMIER EXERCICE OXYDATIONDESCORPSGRASL'équationdelaréactiond'oxydationdulinoléatedeméthylepeuts'écriresimplement:
2 LH+O2=LOOHDanslesconditionsdel'étuderéalisée,lemécanismedecetteoxydationdesacidesgrasinsaturés,notésdonciciLH,parledioxygènemetenjeulesactesélémentairessuivants:oùA-N=N-Areprésentel'initiateurderadicauxetLHreprésentelecorpsgrasinsaturénommélinoléatedeméthyle.1) Justifierenquoilesuivite mporeldela concentrationendiox ygèneestune mesureindirectedelaconsommationdelinoléatedeméthyleaucoursdutemps.Commeledioxygèneréagitaveclelinoléate,suivrel'évolutiondelaconcentrationendioxygènepermetdesuivreindirectementcelleenlinoléate.Lavitessevdelaréactionestdéfiniecommelavitessededisparitiondudioxygène.2) Exprimerv=-d[O2]/dtàpartirdumécanismeréactionnel.D'aprèslesétapesdumécanismeréactionnel:- ���������������= ���������•������+���������������•������������+���������•������3) Enappliquantl'AEQSauxdifférentsintermédiairesréactionnelsA•,AOO•,LOO•etL•,exprimerlavitessevprécédente.������•������=���=���������������=������- ���������•������������������•������=���=���������•������- ���������������•������������
3 ������������•������=���=���������������•������������- ���������������•������+���������•������-������������������•���������•������=���=���������������•������-���������•������Effectuonsdésormaisl'AEQSglobaleenfaisantlasommedes4AEQSprécédentes:���=���������������=������- ������������������•���Ilvientainsi:���������•=������������������=������������Revenonsàl'expressiondelavitessevdedisparitiondudioxygène:-���������������= ���������•������+���������������•������������+���������•������delapremièreAEQS,nousendéduisonsque:���������•������= ���������������=������enfaisantlasommedesdeuxpremièresAEQS:���������������•������������= ���������������=������Alors:-���������������= ���������������=������+���������������=������+���������•������-���������������= ���������������=������+���������������=������+������������������������=������������������Ennégligeantlesdeuxpremierstermes,provenantl'undel'étape(1),l'autredel'étape(3),alorsilvient:���= -���������������=������������������������=������������������
4 4) Montrerquevpeutsemettresouslaformev=k[LH][A-N=N-A]1/2sil'onn égligedeuxde stermesdel'expressionprécédente.Aqu ellesétapes(initiation,propagationourupture)appartiennentcesdeuxtermesdontlacontributionestnégligée?���=������������������������=������������������Lesdeuxter mesnégligésap partiennentauxét apesavantlapropagation, doncauxétapesd'initiation,ouplusprécisémentàl'étaped'initiationetàuneétapeappeléeétapedetransfert(pasattendudansledevoir).5) Donnerl'expressiondekenfonctiondesconstantesdevitessedumécanisme.Paridentification:���=������������������SECOND EXERCICE CINÉTIQUEDERÉACTIONDENOOns'intéresseàlaformationdudimèreN2O4àpartirdeNO,pourlaquelleonproposelemécanismedécritfigure2.Lesdeuxétapessontdesactesélémentaires.L'étape(a)estunpré-équilibrerapide,deconstanted'équilibreK°1.L'étape(b)estl'étapecinétiquementdéterminante(oulimitante).1) ExprimerlavitessedeformationdeN2O4enfonctiondekb,[NO]et[NO3].
5 Commel'acte(2)estunacteélémentaire,alorslaréactionobéitàlaloideVan'tHoff:���= ���������������������=���������������������2) Montrerquelavitesse deformation deN2O4peuts'écr irev=γ.[NO] α.[O2]β.Donnerlesexpressions deα etβetexpliciter γenfonctiondes différentesconstantesdel'énoncé.���= ���������������������=���������������������danscetteloidevitesse,ilapparaîtlaconcentrationenintermédiaireréactionnelNO3;oronnousditquel'équilibreinitialestunpré-équilibrerapide,doncnouspouvonsutiliserlarelationdeGuldbergetWaageappliquéeàcetéquilibre:���°���= ���������������������Alors:���������= ���°���������������Ainsi:���= ���������������������=���������°������������������������= ���������������������=���������°������������������
6 Onpeutaussidirequel'équilibre(1)s'établissanttrèsvite:lesvitessesdesréactionsdanslesensdirectetindirectsontlesmêmes:������= ������������=���′������������Alors:���������′���= ���������������������etvpeutaussis'écrire:���= ���������������������=���������������′������������������Alorsonpeutendéduire:���=��� ; ���=��� ; ���=���������������′���= ���������°���TROISIEME EXERCICE OXYDATIONDUGLUCOSECinétiquedelaréactiond'oxydationduglucosecatalyséeparlaglucoseoxydaseLesenzymessontdescatalyseursbiologiquesquicomportentunsiteactifsurlequelsefixelesubstrat(réactif)ets'opèrelatransformationenproduit.Lastructuredusiteactifestspécifiquedelaréactionqu'ilcatalyseetelleretrouvesaformeinitialeaprèslibérationdu(oudes)produitsformés.L'enzymeglucoseoxydasecatalysel'oxydationparledioxygèneduD-glucoseenacideD-gluconique,appelésparlasuiteglucoseetacidegluconique.Figure1pourinformation,structuresspatialesdesformeslinéairesduD-glucoseetdel'acideD-OH
H OHOHOHOHOH
H HH OH OH OHOHOHOHOH
H HHD-glucoseacide D-gluconique
7 gluconiqueRôled'uncatalyseurLeprofilréactionneld'uneréactionestreproduitfigureAdudocumentréponsequevousn'oublierezpasderendreavecvotrecopie.1) Quelle(s)information(s)fournitceprofilréactionnelsurlaréaction:s'agit-ilduprofild'unacteélé mentaire?Yplac er l'énergied'activati on(oulesénergiesd'activation)?Yfairefigurerle(s)intermédiairesréactionnel(s)etdemêmepourle(s)état(s)detransition.Commeilyapassageparunmaximumd'énergiepotentielunique,ils'agitlàduprofilénergétiqued'unacteélémentaire.L'énergied'activationyfigure:ellereprésenteladifférenced'énergieentrecelledel'étatdetransitionetcelledesréactifs.2) Tracer,surcettefigure,l'allured'unprofilréactionneldecettemêmeréactioncatalysée.Yfairefigurerle(s)intermédiairesréactionnel(s)etdemêmepourle(s)État de
transition Ea8 état(s)detransition.Silaréactionestcatalysée,ellesedérouleenaumoinsdeuxétapes.Lecatalyseurpermetd'augmenterlavitessedelaréac tionen abaissantl'énergied'ac tivation :l' énergied'activationdupremieracte(conduisantàl'intermédiaireréacti onnel )etcelledusecond(àpartirde l'interméd iaireréactionnel)s ontplus petitesquecelledel'acteélémentairereprésentantlamêmeréactionsanscatalyseur.3) Expliciterl'influencedelacatalysesurlathermodynamique(bilansdematièrefinaux)etlacinétiqued'uneréaction.Lacatalysenemodifieenrienl'aspectthermodynamiqued'uneréaction;Lacatalyseaugmentejustelavitessed'uneréaction:iln'intervientquesurl'aspectcinétiqued'uneréaction.Modélisationdel'oxydationduglucoseparlemodèledeMichaelis-MentenÀ20°CetensolutionàpHtamponnéégalà7,ondétermineexpérimentalement,pourdifférentesconcentrationsinitia lesenglucose,lavitesseinitial ev0dela réactiond'oxydationduglucoseparledioxygènecatalyséeparlaglucoseoxydase;laglucoseÉtat de
transition 1 Ea1État de
transition 2Intermédiaire
Réactionnel
Ea29 oxydaseestintroduiteenproportionscatalytiquesparrapportauglucose.Lacourbetracéefigure2représentel'évolutiondela vitesseinitialedecetteréaction.Laconcentrationendioxygènedissousresteconstante.Figure2Évolutiondelavitesseinitialed'oxydationduglucoseLemodèle choisipourrendr ecomptedelacinétiq uedelaréact iond'oxydationduglucoseparledioxygène,catalyséeparlaglucoseoxydase,estceluideMichaelis-Mentenquiestundesmodèlesdemécanismeréactionnellespluscourammentutiliséspourlesréactionscatalyséesparuneenzyme.Cemécanismes'écrit: ��� + ��� !!! !! ������������ !! ��� + ���oùEdésignel'enzyme(glucoseoxydase),Slesubstrat(glucose),ESlecomplexeenzyme-substratforméetPleproduit(acidegluconique)etoùka,k'aetkbsontlesconstantescinétiquesdesdifférentesétapes.Levolumeréactionnelestsupposéconstantaucoursdelatransformationduglucoseenacidegluconique.Onnote[X]laconcentrationdel'espèceXdanslemilieuréactionnelàuninstanttdonnéet[X]0cetteconcentrationàl'instantinitial.Leschémadelafigure3représentel'évolutiontemporelledesconcentrationsdusubstrat(S),duproduit(P),del'enzyme(E)etducomplexeenzyme-substratformé(ES)aucoursdelaréactionpourdesvaleursrelativesdeconstantesdevitesseka,k'aetkb.
10 Figure3ÉvolutiondelaconcentrationdesespècesmisesenoeuvredanslemodèledeMichaelis-MentenLemodèledeMichaelis-Mentenprésentetroiscaractéristiquesprincipalesauniveaucinétique:- pouruneconcentrationinitialedonnéedesubstrat,notée[S]0,lavitesseinitialedeformationduproduitestproportionnelleàlaconcentrationtotaledel'enzyme,[E]0;- pouruneconcentrationtotaledel'enzyme[E]0etunefaibleconcentrationinitialedesubstrat[S]0,lavitesseinitialedeformationduproduitestproportionnelleà[S]0;- pouruneconcentrationtotaledel'enzyme[E]0etuneforteconcentrationinitialedesubstrat[S]0,lavitesseinitialedeformationduproduitdevientindépendantede[S]0etatteintunevaleurmaximalevmax.ÀproposdesrésultatsexpérimentauxL'équationdelaréactiond'ox ydationd uglucos eparledioxygènecatalys éeparlaglucoseoxydaseest:C6H12O6(aq)+6O2(aq)=6CO2(g)+6H2O(aq)4) Commentobtenirexpérimentalementlavaleurdelavitesseinitiale?Laréponsepourras'appuyersurunschéma.Onpeutcalculerlavitesseinitialeàpartirdeladéterminationdelatangenteàlacourbeent=0:lavitesseinitialeestl'opposéedecettedérivée:
11 ÀproposdumodèleLemodèle choisipourrendreco mptedelaciné tiquedelaréaction d'oxydationduglucoseparledioxygèneestceluideMichaelis-Mentenetils'écrit: ��� + ��� !!! !! ������������ !! ��� + ���5) Préciserpourquoil'approximationdesétatsquasi-stationnairesestapplicableàl'espèceESetsurquelintervalledetemps.Justifier.L'approximationdesétatsquasi-stationnairesestapplicableàl'Interméd iaireRéactionnelEScarexceptélespremiersinstantsdelaréaction,saconcentrationesttrèstrèsfaibleaucoursdutemps,etpresqueconstante:onpeutdoncluiappliquerl'AEQS:���������������=���Achaqueinstantt,onpeutécrirepourl'enzymeE:[E]0=[E]+[ES]
12 6) Quetraduitcetteégalité?Cetteégaliténet raduitriend'autreque lacons ervationdelamatière, àsavoirlaconservationdel'enzymequi,àladatet,estsoitengagéedanslecomplexeES,soitlibre.7) Sachantquel'enzymeestintroduiteenproportionscatalytiques(doncentrèstrèspetitequantité)parrapportauglucose,quepeut-ondiredelaconcentrationduglucoselibre[S]parrapportàlaconcentrationtotaleduglucose,notée[S]0?Sil'enzymeestentrèstrèspetitequantité,ilestpossiblededirequelaconcentrationenglucoseestàpeuprèsconstanteetdonclaconcentrationenglucoselibreestpresqueégaleàcelleenglucoseinitial:[S]=[S]08) Montrerquel'expressiondelavitessevdanslecadredecemodèlepeuts'écrire:���= ���!"#.[���]���!+[���]ExprimonslavitessevdeformationduproduitP:���= ������������=������������Or:[E]+[ES]=[E]0Etl'AEQSadonné:���������������=���= ������������-���′���������-������������Utilisonslaconservationdelamatièrepourexprimer[E]enfonctionde[E]0etde[ES]:
13 ���������������=���= ������������-���������-���′���������-���������������������������=���= ��������������� -���������������-���′���������-������������Alors:������= ������������������������+���′���+������ Soitaussi,pouravoiruneexpressioncommençantàressembleràcelledel'énoncé:������= ������������������′���+������+ ��������� Ainsireportéedansl'expressiondev,nouspouvonsécrire:���= ������������=������������= ������������������������′���+������+ ���������Celapeutsesimplifierparka:���= ������������=������������= ������������������!���!������������+������= ������������= ������������������!���!������������+���Ainsi,paridentif ication,nou savonsbienuneloidevitessedelaformede laloiproposée.9) Préciserl'expressiondevmaxetdeKmenfonctiondesconstantesdevitesseska,k'aetkb.
14 ���= ������������= ������������������!���!������������+���Ainsi,paridentif ication,nou savonsbienuneloidevitessedelaformede laloiproposéeenposant:������������= ������������������= ���′���+������������ Confrontation des résultats expérimentaux et du modèle 10) Quelle(s)caractéristique(s)cinétique( s)dumo dèledeM ichaelis-Mentenrend(ent)comptedesrésultatsexpérimentauxobtenus? ���= ������������= ������������������!���!������������+���Ainsi,paridentif ication,nou savonsbienuneloidevitessedelaformede laloiproposéeenposant:������������= ������������������= ���′���+������������Lestroiscaractéristiquesdonnéesdansl'énoncésont:Lemodèle deMichaelis-Mentenprésentetrois caractéristiquesprincipalesauniveaucinétique:- pouruneconcentrationinitialedonnéedesubstrat,notée[S]0,lavitesseinitialedeformationdup roduitest proportionnelleàlaconcen trationtotaledel'enzyme,[E]0;
15 ���= ������������= ������������������!���!������������+���Lorsquenoussommesprochesdet=0:������= ���������������!���!���!������������+���!= ���������!���!���!������������+���!������=������������ × ������OK- pouruneconcentrationtotaledel'enzyme[E]0etunefaibleconcentrationinitialedesubstrat[S]0,lav itesseini tialedeformation duproduitestproportionnelleà[S]0;Laconcentrationensubstratestfaible:alorsaudénominateur,[S]0estnégligeable:������= ���������������!���!���!������������+���!≈���������������!���!���!������������= ���������������!���!���!������������= ���������������!���!������������ ×���!OK- pouruneconcentrationtotaledel'enzyme[E]0etuneforteconcentrationinitialedesubstrat[S]0,lavitesseinitialedeformationduproduitdevientindépendantede[S]0etatteintunevaleurmaximalevmax.Laconcentrationensubstratestforte:alorsaudénominateur,[S]0trèsgrand:������= ���������������!���!���!������������+���!≈���������������!���!= ������������= ���!"#OK:lavitesseestcettefoislimitéeparlaconcentrationtotaleenenzymeE. 11) Proposeruneestimationde lavaleurex périmentaledevmaxpourlaréactiond'oxydationduglucosecatalyséeparlaglucoseoxydase. Plaçonsnousàl'instantinitial,alors[S]=[S]0etdanscecas:������= ���������������= ���������������������!���!������������+������soit:
16 ������= ���������������= ������������������������+������������= ������������������������+������Si[S]0esttrèsgrandalorsceladevient:������= ���������������������+������= ������������������������= ������������ Alorsvmaxestlalimitehorizontaledelacourbereprésentéefigure2:vmaxestvoisinede3,7-3,8µmol.L-1.min-1.Àpartirdesrésultatsexpérimentaux(figure2),onréaliseletracédeLineweaver-Burk,courbereprésentativede!!!enfonctionde![!"#$%&']!(figure4).Lacourbeestajustéeparunefonctionderéférenceaff ine,lec arréducoefficientdecor rélationlinéaireassociér2est0,9988.12) Endéduireunesecondeestimationdelavaleurdevmax.Commentercerésultatetdiscuterdeladonnéeducarréducoefficientdecorrélationlinéairer2pourlavalidationdumodèledeMichaelis-Mentenpourcetteréaction. Figure 4 Tracé de Lineweaver-Burk pour la réaction d'oxydation du glucose
17 Reprenons:������= ������������������������+������Etprenonsl'inversedesmembresdegaucheetdedroite:���������= ������+���������������������������������= ������������������������+���������������������������������= ������������������������+���������������Visiblement,l'ordonnéeàl'originedeladroitetracéeestl'inversedevmax:���������������=���,������������vmax=5,37µmol.L-1.min-1.Lavaleurestassezéloignéedelapremièreproposition,maislecoefficientderégressionaucarrévalidecemodèlelinéaire.Nousdonneronsplusdepoidsàcettedéterminationqu'àlapremière,quireposaitsurletracéd'uneasymptoteencoreincertaine.QUATRIÈME EXERCICE REACTIONDESAPONIFICATIONOnsouhai tedéterminerparconductimé trie,l'ordreglobaldelaré actiondesaponificationdupropanoated'éthyle,ainsiquel'énergied'activationdelaréaction.Cetteréactiondesaponificationapouréquation:
18 C2H5CO2Et+HO-=C2H5CO2-+EtOHÉtudethéorique:résolutiondel'équationdifférentielleOnnote:alaconcentrationinitialeenesteretblaconcentrationinitialeenionhydroxyde;xl'avancementvolumiquedelaréaction:x=[C2H5CO2-]àladatet;αl'ordrepartielenesteretβl'ordrepartielenionhydroxyde;nl'ordreglobaldelaréaction;klaconstantedevitesse;1) Exprimerlavitessevolu miquedel aréactionenfonction delaconstantedevitesse,desconcentrationsinitiales,del'avancementvo lumiqueetdesordrespartiels.Enutilisantlesnotationsdutexte,nousauronsdonc:���= ���.������������������������������������!������= ���.���-���������-������or:���= ������������������������!������= ������������Doncfinalement:���= ������������= ���.���-���������-������2) Établirl'équationdifférentiellesurxenfonctiondek,a,b,αetβ.C'estcequenousvenonsdefaire:���= ������������= ���.���-���������-������Cetteéquationsesimplifieensupposantquel'esteretl'ionhydroxydesontintroduitsen
19 proportionsstoechiométriques.3) Enfaisantl'hypothèsed 'unordreglobalde2,montrerquelaso lutiondel'équationdifférentielleconduitaurésultatsuivant:tka
xa xSia=b(proportionsstoechiométriques):���= ������������= ���.���-���������-������= ���.���-������!���Commeelleestd'ordre2:���= ������������= ������-������Séparonslesvariablesetintégrons:���= ���������-������= ���.���������������-������������!���= ���.������������soit:������-��� - ������= ���.���Réduisonsaumêmedénominateur:������(���-���) - ���-������(���-���)= ���.���������(���-���)= ���.���Cequidonnebienaussi:������-���= ���.���.���Déterminationdel'énergied'activation
20 Onréaliseplusieursmanipulationsdanslesconditionsdécritesci-dessuspourquatretempératuresdifférentes:35°C,40°Cet50°C.4) Rappelerl'expressiondelaconstantedevitessekselonlaloid'Arrhenius.Loid'Arrhénius:���������(���)������ = ���������������cequi,intégrée,donne:������=���.���!������������ 5) Quellesignificationphysiquepeut-ondonneràl'énergied'activation?L'énergied'activationestl'énergieminimalequedoiventposséderlesréactifsafind'êtretransformerenproduits;elle permetainsiau systèmeinitiald epasserlecolcorrespondàl'étatdetransition(oucomplexeactivé).Lesvaleurs delaconstantedevite sseselon latempé raturesontrapportéesdansl etableausuivant:θ(°C)354050k(mol-1.L.s-1)0,1880,2570,4776) Calculerl'énergied'activationEadelaréaction.������=���.���!������������Passonsàlaformelogarithmiquedecetteexpression:������������=���������-������������������������=���������-���������.������
21 Ainsi,letracéde Ln(k(T))enfo nction de1/Tconduitàunedr oit edontlecoefficientdirecteurestégalà!���������Effectuonscetracéenmêmete mpsqueno usrechercheronsl' équation deladroitederégression:θ/°CkT/K1/TLn(k)350,1883080,003246753-1,6713133400,2573130,003194888-1,3586791500,4773230,003095975-0,7402387Ainsilapenteest:-Ea/R=-6185,3Onendéduit:Ea=51,4.103kJ.mol-1
y=-6185,3x+18,408R²=0,99992Ln(k)=f(1/T)
Ln(k)Linéaire(Ln(k))
22 Données:R=8,314J.K-1.mol-1Onprendraici:T/K=θ/°C+273
quotesdbs_dbs48.pdfusesText_48[PDF] oxydation du glucose equation
[PDF] oxydation du glucose par le dioxygène
[PDF] oxydation ménagée des alcools exercices corrigés
[PDF] oxyde de sodium
[PDF] oxydo reduction
[PDF] Oxydo-réduction
[PDF] Oxydoréduction
[PDF] oxydoréduction
[PDF] oxydoréduction 1ere s
[PDF] oxydoréduction cours 1ere s
[PDF] oxydoréduction cours pdf
[PDF] Oxydoréduction et potentiel pris par une électrode
[PDF] oxydoréduction exercices corrigés bac pro
[PDF] oxydoréduction exercices corrigés pdf
