 Les corps composés
Les corps composés
Les valences permettent dans certains de cas de prévoir les formules de corps com- – Le groupe 1 correspond à l'un des groupes bleus du tableau des groupes.
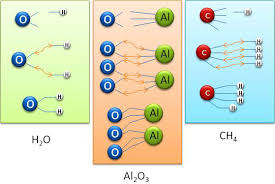 La valence
La valence
(Les autres 3 à 11 ont des valences particulières). Les atomes sont classés en colonnes dans le tableau périodique et celles-ci peuvent être © La chimie.net – ...
 Valences
Valences
Elle sera illustrée par l'association de carbone (C) et d'oxygène. (O). Etape 1 : Recherche les symboles et les valences de chaque atome dans le tableau
 La classification des << corps simples >> par la loi périodique
La classification des << corps simples >> par la loi périodique
24 sept. 2020 C. R. Chimie 2020
 Physico-chimie du plutonium
Physico-chimie du plutonium
ionique (tableau III). 120. RADIOPROTECTION. Page 7. PHYSICO-CHIMIE DU PLUTONIUM. TABLEAU III. Rayons des états de valence 3 à 6 du plutonium. Etat d'oxydation.
 Chimie Générale (Chimie 1)
Chimie Générale (Chimie 1)
23 déc. 2020 Valence d'un atome. Dans le tableau 5 sont représentées les valences de quelques atomes et leurs structures de. Lewis correspondantes.
 Fiché N°1.1 Basés dé la chimié
Fiché N°1.1 Basés dé la chimié
En t'aidant du tableau périodique donne le nombre d'électrons de valence ainsi que la Utiliser le tableau périodique : Bases de la chimie. Déterminer l'ion ...
 La chimie
La chimie
• chaque colonne (groupe) du tableau périodique moderne partage la même électrons de valence (n = 3 pour l'atome et n = 2 pour le cation
 REORIENTATION ET ADMISSION EN LICENCE DES ELEVES
REORIENTATION ET ADMISSION EN LICENCE DES ELEVES
L2 CHIMIE/ Chimie-biologie (Valence) · DSDA. X hc. L2 ELECTRONIQUE ENERGIE En fonction de la classe de CPGE1
 Le tableau de Mendeleïev
Le tableau de Mendeleïev
de chimie pure et appliquée (IUPAC). Les défis du CEA Octobre 2016 N°211. Aude Ganier Claire Abou et Michel Szlazac (infographie)
 lachimie.net.valence.pdf
lachimie.net.valence.pdf
Comment connaître la valence d'un atome ? Les valences des éléments des groupes 12 et 13 à 18 peuvent être déterminées à l''aide du tableau périodique.
 lachimie.net.memodebase.pdf
lachimie.net.memodebase.pdf
Les bases de la chimie à mémoriser … 1. Symbole et nom des éléments formation d'une molécule il suffit d'inverser les valences des éléments.
 COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
dépendent des nombres quantiques n l et m (voir cours de chimie générale même valence
 Chimie Générale (Chimie 1)
Chimie Générale (Chimie 1)
Dans le cas de la molécule de CCl4 ?C =2
 Cours de Chimie Structure de la matière
Cours de Chimie Structure de la matière
et ainsi aux étudiants de L1 (Génie électrique Physique
 Éléments chimiques - Numéros atomiques - Masses molaires
Éléments chimiques - Numéros atomiques - Masses molaires
Nom. Symbole. Z. Masse molaire Nom. Symbole. Z. Masse molaire aluminium. Al. 13. 2698 lithium. Li. 3. 6
 wikipedia : tableau périodique des éléments
wikipedia : tableau périodique des éléments
wikipedia : tableau périodique des éléments. Règle de Klechkowski : Sous-couche 1s 1 case quantique ? 2 électrons. ? 2 éléments sur la 1re période.
 LES COMPOSÉS FONCTIONNELS 1- Définitions 1-1- Fonction
LES COMPOSÉS FONCTIONNELS 1- Définitions 1-1- Fonction
Les Cahiers de Chimie Organique pour les Étudiants en Licences On appelle valence d'une fonction le nombre d'atomes d'hydrogène substitués sur le ...
 Rappels atomistiques structure des métaux
Rappels atomistiques structure des métaux
http://campus.cerimes.fr/odontologie/enseignement/chap1/site/html/cours.pdf
 [PDF] La valence - Lachimienet
[PDF] La valence - Lachimienet
Les valences des éléments des groupes 12 et 13 à 18 peuvent être déterminées à l''aide du tableau périodique (Les autres 3 à 11 ont des valences particulières)
 [PDF] Le tableau de Mendeleïev - CEA
[PDF] Le tableau de Mendeleïev - CEA
Conçu en 1869 par le chimiste russe Dimitri Ivanovitch Mendeleiev le tableau périodique classe tous les éléments chimiques selon leur numéro atomique et leurs
 [PDF] Le tableau périodique - La chimie
[PDF] Le tableau périodique - La chimie
chaque colonne (groupe) du tableau périodique moderne partage la même configuration électronique pour ses électrons de valence
 [PDF] Les corps composés
[PDF] Les corps composés
Nom Groupe Valence Hydoxyde OH 1 Nitrite NO2 1 Nitrate NO3 1 Carbonate CO3 2 Sulfite SO3 2 Sulfate SO4 2 Phosphate PO4 3 Ammonium
 [PDF] Tableau périodique des éléments chimiques (2016)
[PDF] Tableau périodique des éléments chimiques (2016)
Actualisé en 2016 selon recommandations de l'Union Internationale de Chimie Pure et Appliquée Tableau périodique des éléments Numéro atomique
 [PDF] Éléments chimiques - Masses molaires atomiques ( - Nicole Cortial
[PDF] Éléments chimiques - Masses molaires atomiques ( - Nicole Cortial
Nom Symbole Z Masse molaire Nom Symbole Z Masse molaire aluminium Al 13 2698 lithium Li 3 694 antimoine Sb 51 12175 magnésium
 [PDF] Chimie - Fiche de synthèse n°1 - sciences
[PDF] Chimie - Fiche de synthèse n°1 - sciences
Comment connaître la valence d'un atome ? Les valences des éléments des groupes 12 et 13 à 18 peuvent être déterminées à l''aide du tableau périodique
 [PDF] Chapitre II: La classification périodique (Tableau périodique)
[PDF] Chapitre II: La classification périodique (Tableau périodique)
Les Azotides possèdent 5 électrons de valence ils ont tendance à gagner 3é pour former une charge -3 : N3- ; P3- La SEE est de type ns2 np3 La colonne 16 :la
 [PDF] Tableau périodique de Mendele??ev
[PDF] Tableau périodique de Mendele??ev
les lignes du tableau périodique sont nommées « périodes » et sont identifiées par la valeur du nombre quantique principal « n » de la couche de valence
Comment savoir la valence d'un élément ?
Pour connaître la valence d'un élément, il faut regarder le tableau de périodique. On aperçoit au passage que les symboles ne sont pas disposés n'importe comment mais dans des colonnes avec à leur tête des chiffres romains.Quels sont les valences des éléments chimiques ?
Nomenclature et répartition des valences des éléments
valence 0 : He, Ne, Ar, Kr, Xe, Rn ;valence I (élément univalent ou monovalent) : H, Li, Na, K, Rb, Cs, Fr, Cu, Ag, Au, F, Cl, Br, I ;valence II (élément bivalent ou divalent) : Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd, Pt, Hg, Sn, Pb, O, Se, Te, C ;Quelle est la valence d'un atome ?
La valence d'un atome détermine le nombre d'autres atomes auxquels il peut se lier. Par exemple, une valence de 1 indique qu'un atome ne peut se lieu qu'à un seul autre atome, une valence de 3 indique qu'il peut se lier à trois autres atomes, etc.- Dans le tableau périodique, les éléments sont rangés par numéro atomique Z croissant. Une nouvelle ligne est ouverte à chaque fois que la configuration électronique fait intervenir une nouvelle couche. Dans chaque colonne on a le même nombre d'électrons sur la couche externe.
3456789101112131415161718
SEL 1 HHydrogène
2 HeHélium
La 57Ac 89
NeFO
NéonFluorOxygène
678910
CNAzoteCarbone
B 5 Bore ArCl SArgonChloreSoufre
1415161718
Si PPhosphoreSilicium
Al 13Aluminium
Lanthane
Actinium
Li 3 Be 4Lithium Bérylium
11 Mg 12 NaSodium Magnésium
Potassium
19 Ca 20 37Sr 38
55
Ba 56
87
Ra 88
K Rb Cs Fr
Calcium
Rubidium Strontium
Césium Baryum
Francium Radium
Ti 22Zr 40
Hf 72
104
Titane
V 23Vanodium
Cr 24Chrome
Mn 25Manganèse
Fe 26Fer Co 27
Cobalt
Ni 28Nickel
Cu 29Cuivre
Zn 30Zinc Nb 41
Niobium
Mo 42Molybdène
Tc 43Technétium
Ru 44Ruthénium
Rh 45Rhodium
Pd 46Palladium
Ag 47Argent
Cd 48Cadmium
Ga 31Gallium
Ge 32Germanium
As 33Arsenic
Se 34Sélénium
Br 35Brome Kr 36
Krypton
In 49Indium
Sn 50Etain Sb 51
Antimoine
Te 52Tellure
I 53Iode Xe 54
Xénon
Ta 73Tantale
W 74Tungstène
Re 75Rhénium
Os 76Osmium
Ir 77Iridium
Pt 78Platine
Au 79Or Hg 80
Mercure
Tl 81Thallium
Pb 82Plomb Bi 83
Bismuth
Po 84Polonium
At 85Astate
Rn 86Radon 105
Dubnium
106Seaborgium
107Bohrium
108Hassium
109Meitnerium
110Darmstadtium
111Roentgenium
112Copernicium
113Nihomium
114Flerovium
115Moscovium
116Livermorium
117Tennessine
118Oganesson
Ce 58Cérium
Pr 59Praséodyme
Nd 60Néodyme
61Prométhium
Sm 62Samarium
Eu 63Europium
Gd 64Gadolinium
Tb 65Terbium
Dy 66Dysprosium
Ho 67Holmium
Er 68Erbium
Tm 69Thulium
Yb 70Ytterbium
Lu 71Lutetium
Th 90Thorium
Pa 91Protactinium
U 92Uranium
93Neptunium
94Plutonium
95Américium
96Curium
97Berklium98
Californium
99Einsteinium
100Fermium
101Mendelevium
102Nobelium
Rf Db Sg Bh Hs Mt Ds Rg Cn Nh Fi Mc Lv Ts Og
PmPuNp Am Cm Bk Cf Es Fm Md No Lr
103LawrenciumZirconium
Hafnium
Rutherfordium
Sc 21Y 39
La-Lu 57-71
Ac-Lr
89-103
Scandium
Yttrium
Lanthanides
Actinides
Le tableau de Mendeleïev
PRINCIPE
Conçu en 1869 par le chimiste russe Dimitri Ivanovitch Mendeleiev, le tableau périodique classe tous les éléments chimiques selon leur numéro atomique et leurs propriétés chimiques. Quatre éléments ont été identifiés entre 2004 et 2010 et viennent d'être validés par l'Union internationale de chimie pure et appliquée (IUP AC).Les défis du CEA Octobre 2016 N°211
Aude Ganier, Claire Abou et Michel Szlazac (infographie), avec la collaboration dePascal Reiller
, chercheur à la DEN AtomeConstituant fondamental
de la matière formé par un noyau a u centre), composé de protons et de neutrons, autour duquel se répartissent des électrons en di?érents n i veaux d'éner?ies appelés couchesélectroniques (ellipses).
Les atomes stables connus ont jusqu'à
7 couches électroniques (correspondant
aux 7 li?nes du tableau) dont les électrons o c cupent au fur et à mesure des orbitalesélectroniques (il existe jusqu'à 44 types
de ces orbitales pouvant contenir des sous- c o uches électroniques : s(1), p(3), d(5) et f (7)).Élément chimique
Ensemble des atomes caractérisés
par un nombre défini de protons dans leur noyau. Ces atomes ont di?érentes formes possibles les isotopes (même nombre de protons et délectrons mais nombre diérent de neutrons).
Numéro atomique :
nombre de protons et d'électrons de l'élément Symbo le atomique : représentation universelle de l'élémentPériodes (I à VII)
Classement des éléments selon leur
confi?uration électronique (pour prévoir l'évolution de leurs propriétés) nombre d'orbitales occupées par des électrons.Les éléments de la line
I ont1 couche occupée, ceux de la li?ne II
en ont 2, etc.Groupes (1 à 18)
Or?anisation des éléments selon leurs
propriétés communes, comme la réactivité (capacité de l'élément à céder ou recevoir des électrons). C o lonnes 1, 2 et 13 à 17 : éléments remplissant pro?ressivement les orbitales " s » et " p » et ayant le même nombre d'électrons sur leur couche électronique : col. 1 = 1 électron, col. 13 = 3 électrons, col. 14 = 4, etc. C o lonnes 3 à 12 : éléments remplissant les orbitales " d » et " f ». Co lonne 18 : éléments dont la coucheélectronique externe est saturée.
Non-métaux Métaux alcalins Métaux alcalino-terreuxMétaux de transition
Lanthanides (ou terres rares) Actinides
Métaux pauvres Haloènes Gaz rares MétalloïdesNouveaux éléments chimiques validés en 2016 par l'IUPACÉtat physiques
Ne ?azHg liquideFe
solideÉlé ments synthétiques
créés artificiellement dans des accélérateurs de particules ou lors de réactions nucléaires 1 HHydrogène
Familles
Classement des éléments en fonction d'un comportement chimique proche.Élé ments n'ayant pas
d'utilisationLe tableau
de Mendeleïev I II III IV V VI VII1 2 3456789101112131415161718
SEL 1 HHydrogène
2 HeHélium
La 57Ac 89
NeFO
NéonFluorOxygène
678910
CNAzoteCarbone
B 5 Bore ArCl SArgonChloreSoufre
1415161718
SiPPhosphoreSilicium
Al 13Aluminium
Lanthane
Actinium
Li 3quotesdbs_dbs16.pdfusesText_22[PDF] hco3 chimie
[PDF] valence chimie exercice
[PDF] po4 chimie
[PDF] tableau des elements et leur valence
[PDF] groupements chimiques
[PDF] so3 chimie
[PDF] nobody definition
[PDF] nobody film
[PDF] nobody traduction
[PDF] nobody song
[PDF] nobody traduction en francais
[PDF] nobody alex and co
[PDF] nobody chanson
[PDF] nobody lyrics
