 Première générale - Oxydo-réduction - Exercices - Devoirs
Première générale - Oxydo-réduction - Exercices - Devoirs
Exercice 6. 4/5. Oxydo-réduction – Exercices - Devoirs. Première générale - Physique Chimie spécialité - Année scolaire 2022/2023 https://physique-et-maths.fr
 1ère S – Devoir commun 2013 – Épreuve de Physique-Chimie
1ère S – Devoir commun 2013 – Épreuve de Physique-Chimie
Partie A : L'hydrogène sulfuré un gaz bien particulier ! A.1 -Qu'est-ce que l'hydrogène sulfuré ? A.1.1) Rappeler la structure électronique des atomes 1H
 Devoir premier semestre 2013-2014 sciences physiques 1ere C
Devoir premier semestre 2013-2014 sciences physiques 1ere C
Exercice 1. Soit un composé organique A contenant du carbone de l'hydrogène
 correction exercices Précis de Physique-Chimie chapitre1 à 4
correction exercices Précis de Physique-Chimie chapitre1 à 4
6 févr. 2010 Précis d'électronique – Tome 1 – 1ère année – Jean-Luc Azan. Précis d ... chimie. □ 17. 3. Le nombre maximum de verres bus et permettant de ...
 Exercices de révisions : Physique-chimie
Exercices de révisions : Physique-chimie
Calculer la concentration finale en ions I-(aq) dans le mélange si le volume total à la fin de la réaction est de 50 mL. Exercice n°3 : Quantité de matière et
 Exercices de physique-chimie Première Spécialité
Exercices de physique-chimie Première Spécialité
1/ Calculer la masse molaire de l'aspirine. 2/ Exprimer puis calculer la quantité de mati`ere maximale d'aspirine autorisée par jour. 3/ En déduire le nombre
 PHYSIQUE – CHIMIE
PHYSIQUE – CHIMIE
physique – chimie d'une classe de 1ère D du. CSM de Niangon soumet à ses élèves la figure ci – dessous : Le solide (S) de masse m = 400g
 Exercices résolus - de chimie organique - Les cours de Paul Arnaud
Exercices résolus - de chimie organique - Les cours de Paul Arnaud
Il y a donc un atome d'hydrogène en trop par rapport au maximum autorisé. • C2H2Cl6. Formule moléculaire de l'alcane à deux atomes de carbone : C2H6. 6.
 DEVOIR DE VACANCES – SPÉCIALITÉ PHYSIQUE-CHIMIE
DEVOIR DE VACANCES – SPÉCIALITÉ PHYSIQUE-CHIMIE
b. Déterminer le coefficient directeur de la droite. c. Retrouver la concentration par le calcul. Exercice 6 : Identifier le(s)
 Chimie Générale (Chimie 1)
Chimie Générale (Chimie 1)
23 déc. 2020 H20 H2
 Exercices de révisions : Physique-chimie
Exercices de révisions : Physique-chimie
Le diiode I?2 (aq) réagit avec les ions thiosulfate S?2?O?3? Un surfeur couché sur la neige pense à ses cours de physique de 1ère S ! Après une très.
 Première générale - Oxydo-réduction - Exercices - Devoirs
Première générale - Oxydo-réduction - Exercices - Devoirs
Exercice 6. Exercice 7. 2/9. Oxydo-réduction – Exercices - Devoirs. Première générale - Physique Chimie spécialité - Année scolaire 2022/2023.
 Couverture Cours dété_sans devoirs_générique_18-séparées.indd
Couverture Cours dété_sans devoirs_générique_18-séparées.indd
Physique Chimie. 1re S. Physique. Chimie rédigé par des professeurs rattrapage et un devoir bilan avec des exercices récapitulatifs sur toutes les ...
 NIVEAU : 1ère D CE Physique - Chimie AVRIL 2020 DEVOIR N°1
NIVEAU : 1ère D CE Physique - Chimie AVRIL 2020 DEVOIR N°1
1- Calcule la masse molaire du composé B. 2- Détermine sa formule brute. 3- Donne les fonctions chimiques possibles de B. 4- L'hydrolyse du composé B
 ANNALES SCIENCES PHYSIQUES Terminale D
ANNALES SCIENCES PHYSIQUES Terminale D
Chapitre 6 : L'étude de la réaction entre un acide faible et une base forte une base faible et un acide fort. CHIMIE ORGANIQUE. Chapitre 7 : Les alcools.
 Première générale - Exercices - Devoirs - Physique et Maths
Première générale - Exercices - Devoirs - Physique et Maths
6. CH3COCH3. 7. CH3CH2CH2COOH. 8. CH3CH2COCH2CH3. 9. 10. 1/8. Structure des entités organiques – Exercices – Devoirs. Physique – Chimie Première générale
 1ère S – Devoir commun 2013 – Épreuve de Physique-Chimie
1ère S – Devoir commun 2013 – Épreuve de Physique-Chimie
?max×T=290?10?3. (4). Tableau 3 : Lois ou formules utilisables dans ce devoir. 1ère S – Devoir commun 2013 – Épreuve de Physique-Chimie.
 correction exercices Précis de Physique-Chimie chapitre1 à 4
correction exercices Précis de Physique-Chimie chapitre1 à 4
s-3.K-1.mol-1. Exercice 10 : Calcul d'incertitude sur une densité de flux thermique. L
 Première générale - Mouvement dun système - Exercices - Devoirs
Première générale - Mouvement dun système - Exercices - Devoirs
Première générale – Spécialité Physique – Chimie - Année scolaire 2022/2023 6. Faire le bilan des forces appliquées au mobile lors de la première phase.
 Première générale - Polynômes du second degré - Exercices - Devoirs
Première générale - Polynômes du second degré - Exercices - Devoirs
Les polynômes du second degré – Exercices - Devoirs. Exercice 1 corrigé disponible Exercice 6 corrigé disponible ... https://physique-et-maths.fr ...

Première S
Devoir communMai 2013
PHYSIQUE-CHIMIEM. GOLESTIN
M. TARGY
M. LABBÉ
Durée de l'épreuve : 3 h
L'usage de la calculatrice est autorisé
Document autorisé : la classification périodique des éléments (à rendre à la fin de l'épreuve)Ce sujet comporte 12 pages numérotées
Chaque partie est évaluée sur 10 points. Les différentes parties sont indépendantes et peuvent être abordées dans l'ordre souhaité, mais chacune doit être traitée. Les réponses aux questions doivent être rédigées.Données
Constantes
ConstanteValeur
Constante de Planckh=6,62606957×10-34J⋅s
Constante de gravitation universelleG=6,674×10-11N⋅m2⋅kg-2 Vitesse de la lumière dans le videc=2,99792458m⋅s-1Charge élémentairee=1,602×10-19C
Constante électriquek=8,988×109N⋅m2⋅C-2Tableau 1 : Constantes utilisées en Physique et Chimie.
Unités
GrandeurUnitéSymboleDéfinition
MasseUnité de masse atomique
unifiéeu1u=1,660×10-27kg Tableau 2 : Unités utilisées en physique nucléaire et atomique.Formules
Loi ou formuleExpression, les valeurs numériques étant en unités S.I.Loi de Coulomb entre une charge q1 et
une charge q2 situées à la distance d l'une de l'autreF=k⋅q1⋅q2 d2(1)Force de gravitation universelle entre
un objet de masse m1 et un objet de masse m2 situés à la distance d l'un de l'autreF=G⋅m1⋅m2
d2(2)Énergie d'un photonE=h⋅ν=h⋅c
λ(3)
Loi du déplacement de Wien
λmax×T=2,90⋅10-3(4)
Tableau 3 : Lois ou formules utilisables dans ce devoir.1ère S - Devoir commun 2013 - Épreuve de Physique-Chimie2/12
Partie A : L'eau, un solvant bien particulier !
A.1 -Qu'est-ce que l'eau ?
A.1.1)Rappeler la structure électronique des atomes H et O. A.1.2)En déduire le nombre de doublets liants et non liants de chaque atome. A.1.3)Prévoir la structure et la géométrie de la molécule d'eau. A.1.4)Les liaisons O - H sont-elles polarisées ? Si oui, tracer le moment dipolaire de chaque liaison puis le moment dipolaire résultant. Conclure quant à la polarité de la molécule d'eau.Aide : on donne les valeurs d'électronégativité suivantes, (H) = 2,2 ; (O) = 3,5.
A.2 -Première expérience avec le sel de cuisine Document A.1 : Structure du cristal de chlorure de sodium La distance entre un ion chlorure et un ion sodium dans le cristal NaCl est : d = 282 pm. On dissout un peu de chlorure de sodium (sel de cuisine) dans l'eau. A.2.1)Calculer la force d'interaction électrique entre un ion Na+ et un ion Cl- dans le cristal NaCl. A.2.2)Calculer la force d'interaction gravitationnelle entre un ion Na+ et un ion Cl-. On donne les masse atomiques suivantes : m(Na) = 22,9 u et m(Cl) = 35,4 u. A.2.3)Comment expliquer la cohésion du cristal ? On observe que, dès que les cristaux de chlorure de sodium sont introduits dans l'eau, les ions Na+ et Cl- se retrouvent hydratés. A.2.4)Expliquer en quelques phrases et avec des schémas ce qui s'est produit.A.3 -Deuxième expérience avec les alcools
On étudie maintenant la solubilité de deux alcools dans l'eau.A.3.1)Rappeler ce qu'est un alcool.
A.3.2)Les alcools utilisés pour l'expérience sont le propan-2-ol et le heptan-1-ol. Écrire les formules semi-développée et topologique de ces deux molécules.1ère S - Devoir commun 2013 - Épreuve de Physique-Chimie3/12
On constate expérimentalement que l'heptan-1-ol n'est pas miscible dans l'eau tandis que le propan-2-ol l'est. A.3.3)Rappeler, en s'aidant de schémas, la nature des interactions entre les molécules d'eau et une molécule d'alcool puis interpréter ces résultats. A.4 -Troisième expérience avec les alginates A.4.1)Quel type d'interaction existe-t-il entre les ions sodium et les groupes carboxylates ? A.4.2)Justifier la grande solubilité dans l'eau de l'alginate de sodium. A.4.3)Pourquoi l'ion calcium permet-il la formation de ponts entre deux chaînes, ce que ne permet pas l'ion sodium ?A.4.4)Pourquoi les alginates de calcium sont-ils très peu solubles dans l'eau,
contrairement aux alginates de sodium ?Document A.2 : Les alginates
Les alginates sont des polysaccharides (molécules constituées d'un enchaînement de sucres) constituant majoritairement les parois cellulaires des algues. Ils sont extraits d'algues brunes, en particulier, des laminaires (récolte en Atlantique nord : France,Grande-Bretagne et USA).
Un alginate très utilisé est l'alginate de sodium. C'est un polymère formé de deux monomères comportant des groupes carboxylates COO- et des ions sodium Na+. En présence d'ions calcium Ca2+, les ions sodium sont remplacés par les ions calcium qui permettent la formation de ponts entre deux chaînes. Les chaînes d'alginate forment alors de longs rubans de moins en moins solubles dans l'eau, permettant la fabrication de solutions visqueuses ou même de gels. C'est pourquoi l'alginate de sodium est très présent dans l'industrie agro-alimentaire pour la fabrication d'épaississants ou de gélifiants.Document A.3 : Formule de l'alginate de sodium
1ère S - Devoir commun 2013 - Épreuve de Physique-Chimie4/12
Document A.4 : Formule de l'alginate de calcium
1ère S - Devoir commun 2013 - Épreuve de Physique-Chimie5/12
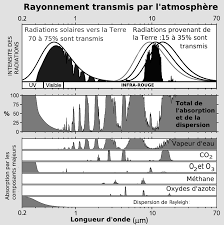
Partie B : Soleil et atmosphère terrestre
L'objectif de cette partie est d'étudier deux phénomènes résultants de l'interaction entre le
rayonnement solaire et l'atmosphère terrestre : la luminescence en haute atmosphère et l'effet de serre. Auparavant, une brève étude du fonctionnement de notre étoile sera menée, et sa durée de vie sera estimée.B.1 -Fonctionnement du Soleil
Document B.1 : Caractéristiques du Soleil
Masse1,99×1030 kg
Diamètre1 390 000 km
Âge4,57 milliard d'années
Quantité d'hydrogène consommé par seconde600 millions de tonnes Document B.2 : Schéma d'une réaction nucléaire dans le SoleilDocument B.3 : Masses de quelques noyaux
Noyauneutron1H2H3H3He4He
Masse (u)1,00871,00732,01363,01553,01494,0015
B.1.1)Écrire l'équation de la réaction décrite sur le Document B.2. Montrer que cette équation respecte les lois de conservation en physique nucléaire. B.1.2)Rappeler ce que signifie que deux noyaux sont isotopes et dire si la réaction nucléaire au sein du soleil fait appel à des isotopes.B.1.3)Calculer la variation de masse m associée à la réaction nucléaire étudiée.
Comment voit-on que cette réaction dégage de l'énergie ? B.1.4)Calculer l'énergie libérée par la réaction. Vos calculs sont-ils cohérents avec les valeurs données sur le Document B.2 ?1ère S - Devoir commun 2013 - Épreuve de Physique-Chimie6/12
B.1.5)Le deutérium (2H) et le tritium (3H) sont produits à partir de noyaux d'hydrogène (1H). Combien de noyaux d'hydrogène faut-il pour former un noyau de deutérium ? Et pour le tritium ? Écrire les réactions correspondantes, sachant que des particules présentes dans certaines désintégrations radioactives sont également créées. B.1.6)On estime que seul 10 % de l'hydrogène contenu dans le Soleil sera transformé en hélium. À partir des données du Document B.3, estimer combien de temps encore le Soleil brillera. On supposera que le Soleil n'était constitué que d'hydrogène lors de sa création. Commenter votre résultat. B.2 -Phénomènes de luminescence de l'atmosphèreDocument B.4 : Rayonnements EUV et luminescence
On appelle " ultraviolet extrême » (EUV) les rayonnements de longueur d'onde comprise entre 10 et 120 nm. Ceux-ci sont arrêtés par les couches supérieures de l'atmosphère, ce qui a pour effet de produire des ions, principalement O+, N2+ et O2+.Ces phénomènes d'interaction entre rayonnement et atmosphère sont étudiés grâce à
l'émission de lumière, appelée luminescence, qui suit le retour dans l'état fondamental des atomes de l'atmosphère qui ont été excités. On utilise notamment deux raies émises dans le visible (400-800 nm) par l'atome d'oxygène. Ces deux raies, l'une rouge et l'autre verte, sont en effet particulièrement intenses. D'après la thèse de doctorat de Frédéric Culot, Université Joseph Fourier, 2005. Document B.5 : Niveaux d'énergie de l'atome d'oxygène L'énergie d'ionisation de l'atome d'oxygène est de 13,6 eV D'après la thèse de doctorat de Frédéric Culot, Université Joseph Fourier, 2005. B.2.1)Rappeler ce que signifie ionisation. Quel est l'ion créé par l'ionisation de l'atome d'oxygène sous l'action des rayons EUV ? B.2.2)Dire sans calcul, mais en justifiant, si les photons EUV possèdent une énergie plus grande ou plus petite qu'un photon du visible. Expliquer en quoi la présence d'une atmosphère, indépendamment de sa composition, a participé à l'apparition de la vie sur Terre. B.2.3)Un photon de longueur d'onde 10 nm peut-il ioniser un atome d'oxygène ? Et un photon de longueur d'onde 100 nm ? B.2.4)À partir du Document B.5, identifier les transitions responsables de la raie verte et de la raie rouge qui sont utilisées pour l'étude des interactions entre rayonnement EUV et atmosphère.quotesdbs_dbs2.pdfusesText_2[PDF] devoir seconde biodiversité
[PDF] devoir statistiques 4ème
[PDF] devoir statistiques bac pro
[PDF] devoir sur l'émigration italienne au xixème siècle
[PDF] devoir sur la pollution 1am
[PDF] devoir surveillé math sup
[PDF] devoir surveillé maths 3ème pdf
[PDF] devoir surveillé maths mpsi
[PDF] devoir surveillé première s physique chimie
[PDF] devoir surveillé statistiques 4ème
[PDF] devoir surveillé svt seconde biodiversité
[PDF] devoir surveillé trigonométrie 1ere s
[PDF] devoir svt
[PDF] devoir svt 2eme science avec correction
