Untitled
Untitled
b) Dosage volumétrique : Prélever Vb 20 mL de la solution de carbonate de sodium à l'aide d'une pipette à deux
 TP no13 : Dosages colorimétriques acido-basiques et d
TP no13 : Dosages colorimétriques acido-basiques et d
On se propose de doser V0 = 10 mL d'une solution de soude carbonatée au moyen d'une solution d'acide chlorhydrique (H3O+ + Cl−) à Ca = 010 mol.L−1. L'acide
 pH dun mélange dune solution de carbonate de sodium et dacide
pH dun mélange dune solution de carbonate de sodium et dacide
acide chlorhydrique 0.1 M à 25 mL de carbonate de sodium 0.05 M. ( pKa1 (H2CO3/HCO3. -) = 6.30 ; pKa2 (HCO3. -/CO3. 2-) = 10.33 ). • Espèces présentes : OH ...
 Dosage Acido-basique - Carbonate de sodium
Dosage Acido-basique - Carbonate de sodium
Objectifs : On se propose de doser une solution basique de carbonate de sodium par un acide fort ( l'acide chlorhydrique ) de concentration connue par pH
 Méthode danalyse Détermination du pouvoir neutralisant dans les
Méthode danalyse Détermination du pouvoir neutralisant dans les
13 mars 2002 Solution de carbonate de sodium d'environ 02 N. Sécher environ 5 g ... Compléter le titrage avec la solution d'acide chlorhydrique 1
 CODEX ŒNOLOGIQUE INTERNATIONAL Dicarbonate de
CODEX ŒNOLOGIQUE INTERNATIONAL Dicarbonate de
4.3.4 Solution molaire d'acide chlorhydrique [HCl] = 1 mol/l. Déterminer la concentration massique par titrage au carbonate de sodium. Pour le dosage de l ...
 Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
d'hydroxyde de sodium ajoutée VE = (40 ± 0
 Chapitre 1 Acides et bases
Chapitre 1 Acides et bases
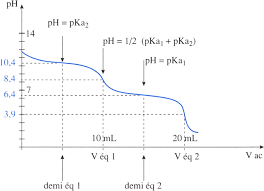
Droite : Courbe de pH : dosage d'une dibase faible (ion carbonate) par un acide fort (acide chlorhydrique). Crédits : Objectif PCEM. Si la précision des
 DOSAGE ACIDOBASIQUE
DOSAGE ACIDOBASIQUE
Peser à la balance analytique exactement environ 1g de carbonate de sodium anhydre Préparer 100mL d'une solution aqueuse de HCl 1 M à partir d'une solution d' ...
 E 1 FICHE GENERALE
E 1 FICHE GENERALE
Pour déterminer la concentration de la solution à doser cS on connaît : Le carbonate de sodium existe sous diverses formes
 Untitled
Untitled
Dosage d'une solution d'acide chlorhydrique diluée. Principe. La réaction entre le carbonate de sodium qui est une di-base et l'acide chlorhydrique donne 2.
 pH dun mélange dune solution de carbonate de sodium et dacide
pH dun mélange dune solution de carbonate de sodium et dacide
Calculer le pH d'une solution obtenue par addition de 15 mL d'acide chlorhydrique 0.1 M à 25 mL de carbonate de sodium 0.05 M. ( pKa1 (H2CO3/HCO3.
 Annexe – titrage : théorie + pratique
Annexe – titrage : théorie + pratique
Neutralisation complète du carbonate de sodium par l'acide chlorhydrique. 1 (2 Na+ CO3. 2-) + 1 (2 H+
 POLYCOPIÉ DE TRAVAUX PRATIQUES CHIMIE 3
POLYCOPIÉ DE TRAVAUX PRATIQUES CHIMIE 3
Tp n° 02 : Étalonnage d'une solution acide (HCl) par une solution de carbonate de sodium. 11. Tp n° 03 : Dosage de l'aspirine contenue dans un comprimé.
 correction - preparation dune solution titree dacide chlorhydrique
correction - preparation dune solution titree dacide chlorhydrique
3°) Quelle est la masse de carbonate de sodium que l'on doit peser pour préparer Ecrire l'équation du dosage sachant que l'ion carbonate est une dibase.
 1) Principe Le dioxyde de carbone contenu dans lair est soluble
1) Principe Le dioxyde de carbone contenu dans lair est soluble
dioxyde de carbone on a un mélange de soude et de carbonate de sodium (2 Na+ + CO3. 2-) dans la solution. On se propose de doser une solution de soude
 Dosage des carbonates par pertes de masse
Dosage des carbonates par pertes de masse
16 juil. 2020 Une fraction des minéraux carbonatés domine cependant : les formes liées au calcium CaCO3 au magnésium MgCaCO3
 1 / 6 TP n°1 DOSAGE DES IONS CARBONATE CO3
1 / 6 TP n°1 DOSAGE DES IONS CARBONATE CO3
On se propose de vérifier la composition en carbonate de sodium de la lessive Saint Marc et de caractériser la présence des ions carbonate. Données :.
 DOSAGE ACIDOBASIQUE
DOSAGE ACIDOBASIQUE
DOSAGE ACIDOBASIQUE. Préparation d'une solution étalon de carbonate de sodium 4° Calcul détaillé de la concentration molaire de HCl : DILUTION.
DÉPARTEMENT DE FORMATION PREPARATOIRE
POLYCOPIÉ DE TRAVAUX PRATIQUES
CHIMIE 3
Réalisé par :
Yazid DATOUSSAID Maitre de conférences ESSAT
Tarik ATTAR Maitre de conférences ESSAT
Année universitaire 2017 - 2018
2Sommaire
Hygiène et sécurité
03Verreries et matériels 05
Tp n° 01 : Préparation des solutions 07
Tp n° 02 : Étalonnage 11
Tp n° 03 13
Tp n° 04 : Dosage des ions hypochlorite dans une eau de Javel 15 Tp n° 05 : solubilité et produit de solubilité 17Hygiène et sécurité
3Sécurité:
Port du tablier est obligatoire
Utilisation des gants et lunettes où cela est demandé Ne pas ingérer ou inhaler des produits chimiques, travailler sous hotte autant que possibleNe pas rejeter de gaz ou vapeurs toxiques, inflammables ou explosifs dans le laboratoire (des hottes
sont installées à chaque laboratoires)Ne pas rejeter à l'évier des produits dans le cas où des récipients sont réservés à cet effet
Ne pas laisser seule une manipulation en cours
En cas d'incident, appeler un assistant
autres: utiliser un récipient intermédiaire leur est destiné, même entre chaque mesure. bleu) Symboles Utilisés sur les Étiquettes ou Les pictogrammes de danger : Dans les lieux publics on trouve souvent des dessins schématiques pour indiquer la sortie, pictogrammes.En chimie, la manipulation des espèces chimiques n'est pas toujours sans danger pour les utilisateurs
mais aussi pour la nature. Les fabricants indiquent donc sur chaque flacon de produit chimique des
pictogrammes pour indiquer les différents dangers.Toxique
Je tue
T ou T+
Les produits portant ce pictogramme empoisonnent rapidement, même à faible dose et peuvent provoquer des effets très variés sur l'organisme : nausées, vomissements, maux de tête, perte de connaissance ou d'autres troubles plus importants entraînant la mort. Toxicité par voie orale, cutanée ou par inhalation.Dangereux pour
Je pollue
N Substances nocives pour l'environnement aquatique et non aquatique (faune, flore, atmosphère) ou ayant un effet nuisible à long terme. Notamment pour les organismes du milieu aquatique (poissons,Hygiène et sécurité
4Corrosif
Je ronge
C Les produits corrosifs provoquent la destruction "non spécifique des tissus" (peau, muqueuses et yeux et voie digestive) par contact ou projection. NocifJe nuis
Xn ou Xi
Ce pictogramme signale lui aussi des dangers sur la santé. Les produits chimiques peuvent provoquer l'un ou plusieurs des effets suivants : empoisonnement à forte dose, irritation des yeux, de la gorge, du nez ou de la peau. Ils peuvent provoquer des allergies cutanées (type eczémas) et provoquer des états de somnolence ou de vertige. CMRJe conduis à la
mort Des produits cancérogènes, mutagènes, reprotoxiques (CMR) et tous produits pouvant modifier le fonctionnement de certains organes comme le ces effets toxiques apparaissent si l'on a été exposé une seule fois ou bien à plusieurs reprises.Inflammable
Je brûle
F ou F+
Les produits peuvent s'enflammer au contact d'une flamme, d'une de frottements, au contact de l'air ou encore au contact de l'eau s'ils dégagent des gaz.Comburant
Je fais brûler
O Les produits comburants (oxydants) qui peuvent provoquer ou aggraver un incendie, ou même provoquer une explosion en présence de produits inflammables.Explosif
E Les produits peuvent exploser au contact d'une flamme, d'une étincelle, d'électricité statique, sous l'effet de la chaleur, d'un choc, de ple certaines matières explosives, auto-réactives ou certains peroxydes organiques. Ils peuvent exploser sous l'effet de la chaleur. Il s'agit de gaz comprimés, de gaz liquéfiés et de gaz dissous. Les gaz liquéfiés réfrigérés peuvent, quant à eux, être responsables de brûlures ou de blessures liées au froid appelées brûlures cryogéniques.Radioactif
Je peux conduis
à un cancer
R Substance émettrice de radiations ionisantes : X, Beta, Gamma,Alpha. Risque de contaminations.
Biologique
B Substance susceptible d'être un agent pathogène ou pouvant induire des mutations génétiques. Éviter tout contact avec lecorps humainVerreries et matériels
5 Verreries et ustensiles Usuels Utilisés dans les Travaux Pratiques de Chimie :Bécher : un récipient classique en chimie, utilisé pour transvaser des solutions ou prélever
une solution avec une pipette par exemple. Les graduations sur un bécher donnent uniquement un ordre de grandeur du volume contenu, elles sont très peu précises !!!! Erlenmeyer : un récipient idéal si on veut éviter les projections de la solution contenue.Ainsi, si on mélange deux liquides, son utilisation est préférable pour des raisons de sécurité.
Ballon mono col rodé
Ballon mono col
Ballon bi-col
Ballon tri-col
Éprouvette graduée
5040
30
20 10 0
Burette
Fiole Jaugée
Pipette graduée et Jaugée
Verreries de mesure : (éprouvette graduée, burette, fiole jaugée, pipette graduée ou jaugée)
Entonnoir
Tube à essais
Réfrigérant
Trépied
Bec Bünsen
Mortier
1 2 3 45678 9 110
2 3 4567
8 9 11
Plaque chauffante avec
agitationVerreries et matériels
6Ampoule à décanter
Pissette Spatule
Verre de montre
Propipette
Ballon Tricol
1 2 3 4 5678 9 110
2 3 4 567
8 9 11
Filtration
Séparation de solide
de liquideSéparation de deux phases
liquides hétérogènes 5040
30
20 10 0 Pince
Statif
Burette
Erlenmeyer
Montage de dosage
TP n°1 Chimie 3
7 DEPARTEMENT DE FORMATION PREPARATOIRE CHIMIE 3TP n°1
PREPARATION DES SOLUTIONS
I.Objectifs:
Préparer et suivre un protocole.
Savoir préparer une solution à une concentration précise, par dissolution d'un composé solide, et par
dilution d'une solution mère.II. A retenir :
II-1. Une solution : E
soluté, dans un solvant. Dans uneSolution = Soluté + Solvant.
- Un solvant :- Un soluté : Est la substance qui, en général, est présente en plus petite quantité et qui se dissout dans
le mélange. II-2. Différentes expressions de la concentration¾ La molarité(mol/L): Le nbre de mole de solutés dans 1 L de solution, CMൌnsoluté /V solution.
¾ La concentration massique(g/L): La masse de soluté par unité de volume, Cmassൌm soluté /V solution.
¾ La molalité (mol/kg) :bre de mole de solutés dissoute dans 1 kg de solvantCmolൌnsoluté /msolvant.
¾ Le pourcentage massique (%):
en %.A%=(mA /msolutions).100. ¾ La fraction molaire : entrele nbre de mole iet le nbre de moles totale.Xi= ni/ ntotale.
¾ La (Normalité CN(éqg/l) : ntenu dans un litre de solution. CNLnéqg / V solution. CN
LZ.CM .
¾ -gramme : C'est la quantité de substance comprenant une mole des particules considérées (H+, eetc)TP n°1 Chimie 3
8¾ Facteur de dilution : f. Il est
définit par la relationf = CmèreCfille = VfilleVmère. On dilue x fois signifie que le facteur de dilutionf vaut x.On réalise une dilution au xième (dixième, cinquième, vingtième) signifie que le facteur fvaut x.
III. Incertitude,
III-1. Incertitude absolue, Incertitude relative: I: est l'erreur maximale que l'on est susceptible de commettre dans l'évaluation de x. L'incertitude absolue s'exprime donc dans les unités de la grandeur mesurée.X=X estimé + X
I : représente l'importance de l'erreur par rapport à la grandeur mesurée.L'incertitude relative n'a pas
III-2.
également.
Le nombre de chiffres significatifs avec lequel un résultat est exprimé doit être en accord avec
calculée.Exemple :
: Si x = a.b ou x=a/b, alors οquotesdbs_dbs50.pdfusesText_50[PDF] dosage complexometrique de la dureté de l'eau
[PDF] dosage complexométrique définition
[PDF] dosage complexométrique dureté de l'eau
[PDF] dosage complexométrique principe
[PDF] dosage d anticorps par l utilisation du test elisa corrigé
[PDF] dosage d un e base fort par un acide fort conclusion
[PDF] dosage d'oxydoréduction compte rendu
[PDF] dosage d'un acide fort par une base forte pdf
[PDF] dosage d'une base forte par un acide fort introduction
[PDF] dosage de feso4 par kmno4
[PDF] dosage de hcl par naoh
[PDF] dosage de l'acide ascorbique
[PDF] dosage de l'acide lactique dans le lait wikipedia
[PDF] dosage de l'ethanol