 Untitled
Untitled
b) Dosage volumétrique : Prélever Vb 20 mL de la solution de carbonate de sodium à l'aide d'une pipette à deux
 TP no13 : Dosages colorimétriques acido-basiques et d
TP no13 : Dosages colorimétriques acido-basiques et d
On se propose de doser V0 = 10 mL d'une solution de soude carbonatée au moyen d'une solution d'acide chlorhydrique (H3O+ + Cl−) à Ca = 010 mol.L−1. L'acide
 pH dun mélange dune solution de carbonate de sodium et dacide
pH dun mélange dune solution de carbonate de sodium et dacide
acide chlorhydrique 0.1 M à 25 mL de carbonate de sodium 0.05 M. ( pKa1 (H2CO3/HCO3. -) = 6.30 ; pKa2 (HCO3. -/CO3. 2-) = 10.33 ). • Espèces présentes : OH ...
 Dosage Acido-basique - Carbonate de sodium
Dosage Acido-basique - Carbonate de sodium
Objectifs : On se propose de doser une solution basique de carbonate de sodium par un acide fort ( l'acide chlorhydrique ) de concentration connue par pH
 POLYCOPIÉ DE TRAVAUX PRATIQUES CHIMIE 3
POLYCOPIÉ DE TRAVAUX PRATIQUES CHIMIE 3
30 janv. 2018 ... (HCl) par une solution de carbonate de sodium. 11. Tp n° 03 : Dosage de l'aspirine contenue dans un comprimé. 13. Tp n° 04 : Dosage des ions ...
 Méthode danalyse Détermination du pouvoir neutralisant dans les
Méthode danalyse Détermination du pouvoir neutralisant dans les
13 mars 2002 Solution de carbonate de sodium d'environ 02 N. Sécher environ 5 g ... Compléter le titrage avec la solution d'acide chlorhydrique 1
 CODEX ŒNOLOGIQUE INTERNATIONAL Dicarbonate de
CODEX ŒNOLOGIQUE INTERNATIONAL Dicarbonate de
4.3.4 Solution molaire d'acide chlorhydrique [HCl] = 1 mol/l. Déterminer la concentration massique par titrage au carbonate de sodium. Pour le dosage de l ...
 Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
d'hydroxyde de sodium ajoutée VE = (40 ± 0
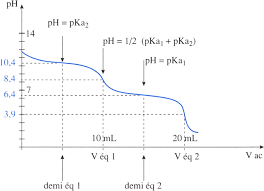 Chapitre 1 Acides et bases
Chapitre 1 Acides et bases
Droite : Courbe de pH : dosage d'une dibase faible (ion carbonate) par un acide fort (acide chlorhydrique). Crédits : Objectif PCEM. Si la précision des
 DOSAGE ACIDOBASIQUE
DOSAGE ACIDOBASIQUE
Peser à la balance analytique exactement environ 1g de carbonate de sodium anhydre Préparer 100mL d'une solution aqueuse de HCl 1 M à partir d'une solution d' ...
 E 1 FICHE GENERALE
E 1 FICHE GENERALE
Pour déterminer la concentration de la solution à doser cS on connaît : Le carbonate de sodium existe sous diverses formes
 Untitled
Untitled
Dosage d'une solution d'acide chlorhydrique diluée. Principe. La réaction entre le carbonate de sodium qui est une di-base et l'acide chlorhydrique donne 2.
 pH dun mélange dune solution de carbonate de sodium et dacide
pH dun mélange dune solution de carbonate de sodium et dacide
Calculer le pH d'une solution obtenue par addition de 15 mL d'acide chlorhydrique 0.1 M à 25 mL de carbonate de sodium 0.05 M. ( pKa1 (H2CO3/HCO3.
 Annexe – titrage : théorie + pratique
Annexe – titrage : théorie + pratique
Neutralisation complète du carbonate de sodium par l'acide chlorhydrique. 1 (2 Na+ CO3. 2-) + 1 (2 H+
 POLYCOPIÉ DE TRAVAUX PRATIQUES CHIMIE 3
POLYCOPIÉ DE TRAVAUX PRATIQUES CHIMIE 3
Tp n° 02 : Étalonnage d'une solution acide (HCl) par une solution de carbonate de sodium. 11. Tp n° 03 : Dosage de l'aspirine contenue dans un comprimé.
 correction - preparation dune solution titree dacide chlorhydrique
correction - preparation dune solution titree dacide chlorhydrique
3°) Quelle est la masse de carbonate de sodium que l'on doit peser pour préparer Ecrire l'équation du dosage sachant que l'ion carbonate est une dibase.
 1) Principe Le dioxyde de carbone contenu dans lair est soluble
1) Principe Le dioxyde de carbone contenu dans lair est soluble
dioxyde de carbone on a un mélange de soude et de carbonate de sodium (2 Na+ + CO3. 2-) dans la solution. On se propose de doser une solution de soude
 Dosage des carbonates par pertes de masse
Dosage des carbonates par pertes de masse
16 juil. 2020 Une fraction des minéraux carbonatés domine cependant : les formes liées au calcium CaCO3 au magnésium MgCaCO3
 1 / 6 TP n°1 DOSAGE DES IONS CARBONATE CO3
1 / 6 TP n°1 DOSAGE DES IONS CARBONATE CO3
On se propose de vérifier la composition en carbonate de sodium de la lessive Saint Marc et de caractériser la présence des ions carbonate. Données :.
 DOSAGE ACIDOBASIQUE
DOSAGE ACIDOBASIQUE
DOSAGE ACIDOBASIQUE. Préparation d'une solution étalon de carbonate de sodium 4° Calcul détaillé de la concentration molaire de HCl : DILUTION.
CONCOURS EXTERNE D'ACCES AU CORPS DES
ADJOINTS TECHNIQUES PRINCIPAUX 2
ème
CLASSE
DE RECHERCHE ET DE FORMATION
DU MINISTERE DE L'ENSEIGNEME
NT SUPERIEUR ET DE LA
RECHERCHE
B.A.P. B
Emploi-type : préparateur en chimie
Epreuve professionnelle d'admission
Durée : 1h30
Coefficient : 3
Les candidats doivent se présenter à cet
te épreuve munis d'une blouse en coton et de lunettes de protection. La calculatrice est autorisée.Page 1 sur 3
CONCOURS Externe d'accès au corps des ADJOINTS TECHNIQUES principaux 2ème
classe de recherche et de formation en Bap B " préparateur en chimie » session 2009Nom :....................................................................................................................
Nom de Jeune Fille : ..................................................................................................
Prénom : ................................................................................................................
Né(e) le: ..............................................................................................................
DOSAGE ACIDOBASIQUE
Préparation d'une solution étalon de carbonate de sodium Peser à la balance analytique exactement environ 1g de carbonate de sodium anhydre Na 2 CO 3 . Dissoudre et transvaser dans une fiole ja ugée de 100 mL. Compléter avec de l'eau distillée.Etalonnage d'une solution d'acide chlorhydrique
Introduire dans un bécher 10 mL de la solution de carbonate préparée ci-dessus. Remplir la burette avec la solution d'acide chlorhydrique Doser cette solution en présence de phénolphtaleine (VPhénol.
), notez ce premier volume équivalent. Une fois ce premier dosage passé (changement de couleur), sur la même prise d'essai, rajouter quelques gouttes d'hélianthine et continuer le dosage jusqu'au virage au rouge de l'héliantine (VHél
). Notez ce second volume d'équivalence. Pour CO 2 (aq), les deux pK a sont égaux à 6,4 et 10,2.Vous devrez faire un dosage rapide (V
1 ) pour évaluer au cm 3 près le volume équivalent, puis deux dosages précis (V 2 , V 3 Calcul de la concentration molaire de la solution de carbonate de sodium : Écrire les réactions de dosage et les constantes d'acidité correspondantes :1° Réaction à la première équivalence :
2° Réaction à la deuxième équivalence :
3° Volume d'HCl versés : V1 Phénol. = V2 Phénol = V3 Phénol =
V1 Hel.= V2 Hel. = V3 Hel. =
Page 2 sur 3
4° Calcul détaillé de la concentration molaire de HCl :
DILUTION
Préparer 100mL d'une solution aqueuse de HCl à partir d'une solution d'HCl 37 %.Calculs :
RECONNAISSANCE MATERIEL
Nommez le matériel présenté
1- 2- 3- 4- 5- 6- 7- 8- 9- 10-Page 3 sur 3
quotesdbs_dbs50.pdfusesText_50[PDF] dosage complexometrique de la dureté de l'eau
[PDF] dosage complexométrique définition
[PDF] dosage complexométrique dureté de l'eau
[PDF] dosage complexométrique principe
[PDF] dosage d anticorps par l utilisation du test elisa corrigé
[PDF] dosage d un e base fort par un acide fort conclusion
[PDF] dosage d'oxydoréduction compte rendu
[PDF] dosage d'un acide fort par une base forte pdf
[PDF] dosage d'une base forte par un acide fort introduction
[PDF] dosage de feso4 par kmno4
[PDF] dosage de hcl par naoh
[PDF] dosage de l'acide ascorbique
[PDF] dosage de l'acide lactique dans le lait wikipedia
[PDF] dosage de l'ethanol
