 Étude dune réaction : titrage des ions fer II par les ions permanganate
Étude dune réaction : titrage des ions fer II par les ions permanganate
Étude d'une réaction : titrage des ions fer II par les ions permanganate. I – Généralités sur les titrages. 1) Objectif d'un titrage. Il permet à l
 Dosage du fer ferreux La manganimétrie est une technique
Dosage du fer ferreux La manganimétrie est une technique
D'autre part le potassium ( +) ion spectateur
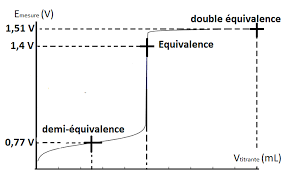 Dosage potentiométrique
Dosage potentiométrique
DOC3 : Courbe théorique du dosage des ions permanganate par les ions fer II ions ferreux Fe2+ en solution mais le sel de Mohr est moins facilement oxydé par ...
 TP- Dosage des ions Fer (II) dans un produit anti-mousse
TP- Dosage des ions Fer (II) dans un produit anti-mousse
ions fer (II) Fe2+ et les ions permanganate. MnO4. -. Cette réaction servira ensuite de réaction support au dosage. Expérience n°1 : - Dans un tube à essais ...
 DOSAGE DES IONS FERREUX PAR DES IONS PERMANGANATE
DOSAGE DES IONS FERREUX PAR DES IONS PERMANGANATE
Produit phytosanitaire utilisé contre la chlorose sous forme de poudre à base d'élément fer (ce solide est en cristal ionique contenant l'ion fer II).
 TP- Dosage des ions Fer II dans un produit anti- mousse
TP- Dosage des ions Fer II dans un produit anti- mousse
Alors que l'on ajoute de la solution aqueuse de permanganate de potassium de couleur violette dans le tube la le mélange reste incolore. Q2-2 : Une réaction
 Untitled
Untitled
dosage Fer(II) /. Ce(IV)) car les espèces Fe3+ et Fe2+ sont présentes en ... tion ferreuse à la solution de permanganate. La formation d'ion manganeux en mi ...
 Détermination dune quantité de matière Fiche
Détermination dune quantité de matière Fiche
Quelle est l'évolution du système lors d'un dosage par titrage colorimétrique ? Les ions permanganate sont en excès et les ions fer (II) sont le réactif ...
 Étude dune réaction : titrage des ions fer II par les ions permanganate
Étude dune réaction : titrage des ions fer II par les ions permanganate
Étude d'une réaction : titrage des ions fer II par les ions permanganate. I – Généralités sur les titrages. 1) Objectif d'un titrage.
 TP 13 DOSAGE des IONS FER (II) contenus dans le SEL de MOHR
TP 13 DOSAGE des IONS FER (II) contenus dans le SEL de MOHR
une solution aqueuse de concentration connue en ion fer (II) dosage des ions. 2+. (aq). Fe de S1 par une solution acidifiée de permanganate de potassium.
 Compte rendu du TP de chimie n°9 Les dosages rédox
Compte rendu du TP de chimie n°9 Les dosages rédox
II) Dosages des ions Fe2+ réagir avec un oxydant tel l'ion permanganate MnO4 ... d'hydroxyde de fer (II) en présence d'ions fer (II) Fe2+. (aq) selon.
 TP- Dosage des ions Fer (II) dans un produit anti-mousse
TP- Dosage des ions Fer (II) dans un produit anti-mousse
PROBLÉMATIQUE : Déterminer la concentration molaire en ion fer(II) de la solution la réaction entre les ions fer (II) Fe2+ et les ions permanganate.
 Teneur en fer dun produit sanitaire. La teneur en fer dun produit
Teneur en fer dun produit sanitaire. La teneur en fer dun produit
Pour réaliser le titrage des ions ferreux Fe2+
 Titrage des ions fer II
Titrage des ions fer II
En déduire l'équation chimique de la réaction de titrage. Q3. À l'équivalence quelle relation existe-t-il entre la quantité de matière d'ions permanganate
 TP- Dosage des ions Fer II dans un produit anti- mousse
TP- Dosage des ions Fer II dans un produit anti- mousse
Q2-2 : Une réaction chimique a-t-elle eu lieu ? Si oui quel réactif pouvez-vous déjà identifier ? L'expérience 2 prouve que les ions permanganate
 TP8 - Dosage colorimétrique dions fer II en solution
TP8 - Dosage colorimétrique dions fer II en solution
Déterminer la quantité de matière puis la concentration en ions fer II d'une solution de sel de Mohr en dosant ces ions par une solution de permanganate
 TP n°12 : LA CHLOROSE DES VEGETAUX
TP n°12 : LA CHLOROSE DES VEGETAUX
(aq) + MnO4. -. (aq)) de couleur violette. Lors du dosage les ions permanganate MnO4. - réagissent avec les ions Fer (II) Fe2+
 Les dosages doxydoréduction
Les dosages doxydoréduction
Les dosages d'oxydoréduction appelés également dosages rédox
Teneur en fer d'un produit sanitaire.
IM PHQHXU HQ IHU G·XQ SURGXLP SO\PRVMQLPMLUH MQPL-chlorose est indiquée sur son emballage : 6,0 % en masse.
I·RNÓHŃPLI GH ŃHP H[HUŃLŃH HVP G·HQYLVMJHU XQ PLPUMJH SMU VSHŃPURSORPRPpPULH MGMSPp MX ŃRQPU{OH GH TXMOLPp
de ce produit.1. Choix du réactif titrant.
Pour réaliser le titrage des ions ferreux, Fe2+, contenus dans un produit phytosanitaire destiné à lutter
contre la chlorose ferrique, on dispose de deux solutions titrantes possibles :Une solution de peroxodisulfate de potassium acidifiée (2K+(aq)+S2O82-(aq)) de concentration 0,10 mol.L-1.
Une solution de permanganate de potassium acidifiée (K+(aq)+MnO4-(aq)) de concentration molaire 0,10
mol.L-1.Les ions peroxodisulfate comme les ions permanganate réagissent en solution aqueuse avec les ions Fe2+. Un
PHVP MYHŃ XQH VROXPLRQ MTXHXVH G·O\GUR[\GH GH VRGLXP MSUqV UpMŃPLRQ entre les ions Fe2+ et les
ions S2O82- ou MnO4- ŃRQGXLP MX PrPH SUpŃLSLPp URXLOOH G·O\GUR[\GH GH IHUHHHB1.1. La transformation chimique qui se produit quand on mélange des ions Fe2+ et des ions
peroxodisulfate S2O82- G·XQH SMUP ou permanganate MnO4- G·MXPUH SMUP TXH le test avec une solution aqueuse
G·O\GUoxyde de sodium met en évidence :
Oxydation des ions Fe2+ en ion Fe3+.
1.2.Écrire les équations des réactions modélisant les transformations chimiques mettant en jeu :
les ions Fe2+ et les ions S2O82- G·XQH SMUP2Fe2+ (aq) = 2Fe3(aq) + 2e-.
S2O82(aq) + 2e- = 2SO42(aq)
Ajouter puis simplifier :
2Fe2+(aq) + S2O82-(aq) = 2Fe3+(aq) +2SO42-(aq)
les ions Fe2+ et les ions MnO4-G·MXPUH SMUP5 fois { Fe2+(aq) = Fe3+(aq) + e- }
MnO4-(aq) +8H+(aq) +5e- = Mn2+(aq) +4H2O(l)
MnO4-(aq) +8H+(aq) +5e- + 5Fe2+(aq) = Mn2+(aq) +4H2O(l) +5Fe3+(aq) +5e- . MnO4-(aq) +8H+(aq) + 5Fe2+(aq) = Mn2+(aq) +4H2O(l) + 5Fe3+(aq)1.3.Montrer, en vous référant à la couleur de chaque solution PLPUMQPH TX·LO HVP SOXV ÓXGLŃLHX[ GH ŃORLVLU OM
solution de permanganate de potassium pour réaliser le titrage des ions ferreux contenus dans le produit
phytosanitaire, la coloration due aux ions ferreux (Fe2+) ou ferrique (Fe3+) en solution aqueuse étant très peu
perceptible. Seul l'ion permanganate possède une forte coloration violette, les autres ions sont incolores.1.4. GpILQLU O·pTXLYMOHQŃH G·XQ PLPUMJHB
A l'équivalence les réactifs sont en SURSRUPLRQV VP±ŃOLRPpPULTXHV. Avant l'équivalence, le réactif titré est
en excès, après l'équivalence le réactif titrant est en excès.2. 0LVH HQ ±XYUH GX PLPUMJH
2.1. La solution de permanganate de potassium étant trop concentrée, il est nécessaire de la diluer 5 fois
MYMQP GH O·XPLOLVHU SRXU OH PLPUMJHB FOoisir la verrerie adaptée à cette dilution. Justifier.
Le volume de la fiole jaugée ex : 50,0 mL , doit être 5 fois plus grand que celui de la pipette jaugée
10,0 mL
2.2. Expliquer pourquoi certaines verreries sont associées à des capacités notées 100 mL, 50 mL, 10 mL, et
G·MXPUHV j GHV ŃMSMŃLPpV GH 1000 PI D00 PI 100 PIBLes verreries de capacités 100 mL, 50 mL sont moins précises que celles de capacités 100,0 mL, 50,0
mL...2.3. IH SURGXLP SO\PRVMQLPMLUH VH SUpVHQPH VRXV OM IRUPH G·XQH SRXGUHB $ILQ de réaliser le titrage, on dissout
1000 J GH SURGXLP GMQV GH O·HMX HP RQ ŃRPSOqPH MYHŃ GH O·HMX GH IMoRQ à obtenir 1,0 L de solution.
Pour prélever ces 10,0 mL , on choisit une pipette jaugée de 10,0 mL. ÉPREUVES COMMUNES DE CONTRÔLE CONTINU 2020 http://labolycee.org1ère Spécialité : physique-chimie
G85e( G( I·e35(89( : 2 h CALCULATRICE AUTORISÉE : quotesdbs_dbs50.pdfusesText_50[PDF] dosage des salicylés dans le sang
[PDF] dosage des triglycérides sériques par méthode enzymatique
[PDF] dosage du cholestérol total
[PDF] dosage du mélange naoh et na2co3
[PDF] dosage du mélange naoh na2co3 par hcl
[PDF] dosage dureté de l'eau
[PDF] dosage en point final définition
[PDF] dosage enzymatique de substrat en point final
[PDF] dosage ethanol dans le vin
[PDF] dosage ethanol dichromate
[PDF] dosage fe2+ par cr2o72-
[PDF] dosage fuel fit
[PDF] dosage indirect
[PDF] dosage ion fer ii par permanganate
