L3 Chimie des Matériaux 2014-2015 Conformité
L3 Chimie des Matériaux 2014-2015 Conformité
III - Programme détaillé par matière des semestres S5 et S6 [1] Electrochimie des concepts aux applications- Cours et exercices corrigés
 Chimie (problèmes et exercices) Indice 540.76 Nombres de Titres
Chimie (problèmes et exercices) Indice 540.76 Nombres de Titres
Chimie organique : rappels de cours et exercices corrigés. Gruia Marie 547/03. 08. 3. 2729857567. Exercices corrigés de chimie organique. Gruia
 Filière Sciences de la Matière Chimie Cours Chimie des Solutions
Filière Sciences de la Matière Chimie Cours Chimie des Solutions
Exercice. On considère une solution d'acide faible de concentration initiale C0 S5. = (. . 108. ) 1. 5. 3.2. Conditions de précipitation. A+ + B- → AB.
 Untitled
Untitled
Exercice 1 : Calculer la force ionique de l'eau de mer dont la composition est : Composé. NaCl. MgCl2 EPREUVE : Electrochimie (sans document). Durée : 2 h ...
 «EXERCICES ET PROBLEMES CORRIGES DE
«EXERCICES ET PROBLEMES CORRIGES DE
Sciences-Mathématiques-Physique (SMP) Sciences-Mathématiques-Chimie. (SMC) et Sciences de la Vie (SVI) des facultés des sciences. Il comporte des exercices
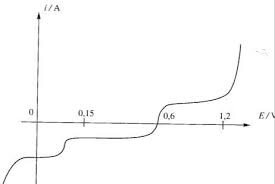 Exercices Cinétique électrochimique – Courbes intensité-potentiel
Exercices Cinétique électrochimique – Courbes intensité-potentiel
Correction détaillée en vidéo. Page 8. Usage personnel uniquement. 8. Exercice n° 5 : Cinétique électrochimique limitée par le transfert de matière*. Soit une
 Exercices de révision- Oxydo-réduction et Piles électrochimiques
Exercices de révision- Oxydo-réduction et Piles électrochimiques
Corrigé. Exercice I. On considère la pile symbolisée par: Cu / Cu2+ (01M) Exercices de révision- Oxydo-réduction et Piles électrochimiques
 Electrochimie des solides - Exercices corrigés avec rappels de cours
Electrochimie des solides - Exercices corrigés avec rappels de cours
Grenoble Sciences est un centre de conseil expertise et labellisation de l'ensei- gnement supérieur français. Il expertise les projets scientifiques des
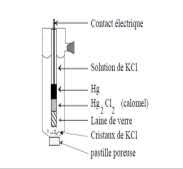 Electrochimie Exercice n° 1 :
Electrochimie Exercice n° 1 :
Electrochimie. Exercice n° 1 : On réalise la pile Daniell en utilisant : - un Correction d'exercice 4 : 1- le couple d'oxydoréduction relatif à cette ...
 Electrochimie des solides - Exercices corrigés avec rappels de cours
Electrochimie des solides - Exercices corrigés avec rappels de cours
Grenoble Sciences est un centre de conseil expertise et labellisation de l'ensei- gnement supérieur français. Il expertise les projets scientifiques des
 Filière sciences de la matière Cours délectrochimie SMC Semestre 5
Filière sciences de la matière Cours délectrochimie SMC Semestre 5
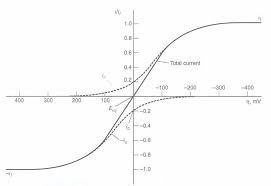
CHAPITRE III : CINETIQUE ELECTROCHIMIQUE. I. Polarisation et surtension d'une électrode. I.1. Définition : I.2. Différents types de courbe de polarisation.
 Chimie (problèmes et exercices) Indice 540.76 Nombres de Titres
Chimie (problèmes et exercices) Indice 540.76 Nombres de Titres
chimiques : rappels de cours exercices corrigés. Gruia
 Electrochim Electrochimie
Electrochim Electrochimie
migration des ions sous l'influence du champ électrique diffusion des ions due au gradient de concentration que provoq ction à l'électrode : voir exercice du TD.
 Chimie Analytique 2éme année pharmacie - Electrochimie - Dr
Chimie Analytique 2éme année pharmacie - Electrochimie - Dr
On mesure les grandeurs électriques (potentiel courant
 Électrochimie
Électrochimie
Constitution d'une pile éq de fonctionnement
 METHODES ELECTROCHIMIQUES POUR LANALYSE IN SITU DE
METHODES ELECTROCHIMIQUES POUR LANALYSE IN SITU DE
18 fév. 2008 J'exprime toute ma gratitude à Maurice Comtat professeur au laboratoire de Génie. Chimique de Toulouse
 Cinétique électrochimique
Cinétique électrochimique
7 avr. 2021 TD 25 – Électrochimie. Correction. Cinétique électrochimique. Exercice 1 : Allure d'une courbe intensité-potentiel.
 Untitled
Untitled
Epreuve d'Electrochimie (Session 2 décembre 2005). Durée : 1 heure. Exercice 1 : Calculer la force ionique d'une solution obtenue en mélangeant 50 cm3
 Cours et exercices corrigés
Cours et exercices corrigés
Connaître un peu de minéralogie est égale- ment utile en chimie minérale et en physique du solide. 1.2.1 Les minéraux comme éléments constitutifs des roches.
UNIVERSITE CADI AYYAD
Faculté Polydisciplinaire
SafiDépartement de Chimie
Filière sciences de la matière
SMCSemestre 5
Préparé par :
Moulay Rachid LAAMARI
Janvier 2015
1SOMMAIRE
CHAPITRE I : PILES ET ACCUMULATEURS
I. LES PILES
I.1. Les principaux types de piles.
I.2. Relation entre potentiel de pile et activités des corps dissous. I.3. Variation de E avec la température: Formule de Gibbs Helmotz.II. ACTIVITES
II.1. Relation entre activité et concentration.II.3. Théorie de Debye-Huckel
a. Modèle proposé par Debye Huckel b. c. Equation limite de Debye-Huckel. d.III. LES ACCUMULATEURS
III.1. Les paramètres
II IICHAPITRE II : DIAGRAMME TENSION-pH
I. Introduction
II. Equilibres acide base.
III. Equilibres redox.
IV. Tracé du diagramme tension pH du cuivre eau à 25°C à partir des potentiels chimiques standards.CHAPITRE III : CINETIQUE ELECTROCHIMIQUE
I.1. Définition :
I.2. Différents types de courbe de polarisation.II. ÉQUATION CINETIQUE I = F(E)
0 et équation de Bulter-Volmer
II.3. Les lois limites de la surtension
II.4. Régime mixte de diffusion transfert
2II.5. Régime pur de diffusion
II.6. Application des courbes de polarisation.
CHAPITRE III : POLAROGRAPHIE
I. Généralités
I.1. Purification du mercure
I.2. Propriétés physiques du mercure
I.3. Électrode à gouttes de mercure
II. Principe du tracé des polarogrammes
II.1 Application du potentiel et appareillage
II.2 Courbe intensité-potentiel
II III. Loi de diffusion et mécanismes réactionnels IIIIII.Ilkovic
III.3 Systèmes rapides
III.4 Systèmes lents
III.5 Mécanismes cinétiques
III.6 Mécanismes catalytiques :
IV. cas particulier
3PILES ET ACCUMULATEURS
I. LES PILES
I.1. Les principaux types de piles.
Il y a deux catégories de piles.
Les piles dites impolarisables, dont le fonctionnement ne modifie pas les extrémités de la chaîne. positif en utilisant à ce pôle un système redox de tension plus élevée que celle d a. Piles impolarisables :Pile Daniell :
+ Cu / CuSO4 // ZnSO4 / Zn -Pile Weston :
+ Hg / Hg2SO4 + CdSO4 // CdSO4 / (( Cd )) Hg b. Piles à dépolarisant solidePile Leclanché
+ C/ MnO2 // NH4Cl / Zn (Hg) -Pile de Rube Mallory :
+ C, Hg / HgO + Zn(OH)2 // KOH / Zn(Hg) - Pile Lalande : + Cu / CuO // NaOH 20% / Zn( Hg) c. Piles à dépolarisant liquidePile de Grove :
+ Pt / HNO3 // ZnSO4 ou H2SO4 / Zn ( amalgamé)Pile au bichromate de Poggendort :
+ C / K2Cr2O7 + H2SO4 / ZnPile de Fery ( Pile air Zinc) :
+ C O2 // NH4Cl ou KOH / Zn d. Etude de la pile Daniel : + Cu / Cu2+ // Zn2+ / Zn La force électromotrice de la pile est E = E+ - E - avec E+ > E- Lorsque plusieurs électrolytes interviennent dans une pile, il existe une tension de jonction liquide/ liquide. Dans ce cas on écrit la f.e.m de la pile : 4E= E+ - E- +j
j : potentiel de jonction liquide/liquide ( + ) : Cu2+ + 2 e Cu ( - ) : Zn Zn2+ 2eSchéma de la pile Daniel
I.2. Relation entre potentiel de pile et activités des corps dissous. + Pt / Cl2 // ZnCl2 / Zn Au pôle ( +) : Cl2 +2 e- 2Cl- : E+ = E0 + 0.06/n log( PCl2/a2 Cl-) Au pôle ( - ) : Zn Zn2+ +2 e- : E- = E0 + 0.06/n log( a Zn 2+)La réaction globale : Cl2 + Zn 2Cl- + Zn2+
Calcul de la tension de la cellule à partir de la formule de Nernst. E = E+ - E- = E0( + ) - E0( - ) - 0.06/2 log (a2 Cl- . a Zn 2+/ PCl2 )On fait apparaître le terme a2Cl- . a Zn2+
a ( ZnCl2 ) = (a Zn 2+. a2Cl- )1/3 E = E0( + ) - E0( - ) + 0.06/2 log(PCl2 ) - 0.06/2 log a3 ( ZnCl2 ) I.3. Variation de E avec la température: Formule de Gibbs Helmotz. Le potentiel thermodynamique est une grandeur mesurable.E= - G / nF avec G = H - TS
E = -H/nF + TS/nF
S = - ( G) / ( T) = - ( -nFE )/ T= nFE / T
E / négatif
selon les types de piles. 5 On appelle r : facteur de conversion de la cellule. r = G / H = 1- TS/ H Le rapport r peut être supérieur à 1, si le rapport H / S est négatif c.a.d S est toujours positif, donc la cellule emprunte de la chaleur au milieu extérieur.II. ACTIVITES
II-1 Relation entre activité et concentration.
La , au moyen des concentrations ne
restent faibles. Cette approximation revient à admettre que les interactions entre particulesLe physico -
peut tenir compte des interactions entre particules, en remplaçant dans la loi particules par une nouvelle grandeur thermodynamique " » concentration et pour un ion B+ on a : aB+ = . CIl varie avec la concentration.
1 quand C0
En solution infiniment diluée concentration et activité deviennent identiques.On peut définir l i
i = i 0 + RTln(ci) : faibles concentrations i = i 0 + RTln(ai) : fortes concentrations i 0 : potentiel chimique standard ci ai II.2. 6BA B+ + A-
a+ et a- sont respectivement les activités des ions B+ et A- . + et - + et A- : a = ( a+ . a- )1/2 = (+ .-)1/2BA +B+ + -A-
a = ( a++ . a-- )1/( + + -) = (++ .- -)1/( + + -) est définie comme une moyenne géométriqueEx : Ca (NO3)2 Ca2+ + 2NO3-
Ca2+ = 0 Ca2+ + RTln(a Ca2+)
NO3- = 0 NO3- + RTln(a NO3- )
Ca (NO3)2 = Ca2+ + 2 NO3-
= (Ca2+ . NO3-2)1/3II.3. Théorie de Debye-Huckel
IV. Modèle proposé par Debye Huckel
Huckel présentent un calcul relativement simple qui proposé est le suivant : Un ion de charge ze acquiert une énergie potentielle U = ze :. : : potentiel électrostatique de la phase ; z e Pour des solutions infiniment diluées, les interactions ion-ion sont négligeables, par contre les interactions ion-solvant (eau) sont i = i 0 + RTln(ci) Lorsque la concentration augmente, les interactions ion-ion électrostatique ( de la forme Ae2/ r) prend des valeurs non 7 négligeables et on aura un terme excédentaire RTln(i potentielle. i = i 0 + RTln(ai)= i 0 + RTln(Ci)+ RTln(i)Gex = RT ln(i).
Pour un electrolyte se dissociant en ions, on pourrait écrire : i RT ln(i) )= Gex sphères. Les deux charges sont à la distance r .2/ r ).
r U0 Pour des grandes distances, négligeable, c.à.d. pour des solutions infiniment diluées, elles se comportent comme des solutions idéales. V. La condition de neutralité, pour une solution donnée : ni zi = 0La répartition de la
Boltzmann : ni = ni exp(-zie/kT)
k : constante de Boltzmann, zi eT : température,
: potentiel électrostatique, Chaque ion i possède une charge zioù la densité locale de charge est = niie = Zie ni exp( -zie/kT)La densité et le potentiel : = - 4/D
: opérateur Laplacien , D : constante diélectrique ( D = 4), = 0r0 : permittivité du vide ; r : permittivité relative.
VI. Equation limite de Debye-Huckel.
log(i) = -AZi2 I / (1+B.aI )A et B sont des constantes calculables.
I= ½ mi.Zi2 : Force ionique
mi 8 mi = Ci ci mole/l), a = r+ + r- ioniques) .Pour des solutions aqueuses et à 25 °C ,
A = 0,51 et B = 0,33
Equation valable pour une force ionique : 10 -2 < I < 10 -1Pour des solutions très diluées, I < 10 -2
Pour des solutions concentrées, I > 10 1
Cest une constante
VII. Calcul du
Soit un électrolyte : BA +B+ + -A-
Par définition :
= (++ .- -)1/( + + -) log( ) = 1/( + + -) log(++.- -) log( ) = 1/( + + -) +log(+) + -log (-) ni Zi = 0 +z+ + -z- = 0, log(i) = -AZi2 I pour I < 10-2I. LES ACCUMULATEURS
Un accumulateur est une chaîne électrochimique à deux électrodes. Les systèmes électrochimiques utilisés doivent avoir des tensions thermodynamiques suffisamment différentes f. e. minimum). 9 On peut définir un accumulateur comme une pile rechargeable, c. a. d qui appliquant aux bornes de la chaîne une différence de potentiel opposée à E.Sa capacité en (A.h)
Son énergie spécifique massique en WhKg-1 et volumique Whl-1. Sa puissance spécifique massique WKg-1 et volumique Wl-1.Son rendement coulombique Q
-Accumulateur au plomb ( Plante) : + PbO2 // H2SO4 / Pb - Accumulateur alcalin au fer-nickel et au fer cadmium nickel :. + Ni2O3, nH2O // KOH / ( Fe , Cd ) - Accumulateur argent zinc. + Ag / AgO // KOH/ Zn - n stables sous la forme Pb ; Pb2+ et PbO2 . Pb Pb2+ + 2e- E0 = -0.13 V/ENH PbO2 + 4H+ + 2e Pb2+ + 2 H2O E0 = 1.45 V/ENHReaction globale :
Pb + PbO2 + 4H+ + 2SO4 2- Pb2+ + SO4 2- 2 H2O + Pb2+ + SO4 2- 10 sulfurique diminue pendant la décharge et croit pendant la charge. 11DIAGRAMME TENSION-pH
Introduction
ces différents corps existent des équilibres qui peuvent être de deux types : - Equilibres acide base, dépendants du pH, mais indépendants du potentiel. - Equilibres redox, dépendants au contraire de la tension et en outre duI. Equilibres acide base.
Soit la réaction acido-basique :
a. Acide + qH2O b. Base + pH+K = BasebH+p / Acidea H2Oq
log K = -1/ ( 2 ,3.RT) / ( i0 ( base) - i0 ( acide)1er cas : Si les deux espèces sont solubles ( acide et base). Le pH de passage
bAcide = aBase = 2ème cas
bAcide = C pH = -1/p log(K) +a/p log(b) -a/p log(C) Dans un diagramme tension pH , ces équilibres sont représentés par des droites verticales.II. Equilibres redox.
Soit la réaction électrochimique suivante :
a Ox + pH + qH2O + n e- b Red 12 i Ox +n e- i E0 = a.0( ox) + q.0(H2O) - b.0(red) / ( 23060.n)E = E0 + 0,06 log( Oxa / Redb) 0,06pH.(p/n)
1er cas : Les deux formes Ox et Red sont dissoutes.
b.Ox = a.Red E = E0 0,06pH.(p/n)+ 0,06/n log( 2ab / 2ba)+ ( a-b)0,06/n logCLe potentiel E dépend de C, sauf pour a = b.
2ème cas : Red )
b.Ox = C E = E0 0,06pH.(p/n)+ 0,06/n a. log(b) + 0,06a/n. logC3ème cas : Si les deux formes sont solides.
quotesdbs_dbs1.pdfusesText_1[PDF] electrocinetique exercices corrigés pdf pcsi
[PDF] electrolyse bateau aluminium
[PDF] electrolyse bateau polyester
[PDF] electrolyse du zinc
[PDF] electromenager discount pau
[PDF] electronic banking definition
[PDF] electronique de puissance cours complet
[PDF] électronique de puissance cours et exercices corrigés pdf
[PDF] electronique de puissance cours gratuit
[PDF] electronique de puissance hacheur exercices
[PDF] electronique de puissance redresseur
[PDF] electronique de puissance thyristor pdf
[PDF] electronique pratique montage pdf
[PDF] electrostatique exercices corrigés gratuit