 L3 Chimie des Matériaux 2014-2015 Conformité
L3 Chimie des Matériaux 2014-2015 Conformité
III - Programme détaillé par matière des semestres S5 et S6 [1] Electrochimie des concepts aux applications- Cours et exercices corrigés
 Chimie (problèmes et exercices) Indice 540.76 Nombres de Titres
Chimie (problèmes et exercices) Indice 540.76 Nombres de Titres
Chimie organique : rappels de cours et exercices corrigés. Gruia Marie 547/03. 08. 3. 2729857567. Exercices corrigés de chimie organique. Gruia
 Filière Sciences de la Matière Chimie Cours Chimie des Solutions
Filière Sciences de la Matière Chimie Cours Chimie des Solutions
Exercice. On considère une solution d'acide faible de concentration initiale C0 S5. = (. . 108. ) 1. 5. 3.2. Conditions de précipitation. A+ + B- → AB.
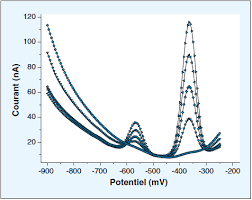 Untitled
Untitled
Exercice 1 : Calculer la force ionique de l'eau de mer dont la composition est : Composé. NaCl. MgCl2 EPREUVE : Electrochimie (sans document). Durée : 2 h ...
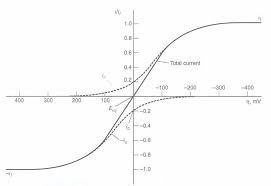 Filière sciences de la matière Cours délectrochimie SMC Semestre 5
Filière sciences de la matière Cours délectrochimie SMC Semestre 5
Tracé du diagramme tension – pH du cuivre – eau à 25°C à partir des potentiels chimiques standards. CHAPITRE III : CINETIQUE ELECTROCHIMIQUE. I. Polarisation et
 «EXERCICES ET PROBLEMES CORRIGES DE
«EXERCICES ET PROBLEMES CORRIGES DE
Sciences-Mathématiques-Physique (SMP) Sciences-Mathématiques-Chimie. (SMC) et Sciences de la Vie (SVI) des facultés des sciences. Il comporte des exercices
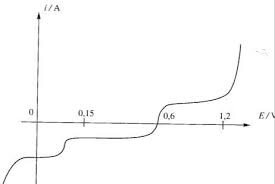 Exercices Cinétique électrochimique – Courbes intensité-potentiel
Exercices Cinétique électrochimique – Courbes intensité-potentiel
Correction détaillée en vidéo. Page 8. Usage personnel uniquement. 8. Exercice n° 5 : Cinétique électrochimique limitée par le transfert de matière*. Soit une
 Exercices de révision- Oxydo-réduction et Piles électrochimiques
Exercices de révision- Oxydo-réduction et Piles électrochimiques
Corrigé. Exercice I. On considère la pile symbolisée par: Cu / Cu2+ (01M) Exercices de révision- Oxydo-réduction et Piles électrochimiques
 Electrochimie des solides - Exercices corrigés avec rappels de cours
Electrochimie des solides - Exercices corrigés avec rappels de cours
Grenoble Sciences est un centre de conseil expertise et labellisation de l'ensei- gnement supérieur français. Il expertise les projets scientifiques des
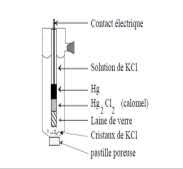 Electrochimie Exercice n° 1 :
Electrochimie Exercice n° 1 :
Electrochimie. Exercice n° 1 : On réalise la pile Daniell en utilisant : - un Correction d'exercice 4 : 1- le couple d'oxydoréduction relatif à cette ...
 Electrochimie des solides - Exercices corrigés avec rappels de cours
Electrochimie des solides - Exercices corrigés avec rappels de cours
Grenoble Sciences est un centre de conseil expertise et labellisation de l'ensei- gnement supérieur français. Il expertise les projets scientifiques des
 Filière sciences de la matière Cours délectrochimie SMC Semestre 5
Filière sciences de la matière Cours délectrochimie SMC Semestre 5
CHAPITRE III : CINETIQUE ELECTROCHIMIQUE. I. Polarisation et surtension d'une électrode. I.1. Définition : I.2. Différents types de courbe de polarisation.
 Chimie (problèmes et exercices) Indice 540.76 Nombres de Titres
Chimie (problèmes et exercices) Indice 540.76 Nombres de Titres
chimiques : rappels de cours exercices corrigés. Gruia
 Electrochim Electrochimie
Electrochim Electrochimie
migration des ions sous l'influence du champ électrique diffusion des ions due au gradient de concentration que provoq ction à l'électrode : voir exercice du TD.
 Chimie Analytique 2éme année pharmacie - Electrochimie - Dr
Chimie Analytique 2éme année pharmacie - Electrochimie - Dr
On mesure les grandeurs électriques (potentiel courant
 Électrochimie
Électrochimie
Constitution d'une pile éq de fonctionnement
 METHODES ELECTROCHIMIQUES POUR LANALYSE IN SITU DE
METHODES ELECTROCHIMIQUES POUR LANALYSE IN SITU DE
18 fév. 2008 J'exprime toute ma gratitude à Maurice Comtat professeur au laboratoire de Génie. Chimique de Toulouse
 Cinétique électrochimique
Cinétique électrochimique
7 avr. 2021 TD 25 – Électrochimie. Correction. Cinétique électrochimique. Exercice 1 : Allure d'une courbe intensité-potentiel.
 Untitled
Untitled
Epreuve d'Electrochimie (Session 2 décembre 2005). Durée : 1 heure. Exercice 1 : Calculer la force ionique d'une solution obtenue en mélangeant 50 cm3
 Cours et exercices corrigés
Cours et exercices corrigés
Connaître un peu de minéralogie est égale- ment utile en chimie minérale et en physique du solide. 1.2.1 Les minéraux comme éléments constitutifs des roches.
Illustration de la couche de Nernst /
Cours de chimie de
llustration de la couche de Nernst / L"actualité chimique - janvier 2003Cours de chimie de seconde année P
janvier 2003 seconde année PSI) !30%#4 #).%4)15% $%3 2%!#4)/.3 %,%#42/#()-)15%3 ȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁ Γ
ΐȁ ,! 2%!#4)/. %,%#42/#()-)15% ȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁ Γ
,! 6)4%33% $% ,! 2%!#4)/. %,%#42/#()-)15% %4 ,! 2%,!4)/. !6%# ,Ȍ).4%.3)4% )ȁ ȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁ Δ
!ȁ ,! 2%!#4)/. %45$)%% Δ "ȁ 2%,!4)/. %.42% ,! 6)4%33% 6 %4 ,Ȍ).4%.3)4% Ε #ȁ #/.6%.4)/. 0/52 ,Ȍ).4%.3)4% ) Ε)) %45$% $%3 #/52"%3 ).4%.3)4%ȃ0/4%.4)%, ȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁ Η
ΐȁ -/.4!'% %80%2)-%.4!, ! Β %,%#42/$%3ȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁ Η
"ȁ 3934%-% 2!0)$% ΐΐ #ȁ 3934%-% ,%.4 ΐΑ $ȁ ./4)/. $% 3524%.3)/. %,%#42/#()-)15% ΐΒ %ȁ #/-0/24%-%.4 $)&&%2%.4 35)6!.4 ,! .!452% $% ,Ȍ%,%#42/$% ΐΖ &ȁ 0!,)%2 $% $)&&53)/. ΐΗ !ȁ !$$)4)6)4% $%3 ).4%.3)4%3 Αΐ "ȁ 02%6)3)/.3 $%3 2%!#4)/.3 ΑΑ))) %45$% $% ,Ȍ%,%#42/,93% ȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁ ΑΔ
ΐȁ #/.$)4)/. $͒%,%#42/,93% ȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁ ΑΔ
15%,,%3 %30%#%3 3/.4 %,%#42/,93%%3 Ȉ ȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁȁ ΑΗ
Situation du chapitre dans le programme :
Dans la première partie, nous étudions l"allure générale des courbes i-E en distinguant les systèmes dits rapides et les systèmes dits lents. Dans une secondepartie, les résultats généraux énoncés lors de l"étude des courbes i-E seront appliqués à
l"électrolyse. n e-ELECTRODE
transfert de chargeélectrode
Ox adsorbé
Red adsorbé
Ox désorbé
Red désorbéOx solution
Red solution
REGION PROCHE DE LA
SURFACE DE L"ELECTRODESOLUTION
transfert de matière"double couche" solutionOx solution
Red solution
SOLUTION
solution e- e- Ox Ox Red réductionélectrode
solution3®¨³ Ȁ ¨ ώ ȃ ȁ&ȁ£
Ox Red oxydationRéduction
ȁ&ȁ£xxxxȝ£³ ώ ȃ ȁ&ȁµRéduction
Ȁ ¨ ώ £1ȝ£³
Par convention :
Le courant est toujours compté
ELECTRODE ¾¾® SOLUTION
e-e- Ox Red oxydation i > 0 compté positivement dans le sens :SOLUTION
Ox Red oxydationSi l"électrode est siège d"une
OXYDATION :
l"électrode fonctionne en dire si elle est le siège d"une les électrons libérés par l"espèce Red sont captés par l"électrode ; une charge dq négative traverse l"interface dans le sens solution ¾¾® l"intensité correspondant à transfert est positiveAinsi pour une
oxydation à l"anode : ia > 0Si l"électrode est siège d"une
REDUCTION :
l"électrode fonctionne enà-dire si elle est le siège d"une
réduction, des électrons passent de l"électrode vers l"espèce en solutionOx1 ; la charge dq traversant l"interface
Si l"électrode est siège d"une
l"électrode fonctionne en anode, c"est-à- dire si elle est le siège d"une oxydation, les électrons libérés par l"espèce Red sont captés par l"électrode ; une charge dq négative traverse l"interface dans le¾¾® électrode et
l"intensité correspondant à ce transfert est positive. oxydation à l"anode :Si l"électrode est siège d"une
l"électrode fonctionne en cathode, c"est- dire si elle est le siège d"une , des électrons passent de l"espèce en solution ; la charge dq traversant l"interface e-e- Ox Red réduction Ox Red réduction i < 0 dans le sens électrode ¾¾® solution est négative et l"intensité correspondant à ce transfert est négative : i c < 0.REM : i = - n.F.dx/dt = - n.F.[dx/dt)
Red - dx/dt)Ox] = - n.F.[vRed - vOx] = - n.F.vRed + n.F. vOx i = - n.F.vRed + n.F. vOx = ic + ia avec : ic = - n.F.vRed < 0 et ia = + n.F. vOx > 0 #/.34!43 Ȁ oxydation de Red réduction de Ox oxydation de Red réduction de Ox0 ± £Î¥¨¨³¨®Ǿ "
OxRedRedOx
ia i / mAEéq
hhhhasurtension faible fort courant branche anodique branche cathodique3¨¦¨¥¨¢ ³¨® Ȁ
E / V surtension faible fort courant branche anodique i / mA hhhh Red Red Ox branche cathodique iCEéq
hhhhca ia surtension fortefort courant OxRed branche anodique E / V fort courant d"oxydation fort courant de réduction hhhhchhhhaVa Vc0®´± ´
$)&&%2%.43 #/-0/24%-%.43 35)6!.4 ,! .!452% $% ,Ȍ%,%#42/$% $)&&%2%.43 #/-0/24%-%.43 35)6!.4 ,! .!452% $% ,Ȍ%,%#42/$% $)&&%2%.43 #/-0/24%-%.43 35)6!.4 ,! .!452% $% ,Ȍ%,%#42/$% hhhha branches cathodiquesbranche anodiqueO2(g)H2O
H2(g)H+
HgFePt
pH = 0E par rapport à l"ECS
Pt hhhhchhhhc iDc branche anodique i / mAEéq
Fe2+Fe3+
Fe2+Fe3+
branche cathodique iDa = kDFe2+.Fe2+ sol iDc = kDFe3+.Fe3+ sol ),,5342!4)/. Ȁ !"3%.#% $%3 0!,)%23 $% $)&&53)/. $!.3 $%58 #!3 branche cathodique i / mA iDc Ag(s) branche anodiqueEéq
AgAg(s)
Ȁ !"3%.#% $%3 0!,)%23 $% $)&&53)/. $!.3 $%58 #!3 Ag+ branche anodique Ag+ Ȁ !"3%.#% $%3 0!,)%23 $% $)&&53)/. $!.3 $%58 #!3 branche anodique d"une espèce oxydable solublequotesdbs_dbs1.pdfusesText_1[PDF] electrocinetique exercices corrigés pdf pcsi
[PDF] electrolyse bateau aluminium
[PDF] electrolyse bateau polyester
[PDF] electrolyse du zinc
[PDF] electromenager discount pau
[PDF] electronic banking definition
[PDF] electronique de puissance cours complet
[PDF] électronique de puissance cours et exercices corrigés pdf
[PDF] electronique de puissance cours gratuit
[PDF] electronique de puissance hacheur exercices
[PDF] electronique de puissance redresseur
[PDF] electronique de puissance thyristor pdf
[PDF] electronique pratique montage pdf
[PDF] electrostatique exercices corrigés gratuit
