 Chapitre 10 :Léquilibre chimique
Chapitre 10 :Léquilibre chimique
https://www.immae.eu/cours/. Page 2. Chapitre 10 : L'équilibre chimique. Thermodynamique. Page 2 sur 27. •. )(CO)(CaO. )( CaCO. 2. 3 g s s. +. = 0. CO2. P. P. Q
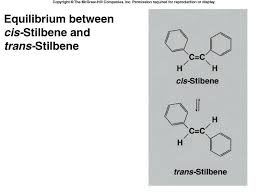 Léquilibre chimique
Léquilibre chimique
quand les vitesses des réactions directes et inverses sont égales et que les concentrations des réactifs et des produits ne changent.
 CINÉTIQUE ET ÉQUILIBRE CHIMIQUE
CINÉTIQUE ET ÉQUILIBRE CHIMIQUE
Ce cours de chimie de la 5e année du secondaire vise à développer vos compétences portant sur l'étude des phénomènes ou des applications technologiques en lien
 Equilibres chimiques
Equilibres chimiques
Exprimer une constante d'équilibre chimique. Déterminer la composition d'un au cours de la réaction chimique en fonction de la quantité de matière des ...
 Faculté des Sciences Meknès Cours THERMOCIMIE-EQUILIBRES
Faculté des Sciences Meknès Cours THERMOCIMIE-EQUILIBRES
équilibre. IV-Loi de déplacement d'équilibres chimiques. Les facteurs qui peuvent influencer un équilibre chimique sont :La pression la température ou la ...
 1-COURS Etat dequilibre dun systeme chimique fr SPC & SM_2021x
1-COURS Etat dequilibre dun systeme chimique fr SPC & SM_2021x
cm . 1) Déterminer les concentrations molaires effectives des espèces chimiques qui se trouvent dans la solution à l'équilibre.
 Chapitre I: Equilibres chimiques
Chapitre I: Equilibres chimiques
On dit un état d'équilibre chimique si la Rx conduit a un mélange dans lequel sont Pour étudier l'évolution d'un système chimique au cours du temps il faut ...
 «EXERCICES ET PROBLEMES CORRIGES DE
«EXERCICES ET PROBLEMES CORRIGES DE
Il comporte des exercices d'application concernant la loi du gaz parfait le premier et le second principe de la thermodynamique et les équilibres chimiques.
 COURS-Equilibre-chimique.pdf
COURS-Equilibre-chimique.pdf
Les notions abordées dans ce chapitre seront précisées et justifiées dans le cours de thermodynamique physique et chimique de PTSI et de PT. I – Généralité sur
 Chapitre 2 - Évolution spontanée dun système chimique
Chapitre 2 - Évolution spontanée dun système chimique
On dit alors que la réaction est non totale ou équilibrée. Taux d'avancement. On définit le taux d'avancement τ comme étant le rapport entre l'avancement final
 Chapitre 10 :Léquilibre chimique
Chapitre 10 :Léquilibre chimique
4.0 International”. https://www.immae.eu/cours/ On ne peut écrire la loi d'action de masse qu'à l'équilibre chimique. • Il ne faut pas confondre 0.
 Equilibres chimiques
Equilibres chimiques
Exprimer une constante d'équilibre chimique Il se produit souvent un équilibre avec au final un ... au cours de la réaction chimique.
 COURS-Equilibre-chimique.pdf
COURS-Equilibre-chimique.pdf
Les notions abordées dans ce chapitre seront précisées et justifiées dans le cours de thermodynamique physique et chimique de PTSI et de PT. I – Généralité sur
 CINÉTIQUE ET ÉQUILIBRE CHIMIQUE
CINÉTIQUE ET ÉQUILIBRE CHIMIQUE
Bienvenue dans le cahier d'apprentissage du cours Cinétique et équilibre chimique. Ce cours de chimie de la 5e année du secondaire vise à développer vos
 Chapitre 2 - Évolution spontanée dun système chimique
Chapitre 2 - Évolution spontanée dun système chimique
2.1 Équilibre chimique. 2.1.1 Réaction totale ou non totale. Lors d'une transformation chimique on dit que la réaction est totale si elle s'arrête
 Léquilibre chimique
Léquilibre chimique
que les concentrations des réactifs et des produits ne changent plus dans le temps l'équilibre chimique est atteint. • l'équilibre chimique est donc un
 Terminale générale -Evolution spontanée dun système chimique
Terminale générale -Evolution spontanée dun système chimique
Evolution spontanée d'un système chimique – Fiche de cours. 1. Etat d'équilibre d'un système a. Transformation non totale.
 Cours Thermo Chahra
Cours Thermo Chahra
La thermodynamique chimique + les équilibres chimiques. Avant propos: Ce cours de thermodynamique est destiné aux étudiants de 1er années des sciences.
 Équilibre chimique
Équilibre chimique
Cours 7 : Équilibre chimique. Blaise Pascal PT 2021-2022. Notions et contenus. Capacités exigibles. Entropie de réaction. Entropie standard de réac-.
 Les transformations de la matière
Les transformations de la matière
EQUILIBRE CHIMIQUE ET RELATION DE GULDBERG ET WAAGE OU LOI D'ACTION DES MASSES Au cours d'une transformation nucléaire le nombre de protons Z d'un ...
UNIVERSIT MENTOURI 1 INSTITUT DES SCIENCES VTRINAIRES DPARTEMENT PRCLINIC CHIMIE GNRALE 2018-2019 Dr Chahra BOUCHAMENI P MENHANE⇒#⇒⇒3.3.2 Entropie molaire absolue. ........................................................................ 25 3.3.3 Calcul de lÕentropie molaire standard S¡. ............................................... 25 3.3.4 Comment calculer S¡T pour un compos pur ? ........................................ 25 3.4 LA VARIATION DÕENTROPIE LORS DÕUNE REACTION CHIMIQUE ........................ 26 3.5 LÕENTHALPIE LIBRE DÕUNE REACTION CHIMIQUE ............................................. 27 3.5.1 Calcul de lÕenthalpie libre G dÕun constituant gazeux. ........................... 27 3.5.2 Relation entre G et lÕactivit a. ................................................................ 28 3.5.3 Calcul de lÕenthalpie libre de raction ⇒rG(T) .......................................... 28 ;"2$*"$67&2&"/$%$/$'1$*"?"<&<2&)@/3.4&$"1)'*$&22$$"+++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++",;"
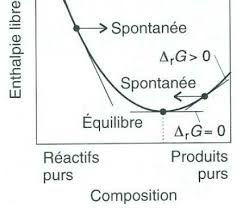
"=#)()(ractifsEproduitsEH rUNIVERSIT MENTOURI 1 INSTITUT DES SCIENCES VTRINAIRES DPARTEMENT PRCLINIC CHIMIE GNRALE 2018-2019 Dr Chahra BOUCHAMENI P MENHANE⇒#D⇒⇒3.5 LÕenthalpie libre dÕune raction chimique LÕenthalpie libre (G) est une fonction indispensable pour lÕtude des ractions chimiques ; elle permet de prvoir si une raction chimique effectue T et P est thoriquement possible et dans quel sens elle volue. La relation suivante reprsente la fonction dÕtat dite de GIBBS appele enthalpie libre. ⇒G¡ peut tre aussi calcul selon lÕexpression suivante : "G¡ peut tre calcul aussi une temprature T est donne par la relation suivante : Avec et sont calcules en appliquant la loi de Kirchoff. LÕenthalpie libre standard de tous les corps simples est nulle : ⇒rG¡ =0 ¥ Si la raction est spontane, < 0. ⇒ sens 1 ¥ Si la raction est quilibre, = 0. ⇒ quilibre ¥ Si la raction a besoin dÕun catalyseur, > 0. ⇒ sens -1 3.5.1 Calcul de lÕenthalpie libre G dÕun constituant gazeux. G = H&TS ⇒ dG = dH&TdS&SdT = (VdP+TdS)-TdS-SdT avec dH = VdP + TdS ⇒ dG = VdP Ð SdT T = cte ; dT = 0 ⇒ dG = VdP A@"B"A4"C"("A*"⇒G = ⇒⇒H Ð T ⇒S ⇒G¡298 = ⇒⇒H¡298 Ð T⇒⇒S¡298 ⇒rG¡298 = ⇒⇒⇒⇒G¡298 (produits )Ð ⇒⇒⇒G¡298(ractifs) ⇒G¡T = ⇒⇒H¡T Ð T⇒⇒S¡T
UNIVERSIT MENTOURI 1 INSTITUT DES SCIENCES VTRINAIRES DPARTEMENT PRCLINIC CHIMIE GNRALE 2018-2019 Dr Chahra BOUCHAMENI P MENHANE⇒#E⇒⇒1 mole de gaz parfait ⇒ PV = 1 RT ⇒ V = RT/P dG = VdP = RT dP/P ⇒ ⇒dG = RT⇒dP/P ⇒ G = RT Ln P + cte Prf. = P¡ = 1 bar ⇒ G = G¡ dÕo cte = G¡ & RT Ln P¡ dÕo G = RT Ln P + G¡& RT Ln P¡ = G¡ + RT Ln P/P¡ 3.5.2 Relation entre G et lÕactivit a. 3.5.2.1 Enthalpie libre dÕun compos X. GX(T) = G¡X(T) + RT Ln aX avec a(X) : activit du constituant (X) Solide pur : a(X) = 1 Liquide pur : a(X) = 1 (⇒ solvant) Solution : a(X) = Ci / C¡ avev Ci : concentration et C¡ : concentration de rfrence = 1 mol.L-1 Gaz parfait : a(X) = Pi / P¡ avec P¡ : pression de rfrence = 1 bar 3.5.2.2 Cas dÕun mlange de plusieurs gaz A, B et C. GA (T) = G¡A (T)+ RT Ln P(A) / P¡ pression partielle du gaz A dans le mlange tat de rfrence : gaz A sous la pression P¡ = 1 bar De mme pour les gaz B et C, on a : GB (T) = G¡B (T)+ RT Ln P(B) ; GC (T) = G¡C (T)+ RT Ln P(C) 3.5.2.3 En solution : C¡ = concentration de rfrence = 1 mole.L-1 3.5.3 Calcul de lÕenthalpie libre de raction ⇒rG(T) ¥ Exemple 1 G=G¡ +RT Ln P/P¡ P¡ = 1 bar
quotesdbs_dbs1.pdfusesText_1[PDF] equilibre chimique le chatelier
[PDF] équilibre concurrentiel def
[PDF] equilibre concurrentiel et optimum de pareto
[PDF] equilibre d'un solide mobile autour d'un axe fixe exercices corrigés
[PDF] équilibre de nash pdf
[PDF] equilibre de pareto
[PDF] équilibre en stratégie dominante
[PDF] equipe mobile bru stars
[PDF] equipe mobile charleroi
[PDF] equipe mobile projet 107 tournai
[PDF] equipe mobile psychiatrie
[PDF] équipe mobile soins palliatifs strasbourg
[PDF] equipement c3 picasso confort
[PDF] equipement c4 exclusive 2011
