 1 EXERCICES - CORRIGÉ Équilibrez les équations
1 EXERCICES - CORRIGÉ Équilibrez les équations
Traduisez chaque énoncé par une équation chimique- CORRIGÉ. (ATTENTION ! Il faut aussi les équilibrer ! ! ! !) 1- Le dihydrogène gazeux se combine au
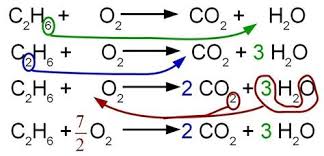 Équilibre equation chimique exercice corrigé
Équilibre equation chimique exercice corrigé
Équilibre equation chimique exercice corrigé 4eme. Equilibrer equation Equilibre Equation Chimique Exercice Corrigé 4eme PDF:Fiche 1Fiche 2Fiche 3Fiche.
 Équilibre equation chimique exercice corrigé
Équilibre equation chimique exercice corrigé
Physique Chimie 4ème Exercices Corrigés Gratuit PDF.Une équation chimique ou une équation de réaction est une représentation d'une réaction chimique au moyen d'
 Exercices : équation-bilan I- Equilibrer les équations suivantes : a) b
Exercices : équation-bilan I- Equilibrer les équations suivantes : a) b
1) Ecrire la formule des trois chlorures métalliques qui se forment. 2) En déduire les trois équations des réactions chimiques qui se produisent dans un feu d'
 4eme - Chimie - Corrigé Exercices chap 1 2 3
4eme - Chimie - Corrigé Exercices chap 1 2 3
La formule chimique de la molécule d'aspirine est : C9H8O4. Exercice 10 page 53 (chapitre 2 du cours). La molécule de saccharose est composée de 12 atomes de
 Bulletin dinformation de Sciences 30 de 2023-2024
Bulletin dinformation de Sciences 30 de 2023-2024
A. Exercice. Filles qui ont fait de l'exercice. B. Exercice. Filles qui n'ont pas fait d'exercice Les élèves n'ont pas à équilibrer les équations chimiques.
 EXERCICE 3ème Equilibrer une équation bilan
EXERCICE 3ème Equilibrer une équation bilan
EXERCICE 3ème. Equilibrer une équation bilan. Equilibrer les équations bilan suivantes : C + O2 CO. N2 + H2 NH3. CuO + C. Cu + CO2. C3H8 + O2. CO2 + H2O. Fe +
 Fascicule SCIENCES PHYSIQUES
Fascicule SCIENCES PHYSIQUES
Exercice 4 Formule chimique. Ecris la formule chimique à partir de la Equilibre les équations chimiques qui suivent : 1) Na + O2 →. Na2O. 7) CO2. + H2O.
 correction exercices Précis de Physique-Chimie chapitre1 à 4
correction exercices Précis de Physique-Chimie chapitre1 à 4
6 févr. 2010 un corrigé sans parfois avoir essayé de le comprendre. Si vous avez des ... Exercice 3 : Équilibrer une équation bilan. Lire page 30 pour ...
 Chimie quantitative – mole masse molaire
Chimie quantitative – mole masse molaire
https://classesbranchees.csf.bc.ca/capsciences/wp-content/uploads/sites/12/Quantitatif-exercices-corrige%CC%81.pdf
 4eme - Chimie - Corrigé Exercices chap 1 2 3
4eme - Chimie - Corrigé Exercices chap 1 2 3
Physique Chimie - Corrigés d'exercices – niveau 4 ème Cette équation est équilibrée car elle vérifie la conservation des atomes.
 ANNALES SCIENCES PHYSIQUES 3ème
ANNALES SCIENCES PHYSIQUES 3ème
Recenser les données connues dans l'exercice ; Les corriger. ... b) Ecrire l'équation-bilan équilibrée de la réaction chimique amorcée par l'étincelle.
 1 EXERCICES - CORRIGÉ Équilibrez les équations
1 EXERCICES - CORRIGÉ Équilibrez les équations
Équilibrez les équations suivantes : Traduisez chaque énoncé par une équation chimique- CORRIGÉ. (ATTENTION ! Il faut aussi les équilibrer !
 Exercices : équation-bilan I- Equilibrer les équations suivantes : a) b
Exercices : équation-bilan I- Equilibrer les équations suivantes : a) b
Ajuster les nombres stœchiométriques des équations chimiques ci-dessous relatives aux principales réactions alors mises en jeu ; C8H18 représente les.
 correction exercices Précis de Physique-Chimie chapitre1 à 4
correction exercices Précis de Physique-Chimie chapitre1 à 4
Problèmes corrigés de physique (CAPES de sciences physiques). © Bréal 2006 Eléments de correction des exercices du chapitre 3 : la réaction chimique .
 Exercices de révisions : Physique-chimie
Exercices de révisions : Physique-chimie
Il s'agit de la réaction de combustion du 11-diméthylhydrazine avec pour comburant
 Ré visions sur lé bilan duné transformation chimiqué Exércicés sur
Ré visions sur lé bilan duné transformation chimiqué Exércicés sur
Cette notion d'équation bilan est très importante en chimie car elle traduit ce qui se passe Corrigé de l'exercice 1 : équilibrer une équation-bilan.
 Cours et exercices de chimie des solutions
Cours et exercices de chimie des solutions
On parle ainsi d'une solution aqueuse lorsque le solvant est de l'eau. Ceci est particulièrement le cas des solutions dans tous les systèmes vivants.
 Transformations chimiques
Transformations chimiques
Exercice 12 : oxydation du cuivre par l'acide nitrique. Corrigé d'équation : ... La constante d'équilibre de cette réaction vaut à 25°C : K°= 1. 10+63.
 Génie de la Réaction Chimique: les réacteurs homogènes
Génie de la Réaction Chimique: les réacteurs homogènes
14 juil. 2022 Exercice : Réaction exothermique équilibrée ... liées aux réactions chimiques (écriture d'une équation de réaction stœchiométrie) ;.

Exercices : équation-bilan
I- Equilibrer les équations suivantes :
a) ................ C4H10 + ........... O2 → .............. CO2 + ................... H2O
b) ................. Ag+ + ............... Cu → ................. Ag + .............. Cu2+
c) C5H12 + ............... O2 → ................... CO2 + ................... H2O d) C....H.... + .......... O2 → 5 CO2 + 4 H2O e) C....H.... + 12 O2 → ................... CO2 + 8 H2O f) C....H.... + 11 O2 → 7 CO2 + ................... g) .......... Cu2+ + ............ Al → ........ Al3+ + ............. Cu h) ........... S2O82- + ........ I- → ............... SO42- + ............ I2 i) .............. Fe3+ + ......... I- → ............... Fe2+ + ............ I2 j) ............... Sn2+ + ......... Fe3+ → ................ Sn4+ + ............. Fe2+ II- Dans chaque cas, écrire l'équation bilan1) L'acétylène C2H2 est préparé en faisant agir de l'eau sur du carbure de
calcium CaC2 . Il se forme simultanément de l'hydroxyde de calcium Ca(OH)2 .2) Combustion complète de l'acétylène dans le dioxygène.
III- 1) Lors de la photosynthèse, les plantes absorbent du dioxyde de carbone et de l'eau pour produire du dioxygène et, par exemple, du glucose C6H1206.2) L'élimination du cholestérol, de formule C27H460, par l'organisme peut, en
première approximation, être assimilée à sa combustion lente, mais complète.3) La fermentation des sucres, de formule C6H1206 , présents dans le moût de
raisin fournit de l'éthanol C2H60 et du dioxyde de carbone. Les sucres sont les seuls réactifs.4) En présence d'une levure, le mycoderma aceti, l'éthanol C2H60 réagit avec le
dioxygène pour donner de l'eau et de l'acide éthanoïque ou acide acétiqueC2H4O2 , principal constituant du vinaigre. IV- Un pot catalytique a pour but d'éliminer les principaux polluants gazeux
présents dans les gaz d'échappement. Ces gaz polluants sont principalement le monoxyde d'azote NO , le dioxyde d'azote NO2 , le monoxyde de carbone CO et les hydrocarbures imbrûlés, souvent notés CxHy . A la sortie d'un pot d'échappement fonctionnant correctement, on ne trouve que du diazote, de l'eau et du dioxyde de carbone. Ajuster les nombres stoechiométriques des équations chimiques ci-dessous relatives aux principales réactions alors mises en jeu ; C8H18 représente les hydrocarbures imbrûlés : a) CO + O2 → CO2 b) C8H18 + O2 → CO2 + H2O c) NO+ CO → N2 + CO2 d) NO2 + CO → N2 + CO2 e) C8H18 + NO → N2 + CO2 + H2O V- Le chlorate de potassium KClO3 , le chlorate de baryum Ba(ClO3)2 et le chlorate de strontium Sr(ClO3)2 sont des solides ioniques, utilisés dans les feux d'artifice pour obtenir respectivement des étincelles violettes, rouges et vertes. Leurs réactions avec du carbone donnent du dioxyde de carbone et le chlorure du métal correspondant.1) Ecrire la formule des trois chlorures métalliques qui se forment.
2) En déduire les trois équations des réactions chimiques qui se produisent dans
un feu d'artifice utilisant les trois chlorates précédents.3) Par réaction entre le chlorate de potassium et l'aluminium, on obtient des
gerbes d'étincelles blanches dues à la formation d'alumine Al203. Ecrire l'équation de cette réaction sachant qu'il se forme aussi du chlorure de potassium. VI- Le nitrobenzène C6H5NO2 est utilisé dans la chimie des colorants ; on le prépare par action de l'acide nitrique HNO3 sur le benzène C6H6. Ecrire l'équation de cette synthèse sachant qu'il se forme également de l'eau.Exercices : équation-bilanCorrectionI-
a) 2 C4H10 + 13 O2 → 8 CO2 + 10 H2O b) 2 Ag+ + Cu → 2 Ag + Cu2+ c) C5H12 + 8 O2 → 5 CO2 + 6 H2O d) C5H8 + 7 O2 → 5 CO2 + 4 H2O e) C8H16 + 12 O2 → 8 CO2 + 8 H2O f) C7H16 + 11 O2 → 7 CO2 + 8 H2O g) 3 Cu2+ + 2 Al → 2 Al3+ + 3 Cu h) S2O82- + 2 I- → 2 SO42- + I2 i) 2 Fe3+ + 2 I- → 2 Fe2+ + I2 j) Sn2+ + 2 Fe3+ → Sn4+ + 2 Fe2+II- 1) CaC2 + 2 H2O → C2H2 + Ca(OH)2
2) 2 C2H2 + 5 O2 → 2 CO2 + H2O
III- 1) 6 CO2 + 6 H2O → C6H1206 + 6 O2
2) C27H460 + 38 O2 → 27 CO2 + 23 H2O
3) C6H1206 → 2 CO2 + 2 C2H60
4) C2H60 + O2 → C2H4O2 + H2O
IV- a) 2 CO + O2 → 2 CO2 b) 2 C8H18 + 25 O2 → 16 CO2 + 18 H2O c) 2 NO+ 2 CO → N2 + 2 CO2 d) 2 NO2 + 4 CO → N2 + 4 CO2 e) 2 C8H18 + 50 NO → 25 N2 + 16 CO2 + 18 H2OV- 1) Chlorure de potassium : KCl
Chlorure de baryum : BaCl2
Chlorure de strontium : SrCl2
2) 2 KClO3 + 3 C → 3 CO2 + 2 KCl
Ba(ClO3)2 + 3 C → 3 CO2 + BaCl2
Sr(ClO3)2 + 3 C → 3 CO2 + SrCl2
3) KClO3 + 2 Al → Al203 + KCl
VI- HNO3 + C6H6 → C6H5NO2 + H2O
quotesdbs_dbs2.pdfusesText_2[PDF] équilibre equation chimique exercice corrigé seconde
[PDF] équilibre equation chimique exercice pdf
[PDF] equipe de france u17 2015 effectif
[PDF] équipement de protection individuelle
[PDF] équipement de protection individuelle (epi)
[PDF] équipement de protection individuelle cnesst
[PDF] équipement de protection individuelle coronavirus
[PDF] équipement de protection individuelle covid
[PDF] équipement de protection individuelle en anglais
[PDF] équipement de protection individuelle english
[PDF] equipment lease agreement california
[PDF] equipment lease agreement sec
[PDF] equipment lease warranty
[PDF] equipment rental agreement
