 Premier et Second Principes
Premier et Second Principes
cv = 715 J/kg/K et cp = 1000 J/kg/K. Le cas d'un solide est particuli`erement simple ce qu'il atteigne son état d'entropie maximale compatible avec les ...
![Le son [k] Ecris les mots sous chaque dessin .! Ecris trois mots en Le son [k] Ecris les mots sous chaque dessin .! Ecris trois mots en](https://pdfprof.com/PDFV2/GoBo/Images13/42_21320_3_.png) Le son [k] Ecris les mots sous chaque dessin .! Ecris trois mots en
Le son [k] Ecris les mots sous chaque dessin .! Ecris trois mots en
Ecris trois mots en remettant les syllabes dans l'ordre. ! ! Ecris une phrase qui explique ce que tu vois.! che ! dic ! tée ! clo ! cal ! cul ! ! !
 Pour enseigner la lecture et lécriture au CP
Pour enseigner la lecture et lécriture au CP
tion induite par les multiples échanges langagiers qu'il peut avoir avec son milieu. cu ck
 Pour enseigner la lecture et lécriture au CP
Pour enseigner la lecture et lécriture au CP
tion induite par les multiples échanges langagiers qu'il peut avoir avec son milieu. cu ck
 ET - Problemes.pdf
ET - Problemes.pdf
q k exp. T. T. T. T tc a ce a c. C.Q.F.D.. 2. A la sortie cs c. T. T = et. Σ. = S son coefficient global d'échange k est estimé par le constructeur à : 65 q6 ...
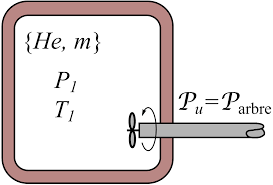 Exercices de Thermodynamique
Exercices de Thermodynamique
On place deux moles de ce gaz dans une enceinte de volume V = 1 L à la température de T = 300 K. Q : Comparer les pressions données par les équations d'état du
 4. Thermochimie
4. Thermochimie
Ti = 20°C à Tf = 100°C est q = CP⋅m⋅ΔT = 4.18 [ J⋅K–1g–1]⋅1 [g]⋅80 [K] q = 334 J. La vaporisation de 1 g d'eau à T = 100°C et à pression constante (1
 La vapeur deau
La vapeur deau
où : • Q est l'énergie reçue (Q>0) ou cédée (Q<0) par le corps (en J). • m est la masse de ce corps (en kg)
 Cahier des sons Dossier réalisé par
Cahier des sons Dossier réalisé par
21 sept. 2019 son [ ã ] an - en - am - em page 22 son [ k ] c - qu - k page 23 son [ I] on - om page 24 son [ wa ] oi page 25 son [j] j - g - ge page 26 son [ ...
 Étude des décompositions des groupes des p-classes didéaux
Étude des décompositions des groupes des p-classes didéaux
avec son relèvement canonique Gai(K^/Q^) ce qui permet d'écrire pour tout n a ki
 q qu
q qu
c
 1 LECTURE Etude de sons [c]
1 LECTURE Etude de sons [c]
Entoure la lettre qui fait le son [c] dans chaque mot. cabane mercredi [c] c qu q k. Lis et classe les mots dans la colonne qui convient.
 Premier et Second Principes
Premier et Second Principes
Ce qu'il y a d'amusant dans ces jeux de notations c'est que l'on passe de qui est environ 25J/mole/K. Dans le cas des solides Cp et Cv ont `a peu pr`es ...
 Corrigé fiche de TD N° 2 (Calorimétrie) 2019-2020 Exercice 1
Corrigé fiche de TD N° 2 (Calorimétrie) 2019-2020 Exercice 1
Cp - Cv = R. Alors Q 12 = 1?2. m c dT = m c1?2. dT. Q = m c dT c : capacité calorifique massique en ( J.Kg. -1. K. -1. ) Q 1
 10 texte son [k]
10 texte son [k]
Lecture : texte autour du son [k]. Le petit coq a perdu sa voix. Il a trop crié chaque matin. Le plus fort cocorico qu'on n'ait jamais entendu !
 Exercices de Thermodynamique
Exercices de Thermodynamique
2) Montrer qu'il existe un unique état C tel que : (. ?P. ?V )T= 0 et ( 2) Calculer son volume molaire sous P = 1 000 bars et à T = 293 K. Commenter.
 Pour enseigner la lecture et lécriture au CP
Pour enseigner la lecture et lécriture au CP
de lecture pour le CP ? 108 Qu'est-ce qu'un manuel de lecture ? 111 Quelle place accorder au manuel dans l'enseignement de la lecture ?
 lecture : LE SON [k] C c c C CP
lecture : LE SON [k] C c c C CP
J'ai constaté qu'avec le coloriage les élèves lisent la première syllabe et cherchent dans leur tête un mot possible. Ils cherchent ensuite s'il y a dans les
 Dictée : le son [ K ]
Dictée : le son [ K ]
Mon oncle pose du sucre et du café dans son sac magique. . Qui chante à la chorale ? Que mange le kangourou ? C'est les vacances je suis content. .
 Chapitre 3 LES GAZ PARFAITS : EXEMPLES DE CALCULS DE
Chapitre 3 LES GAZ PARFAITS : EXEMPLES DE CALCULS DE
R est la constante des gaz parfaits Cv et Cp sont les chaleur [C]. [C0]. (3.3). †Remarquons qu'à la limite T ? 0 l'entropie ne devient pas nulle.
 Le son [k] - CP - 4ème période - le stylo de vero - Eklablog
Le son [k] - CP - 4ème période - le stylo de vero - Eklablog
8 fév 2016 · Le son [k] - CP - 4ème période Travail sur le son [k] avec différentes graphies : c (ca cu co) k et qu Les caractéristiques de la lettre
 [k] c q qu k – Son simple : CP - PDF à imprimer - Pass Education
[k] c q qu k – Son simple : CP - PDF à imprimer - Pass Education
Le son [k] k c q qu pour le niveau CP : Ortho' fléchés en phonologie Apprendre l'orthographe des sons à graphies multiples en s'amusant Grâce au nombre de
 [PDF] Le son[K ] c qu q k ck ch cc - Bout de Gomme
[PDF] Le son[K ] c qu q k ck ch cc - Bout de Gomme
du café une cabane le calcul le cahier un camion un canard un cadeau la classe la cuisine un cochon le cœur le cou de la couleur un crocodile une quille q k
 [PDF] lecture : LE SON [k] C c c C CP
[PDF] lecture : LE SON [k] C c c C CP
lecture : LE SON [k] C c c C leçon 17 CP 1) Exercices moteurs et de latérisation Exercices de latéralisation 2) Exercices graphiques
 [PDF] Exercices-son-K-n°3pdf - Blogs en classe
[PDF] Exercices-son-K-n°3pdf - Blogs en classe
Entoure le son k Nomme le dessin et colorie-le si tu entends “k ” Repère la place du son « k » et fais une croix dans la case brique raquette cadeau musique
 [PDF] Exercice 1 : Souligne les mots où tu entends le son [K] glace
[PDF] Exercice 1 : Souligne les mots où tu entends le son [K] glace
Exercice 1 : Souligne les mots où tu entends le son [K] glace – couteau – facile – piquer – crayon – coq – incendie – question –
 Le son [k] (CP - CE1 - CE2) Leçons & fiches dexercices PDF
Le son [k] (CP - CE1 - CE2) Leçons & fiches dexercices PDF
Découvrez notre leçon sur le son [k] pour le CP - CE1 - CE2 et nos fiches d'exercices à imprimer (PDF)
 Le son [k] CP - CE1 - CE2 - Fiche & Exercice Phonologie à imprimer
Le son [k] CP - CE1 - CE2 - Fiche & Exercice Phonologie à imprimer
Découvrez notre leçon de phonologie sur le son [k] pour le CP CE1 et CE2 ainsi qu'une série d'exercices d'évaluation à imprimer en PDF
 Le son [k] : « c k qu » - Maxicours
Le son [k] : « c k qu » - Maxicours
Le son [ k ] peut s'écrire de trois façons différentes : - avec la lettre c comme dans « couleur » - avec la lettre k comme dans « koala » - avec la lettre qu
P.-Y. Lagr´ee, Premier et Second Principes
Premier et Second Principes
Nous introduisons dans ce chapitre l"´energie interne et sa variation en fonction de la chaleur et
des travaux re¸cus. Nous d´efinissons ensuite l"entropie.Ces d´eveloppements sont de pr´e-requis pour la suite du cours de mani`ere `a bien comprendre ce
qu"est l"´energie, la capacit´e calorifique... pour un gaz.1 rappel sur les gaz
Cette premi`ere section est l`a pour d´efinir la temp´erature pour un gaz, son ´energie et la
variation de l"´energie par rapport `a la temp´erature : la capacit´e calorifique.1.1 Pression dans les fluides
1.1.1 Pression et travail
Nous commen¸cons par un rappel rapide sur les gaz. La premi`ere quantit´e que nous allons calculer est la pression. Cette quantit´e est fondamentale pour un gaz. Si on se donne un pistonplong´e dans le "vide", il faut exercer une certaine force pour l"empˆecher de bouger. La force par
unit´e de surface est la pression : P=F/S Unit´es :Pest en Pascal (ML-1T-2),Fen Newton (MLT-2), etSenm2(L2), la pression atmosph´erique normale est de 1,013 105Pa= 1013hPa. On d´eplace le piston en exer¸cant uneforceFsur une distance-dx, on comprime ainsi le gaz, le travail effectu´e par l"op´erateur est :
dW=F(-dx) `a cette forceFon associe la pressionF=PeS, o`uPeest la pression ext´erieure. Le travail est donc dW=-PeSdx=-PedV. Il y a un signe moins car lorsque l"on comprime, le volume diminue, on fournit du travail au gaz.C"est l"op´erateur qui exerce cette force, pour le gaz `a l"int´erieur il s"agit du travail des forces
ext´erieures.Attention, si on fait cette manoeuvre lentement, la pression dans l"enceinte s"´equilibre toujours
avecPeet donc dW=-PdV. Le fait queP=Petraduit que la transformation estr´eversible, le syst`eme passe d"un ´etat `a l"autre par une succession d"´etats d"´equilibre.-1.1-Premier PrincipeP
Th´eorieCin´etique
parunit´edesurfaceestlapression: P=F/SUnit´es:PestenPascal(ML
-1 T -2 ),FenNewton(MLT -2 ),etSenm 2 (L 2 5Pa=1013hPa.On
ainsilegaz,letravaileffectu´eest: dW=F(-dx) `acetteforceFonassocielapressionF=P eS,o`uP
e estlapression ext´erieure.Letravailestdonc dW=-P eSdx=-P
e dV.´equilibreavecP
e etdonc dW=-PdV.LefaitqueP=P
e1.2.2Pointdevuemicroscopique
paroi`alavitessev x x elle x estdonc2mv x vontheurterlemurenuntempsΔt=λ/v x .Ilyadonc(λdSN
2V )particules doncλdSN
2V )2mv x v xΔtdSN
V )mv x mv 2 x dSN V Δt surfacedonc: p= Nmv 2 x V -1.2-Fig.1 - lancer un piston en [cliquant sur l"image (Flash!)]1.1.2 Point de vue microscopique, Energie
D"un point de vue microscopique, les atomes (de massem) sont emprisonn´es dans une en-ceinte (Natomes,N >>1, ils ont une vitesse moyenne (not´eev) et une ´energie cin´etique totale
not´ee : E=N12 mv2,il s"agit de l"´energie cin´etique moyenne de toutes les particules pr´esentes dans la boˆıte de volume
V. L"ordre de grandeur deNestNA= 6 1023le nombre d"Avogadro, l"ordre de grandeur de la masse d"un atome d"Azote est de 28g par mole, soit 0.028/6 1023= 4.710-26kg. Ces atomes frappent les parois de l"enceinte. C"est ces chocs qui provoquent la pression. Pardes bilans de quantit´e de mouvement contre la paroi, on ´etablit que la pression en fonction de
la vitesse moyenne s"´ecrit : p=13 nmv2 avecn=N/Vle nombre de particules par unit´e de volume. Donc la relation entre la pression le volume et l"´energie cin´etique est : pV=23 E.On introduit la densit´eρ=Nm/V
1.2 Temp´erature dans les fluides
La temp´erature absolue est par d´efinition une mesure de l"agitation thermique. L"´energie cin´etique 12 mv2. On pose par d´efinition que la temp´erature est la mesure de l"´energie cin´etique moyenne :12 mv2=32 kBT-1.2-Premier Principe
avec la constante de Boltzmann : kB= 1.38 10-23JK-1
Il s"agit plus g´en´eralement de ce que l"on appelle"l"´equipartition de l"´energie". En effet,
nous venons de parler du mouvement de translation, mais on peut ˆetre plus g´en´eral et ´etudier
la rotation autour de diff´erents axes de rotation et la vibration de la particule. En fait, `a chaque
mouvement de la particule est associ´e 12 kBT. Dans le cas de la particule qui se d´eplace en translation, `a chaque direction de vitessevx, v yetvzest associ´ee12 kBT. Ce qui donne bien en tout32 kBT. Si la particule est diatomique,et qu"elle tourne sur elle mˆeme, chaque axe de rotation a une ´energie cin´etiqueJω2. Il lui est
associ´e donc 12 kBTpar rotation, soit doncE=52 kBTDe plus, des vibrations internes peuvent intervenir, ce qui donne encore une ´energie quadratique et donc 2 12 kBTpar vibration (nous en reparlerons pour les solides).Nous constatons que l"´energie interne ne d´epend que de la temp´erature, elle ne d´epend pas
du volume. Dans un gaz r´eel, il y a des interactions entre les mol´ecules et donc donc la distance
entre elles intervient; donc le volume du gaz va intervenir dans l"expression de l"´energie.1.3 Loi de Boyle Mariotte
Expression de la pression s"obtient compte tenu de la d´efinition de la temp´erature, d"o`u pV=NkBT Si on compte les particules avec des moles, on aNA= 6.02 1023le nombre d"Avogadro d"o`u N AkB=R= 8.317J/mol/Ket sinmolest le nombre de moles en jeu (nmolNA=N) : pV=nmolRT En introduisant la densit´eρ=Nm/Von ´ecrit aussip=ρ(kB/m)T, on poser= (kB/m)la valeur de la "constante des gaz parfaits sp´ecifique" dans le cas de l"air, qui est un m´elange
d"Azote (80 % de masse 32 g/mol) et d"Oxyg`ene (20% de masse 28 g/mol) de masse molaire elle vaut 28.96 g/mol. doncr=NAkB/(.028964) = 287. On retiendra que pour l"air r= 287J/kg/K (pour leCO2r=188,9; pour le propaner=189; pourH2r=4124). Pour un "gaz parfait", on ´ecrira maintenant la Loi de Boyle Mariotte sous la forme : p=ρrT,pour l"airr= 287J/kg/K.-1.3-Premier Principe
Ce qu"il y a d"amusant dans ces jeux de notations c"est que l"on passe de diff´erents points de vue suivant les notations adopt´ees. 1°) on a le point de vue des atomes aveckBla constante de Boltzmann, 2°) puis on passe `a un point de vue plus global avec la constanteRpuisque l"on estpass´e `a la mole d"atomes. 3°) on passe au point de vue pratique avecrpuisque l"on utilise l`a les
unit´es de tous les jours.1.4 Chaleur sp´ecifique d"un fluide
Par d´efinition c"est la d´eriv´ee de l"´energie interne par rapport `a la temp´erature, cela permet de
calculer l"accroissement d"´energie interne pour chaque ´el´evation de temp´erature. Cette quantit´e
estfondamentalepour la suite. La capacit´e calorifique `a volume constant est par d´efinition :CV=?∂E∂T
V.On d´efinira par suite une autre fonction thermodynamique appel´ee enthalpie et telleH=E+PV.
La capacit´e calorifique `a pression constants est : CP=?∂H∂T
P. Pour le gaz monoatomique, comme l"´energie totale estE=32 nmolRT C V=32 nmolR. pour un gaz diatomiqueE=52 nmolRTdoncCV=52 nmolR. Pour le gaz monoatomique, comme l"enthaphie totale estE+PV=32
nmolRT+nmolRTsoit donc pour la capacit´e calorifique : C P=52 nmolR.Pour un gaz diatomiqueCP=72
nmolR. On noteγ=Cp/Cv, il passe de pour l"airγ= 1.4. Pour un gaz parfait on voit que l"on a a C p-CV=nmolR, etCV=nmolRγ-1etCP=γnmolRγ-1-1.4-Premier Principe
1.5 Cas des solides
1.5.1 Mod´elisation du solide
Un solide est un assemblage d"atomes dispos´es assez r´eguli`erement. Les atomes sont fix´es les
uns par rapport aux autres et ne peuvent que faiblement bouger contrairement au cas du gaz. Ce faible mouvement est une vibration autour de la position d"´equilibre, soit pour l"axe desx: m2 (x2) +k2 (x2)et idem pour les autres axes. L"´energie par axe, en suivant le th´eor`eme d"´equipartition est donc
22(kBT) et donc (kBT).
1.5.2 Chaleur sp´ecifique
L"´energie totale est donc :
E= 3nmolRT
La capacit´e calorifique
CV=?∂E∂T
V soit CV= 3nmolR
qui est environ 25J/mole/K. Dans le cas des solidesCpetCvont `a peu pr`es la mˆeme valeur.1.6 Chaleur sp´ecifique : Expression massique
Les quantit´es que nous avons introduites sont pour l"instant globales. On a un volumeV,qui contient une ´energieEr´epartie entreNparticules tr`es petites, entre chaque particule, il y
quotesdbs_dbs11.pdfusesText_17[PDF] le son ch ce1
[PDF] le son ch chanson
[PDF] le son ch cp
[PDF] le son ch en francais
[PDF] le son ch en phonétique
[PDF] le son ch et j
[PDF] le son ch exercices
[PDF] le son d'avoine a
[PDF] le son de la lettre c
[PDF] le son de mes airpods est faible
[PDF] le son é ce1 exercices pdf
[PDF] le son é ce2 exercices pdf
[PDF] le son é cp exercices en ligne
[PDF] le son è ê ai ei
