 Guide bonnes pratiques de fabrication
Guide bonnes pratiques de fabrication
6 mai 2019 ... Formation et connaissances. Déterminer le besoin en termes de formation ... cours de fabrication ;. - l'identification de la zone d'atmosphère ...
 GUIDE DACCOMPAGNEMENT PEDAGOGIQUE BACCALAUREAT
GUIDE DACCOMPAGNEMENT PEDAGOGIQUE BACCALAUREAT
maquillage visage est évalué lors de la démonstration d'auto maquillage. ... déroulement du contrôle en cours de formation organisé sous la responsabilité du chef ...
 Ecole Française de Tatouage Protocole Référentiel des bonnes
Ecole Française de Tatouage Protocole Référentiel des bonnes
Il contient également des exemples de fiches techniques de produits en adéquation avec les normes imposées. CE PROTOCOLE NE DISPENSE PAS DE LA FORMATION EN
 Guide pratique professionnels tatouage et perçage
Guide pratique professionnels tatouage et perçage
effraction cutanée de maquillage permanent ou de perçage corporel
 Guide de bonnes pratiques en matière de simulation en santé
Guide de bonnes pratiques en matière de simulation en santé
6 déc. 2012 o CV du formateur (formation programme de simulation mis en œuvre
 Guide daccompagnement pour lorganisation dun événement
Guide daccompagnement pour lorganisation dun événement
Au terme du débat les principales idées sont retransmises au cours d'une • Espace Associatif des Graves – Villenave d'Ornon -Tél. 05 57 14 21 10.
 guide des epreuves pratiques cca
guide des epreuves pratiques cca
Le programme de cette formation est spécifié dans le manuel d'exploitation. Le PAX doit être capable de se situer dans l'espace et dans le temps. Le PNC doit ...
 Recommandations organisationnelles
Recommandations organisationnelles
111. Page 4. 4 Recommandations oRganisationnelles – PouR comPRendRe évalueR et mettRe en œuvRe – sécuRité des Patients en chiRuRgie ambulatoiRe – guide
 Guide de bonnes pratiques en matière de simulation en santé - HAS
Guide de bonnes pratiques en matière de simulation en santé - HAS
6 déc. 2012 L'approche choisie pour ce programme de formation est une approche combinant des cours des formations pra- tiques
 EST2050 : Maquillage – Document dappui
EST2050 : Maquillage – Document dappui
Espace physique et formation de groupes de travail. • Pour les périodes d Le cours EST2050 : Maquillage est divisé en quatre unités d'enseignement.
 EST2050 : Maquillage – Document dappui
EST2050 : Maquillage – Document dappui
de salubrité relatives à ce cours. Espace physique et formation de groupes de travail. • Pour les périodes d'apprentissage théorique il est conseillé de
 MANUEL DE SANTÉ MENTALE ET SOUTIEN PSYCHOSOCIAL
MANUEL DE SANTÉ MENTALE ET SOUTIEN PSYCHOSOCIAL
Au cours de la mise en œuvre du programme le comité fournira un retour d'information régulier sur ses résultats et les plans de formation. Le.
 Manuel de formation - des jeunes au leadership
Manuel de formation - des jeunes au leadership
jeunes Francophones pour renforcer leurs capacités d'intervention et d'influence au cours des différentes actions qu'ils auront à conduire. Ce guide a été
 MODULE ACTIVITES DEVEIL ET DE CREATION (AEC)
MODULE ACTIVITES DEVEIL ET DE CREATION (AEC)
GUIDE PEDAGOGIQUE ACTIVITES D'EXPRESSION ET DE CREATION (CP-CE-CM) (Identification de l'espace approprié à l'apprentissage) ... PLAN DU COURS.
 Code de déontologie des infirmières et infirmiers
Code de déontologie des infirmières et infirmiers
Parce que nous tenons à ce que les infirmières et infirmiers reçoivent la meilleure formation possible en phase avec le développement exponentiel des
 FORMATION DES PAIRS EDUCATEURS
FORMATION DES PAIRS EDUCATEURS
Le guide a été élaboré lors d'un atelier d'élaboration de cours pour les jeunes animateurs. Les organisateurs de l'atelier : Africare et le Centre d'Etudes
 Guide de bonnes pratiques en matière de simulation en santé - HAS
Guide de bonnes pratiques en matière de simulation en santé - HAS
Dec 6 2012 L'approche choisie pour ce programme de formation est une approche combinant des cours
 Guide de bonnes pratiques en matière de simulation en santé
Guide de bonnes pratiques en matière de simulation en santé
Dec 6 2012 Exemple de programme de simulation en chirurgie pour la formation initiale . ... ques et des objectifs
 Pour une meilleure prise en compte de la diversité sexuelle et de
Pour une meilleure prise en compte de la diversité sexuelle et de
non binaires : guide pour les établissements d'enseignement produit par la Table à l'identité de genre de la personne (vêtements coiffure
 Guide bonnes pratiques de fabrication
Guide bonnes pratiques de fabrication
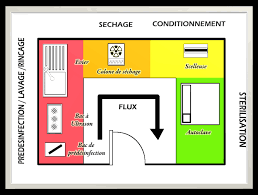
May 6 2019 L'agencement de l'espace réservé à la fabrication et au stockage en cours de production doit permettre de ranger de façon ordonnée et ...
République française
GUIDE DES BONNES PRATIQUES
DE FABRICATION
du 29 décembre 2015, modifiée par les décisions des 30 décembre 2016 et 2019 Décision du 29 décembre 2015 relative aux bonnes pratiques de fabricationJournal officiel de la République française du 29 janvier 2016, texte 34 sur 188. (NOR : AFSM1600529S)
Le directeur général de l"Agence nationale de sécurité du médicament et des produits de
santé (ANSM), Vu l"article 47 de la directive 2001/82/CE et la directive 2001/83/CE du Parlement et du Conseil du 6 novembre 2001, modifiée par la directive 2011/62/UE, instituant un code communautaire relatif aux médicaments à usage vétérinaire et un code communautaire relatif aux médicaments à usage humain, ensemble le guide des bonnes pratiques de fabrication publié par la Commission européenne ; Vu la directive 2003/94/CE de la Commission du 8 octobre 2003 établissant les principes et lignes directrices de fabrication concernant les médicaments à usage humain et les médicaments expérimentaux à usage humain ; Vu le code de la santé publique, et notamment les articles L.5121-5, L.5124-1, L.5138-1, L.5138- 3,R.5124-1 et R.5138-1 et suivants ;
Vu l"avis de l"Agence nationale de sécurité sanitaire de l"alimentation, de l"environnement et du
travail en date du 14 septembre 2015 ;Considérant la publication par la Commission européenne de nouveaux chapitres au guide
européen des bonnes pratiques et notamment les chapitres 3, 5, 6 et 8 ; Considérant les modifications successives apportées aux principes de bonnes pratiques de fabricatio n depuis l"intervention de la décision du 4 décembre 2013 ;Considérant qu"afin d"améliorer la lisibilité de ces principes et de faciliter leur connaissance et
leurbonne application par les opérateurs, il y a lieu d"intégrer dans un document unique l"ensemble
de ces modifications en reprenant la présentation du guide européen de bonnes pratiques de fabrication (GMP) tel que publié par la commission européenne,Décide :
Art. 1
er. - Les principes des bonnes pratiques de fabrication sont définis en conformité avec les dispositions annexées à la présente décision. Art. 2 - Les principes de bonnes pratiques de fabrication de la partie I, tels qu"annexés à la présente décision, sont applicables aux établissements pharmaceutiques mentionnés à l"articleL.5124-1 du code
de la santé publique. Ils s"appliquent également aux opérations d"approvisionnement, de conditionnement, d"étiquetage et de stockage de médicaments expérimentaux réalisées par les pharmaciens des lieux de recherches autorisés pour ces opérations au titre du troisième alinéa de l"article L.1121-13 du même code.Art. 3. - Les principes de bonnes pratiques de fabrication de la partie II, tels qu"annexés à la
présente décision, sont applicables aux établissements mentionnés à l"article L.5138-1 du code de la santé publique, se livrant à la fabrication des substances actives entrant dans la composition des médicaments, y compris lorsqu"il s"agit de reconditionnement et de réétiquetage en vue de leur distribution.Art. 4. - La partie III, telle qu"annexée à la présente décision, recueille un ensemble de guides
destinésà clarifier les attentes des autorités sanitaires en matière de fabrication de médicaments.
Ces modèles
de documents ont un caractère informatif. Art. 5. - La nouvelle annexe figurant après la partie III est applicable aux établissements et activités mentionnées aux articles 2 et 3 ;Art. 6. - La décision du 4 décembre 2013 relative aux bonnes pratiques de fabrication est abrogée.
Art. 7. -
Le directeur de l"inspection est chargé de l"exécution de la présente décision, qui sera publiée a u Journal officiel de la République française.Fait, le 29 décembre 2015
D. MARTIN
Décision du 30 décembre 2016 relative aux bonnes pratiques de fabricationLe directeur général de l"Agence nationale de sécurité du médicament et des produits de santé
(ANSM), Vu la directive 2001/82/CE et la directive 2001/83/CE du Parlement et du Conseil du6 novembre 2001, modifiée par la directive 2011/62/UE, instituant un code communautaire relatif
aux médicaments à usage vétérinaire et un code communautaire relatif aux médicaments à usage
humain, ensemble le guide des bonnes pratiques de fabrication publié par la Commission
européenne ; Vu le code de la santé publique (CSP), et notamment les articles L. 5125-1 et L.5138-1 et suivants ; Vu la décision du 29 décembre 2015 relative aux bonnes pratiques de fabrication ;Vu l"avis de l"Agence nationale de sécurité sanitaire de l"alimentation, de l"environnement et du
travail en date du 16 août 2016 ;Considérant la publication par la Commission européenne de nouvelles annexes au guide
européen des bonnes pratiques de fabrication ainsi que des lignes directrices relatives à
l"évaluation formalisée du risque visant à déterminer les bonnes pratiques de fabrication
appropriées pour les excipients utilisés dans les médicaments à usage humain.Décide :
Art. 1er. - Les lignes directrices particulières n°15 et 16 intitulées " Qualification et validation »
et "Certification par une personne qualifiée et libération des lots » figurant dans la partie
" Annexes » du guide de bonnes pratiques de fabrication telle qu"issue de la décision du 29décembre 2015 susvisée sont remplacées par les annexes n°15 et 16 telles qu"annexées à la
présente décision.Art. 2. - Il est inséré en partie III de ce même guide, après les " Exigences internationales
harmonisées pour la certification d"un lot », les lignes directrices du 19 mars 2015 relatives à
l"évaluation formalisée du risque visant à déterminer les bonnes pratiques de fabrication
appropriées pour les excipients utilisés dans les médicaments à usage humain, telles qu"annexées
à la présente décision.
Art. 3. Le directeur de l"inspection est chargé de l"exécution de la présente décision, qui sera
publiée sur le site internet de l"ANSM.Fait, le 30 décembre 2016
D. MARTIN
Décision du 2019 modifiant la décision du 29 décembre 2015 modifiée relative aux bonnes pratiques de fabrication des médicamentsGHIDEULFDWLRQSXEOLpSDUOD&RPPLVVLRQHXURSpHQQH9XOHFRGHGHODVDQWpSXEOLTXHHWQRWDPPHQWVHVDUWLFOHV/HW/9XODGpFLVLRQGXGpFHPEUHPRGLILpHUHODWLYHDX[ERQQHVSUDWLTXHVGHIDEULFDWLRQ&RQVLGpUDQW OD SXEOLFDWLRQ SDU OD &RPPLVVLRQ HXURSpHQQH GX JXLGH GHV ERQQHV SUDWLTXHV GH IDEULFDWLRQ
Article 1
er :Article 2 :
Article 3 :
'0$57,1Fait, le
TABLE DES MATIERES
PARTIE I BONNES PRATIQUES DE FABRICATION DES MEDICAMENTS AUSAGE HUMAIN
8PREAMBULE
INTRODUCTION
CHAPITRE 1 : SYSTEME QUALITE PHARMACEUTIQUE
CHAPITRE 2 : PERSONNEL
CHAPITRE 3 : LOCAUX ET MATÉRIEL
CHAPITRE 4 : DOCUMENTATION
CHAPITRE 5 : PRODUCTION
CHAPITRE 6 : CONTRÔLE DE LA QUALITÉ
CHAPITRE 7 : ACTIVITES EXTERNALISEES
CHAPITRE 8 : RÉCLAMATIONS, DEFAUTS QUALITE ET RAPPELS DEMÉDICAMENTS
CHAPITRE 9 : AUTO-INSPECTION 9 10 12 18 23
2735
45
51
53
58
PARTIE II BONNES PRATIQUES DE FABRICATION POUR LES SUBSTANCES ACTIVES UTILISEES COMME MATIERES PREMIERES DANS LES
MEDICAMENTS
1. Introduction
2. Management de la qualité
3. Personnel
4. Bâtiments et installations
5. Equipements de fabrication
6. Documentation et enregistrements
7. Gestion des matières
8. Production et contrôles en cours de procédé
9. Conditionnement et étiquetage d"identification des substances
actives et des intermédiaire s 10. Stockage et distribution
11. Contrôles en laboratoire
12. Validation
13. Maîtrise des modification
s 14. Refus et réutilisation des matières
15. Réclamations et rappels
16. Fabricants sous contrat (incluant les laboratoires)
17. Agents, courtiers, negociants, distributeurs, reconditionneurs et
réétiqueteur s 18. Dispositions spécifiques pour les substances actives fabriquée
s p ar culture cellulaire / fermentation19. Substances actives utilisées en essais cliniques
20. Glossaire
596 0 63
66
67
70
73
77
79
82
84
85
88
92
93
95
96
97
99
102
104
PARTIE III DOCUMENTS RELATIFS AUX BONNES PRATIQUES DE FABRICATION 109 P
ARTIE IV GESTION DU RISQUE QUALITE (ICH Q9)
Préambule
1. Introduction
2. Champs d"application
3. Principes de la gestion du risque qualité
4. Processus général de gestion du risque qualité
5. Méthodologie de gestion du risque
6. Intégration de la gestion du risque qualité aux activités de l"industrie
et de la réglementation7. Définitions
8. Références
SYSTEME QUALITE PHARMACEUTIQUE (ICH Q10)
Préambule
1. Système qualité pharmaceutique
2. Responsabilité de la direction
3. Amélioration continue des performances du procédé et de la
qualité du produit4. Amélioration continue du systeme qualité pharmaceutique
5. Glossaire
EXIGENCES INTERNATIONALES HARMONISEES POUR LA
CERTIFICATION D"UN LOT
LIGNES DIRECTRICES DU 19 MARS 2015 RELATIVES A L"EVALUATION FORMALISEE DU RISQUE VISANT A DETERMINER LES BONNES PRATIQUES DE FABRICATION APPROPRIEES POUR LES EXCIPIENTSUTILISES DANS LES MEDICAMENTS A USAGE HUMAIN
GUIDE DES BONNES PRATIQUES DE FABRICATION SPECIFIQUESAUX MEDICAMENTS DE THERAPIE INNOVANTE
1. Introduction
2. Approche fondée sur le risque
3. Personnel
4. Locau
x 5 . Équipements6. Documentation
7. Matières premières de départ et matières premières
8. Lots de semences et système de banque de cellule
s 9 . Production10. Qualification et validation
11. Personne qualifiée et libération des lots
12. Contrôle de la qualité
13. Activités externalisée
s 14. Défauts qualité et rappels de produits
15. Mesures de contrôle de l"environnement pour les MTI composé
s e n tout ou partie d"OGM16. Reconstitution du produit après libération des lots
17. Production automatisée des MTI
Glossaire 110
1 10 111112
112
112
116
117
118
120
130
130
131
134
136
141
142
147
151
155
159
163
170
174
184
186
194
200
203
215
223
231
237
238
241
quotesdbs_dbs18.pdfusesText_24
[PDF] La procédure de passation des marchés publics au Maroc - Ena
[PDF] La procédure de passation des marchés publics au Maroc - Ena
[PDF] Principes de Base du Marketing - UPMC
[PDF] Le marketing digital ses formes et ses enjeux pour une - CREG
[PDF] L 'essentiel du plan marketing opérationnel
[PDF] cours de marketing - Jetudie
[PDF] option comptabilité, contrôle et audit - UIR
[PDF] Les céramiques - unf3s - campus numeriques
[PDF] Dérivée d 'une fonction - Exo7
[PDF] IUT GEA, 1re année, Cours de Mathématiques 1 Quelques notions
[PDF] GÉNIE INDUSTRIEL ET MAINTENANCE (GIM)
[PDF] IUT Mesures Physiques
[PDF] l2´economie gestion 2010-11 cours de m´ethodes math´ematiques 3
[PDF] Programme ECT 1 et 2
