 Electrochimie Exercice n° 1 :
Electrochimie Exercice n° 1 :
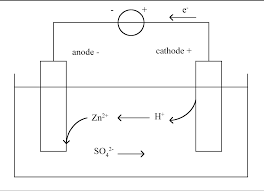
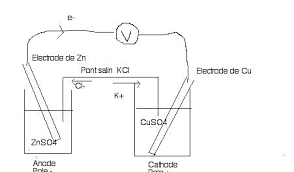
On réalise la pile Daniell en utilisant : - un bécher renfermant 100cm3 d'une solution molaire de sulfate de cuivre dans laquelle plonge une plaque de cuivre ;
 CORRECTION EXERCICES SUR OXYDO-REDUCTION / PILES [ ] [ ]
CORRECTION EXERCICES SUR OXYDO-REDUCTION / PILES [ ] [ ]
EXERCICE 1 : Couples en présence : Fe. 2+. /Fe. E o. 1 = – 044 V. Ag. +. /Ag. E o. 2 ) On realise une pile par l'association de 2 demi-piles : Une demi-pile ...
 Corrigé de lexamen du 20 juin 2007 2 heures
Corrigé de lexamen du 20 juin 2007 2 heures
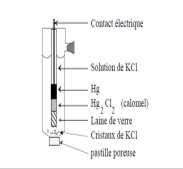
20 juin 2007 b) - Le pont salin est une solution de KCl. Quel est son rôle et comment les ions du sel KCl migrent ils lors du fonctionnement de la pile ?
 Examen du baccalauréat. Section : Mathématiques. Corrigé de l
Examen du baccalauréat. Section : Mathématiques. Corrigé de l
CHIMIE. Corrigé. Chimie. Exercice N°2. 1 –. 2 -. On sait qu'à la température 25°C la force électromotrice d'une pile analogue à la pile DANIELL
 CH.5.6 PILE et SYNTHÈSE – Correction - sujet A
CH.5.6 PILE et SYNTHÈSE – Correction - sujet A
➁ Exercice 2 : Le jus de citron contient de l'acide citrique. 1. Quel est l'ion nécessairement présent dans cette boisson ? Justifier. C'est un acide ; il
 BACCALAURÉAT TECHNOLOGIQUE SCIENCES ET
BACCALAURÉAT TECHNOLOGIQUE SCIENCES ET
La pile Daniell vient corriger certains défauts de la pile Volta : elle est simple de L'objectif de cet exercice est d'étudier une pile Daniell réalisée au ...
 BACCALAURÉAT TECHNOLOGIQUE SCIENCES ET
BACCALAURÉAT TECHNOLOGIQUE SCIENCES ET
La pile Daniell vient corriger certains défauts de la pile Volta : elle est simple de L'objectif de cet exercice est d'étudier une pile Daniell réalisée au ...
 Exercices
Exercices
Exercice 36 corrigé à la fin du manuel de l'élève. 37 a. Demi-pile cuivre : Cu2+. (aq) + 2 e– = Cu(s) (
 DS no8 Piles accumulateurs & électrolyse Exercice 1 – La pile sous
DS no8 Piles accumulateurs & électrolyse Exercice 1 – La pile sous
%20accu%20%26%20e%CC%81lectrolyse-Complet.pdf
 CORRECTION EXERCICES SUR OXYDO-REDUCTION / PILES [ ] [ ]
CORRECTION EXERCICES SUR OXYDO-REDUCTION / PILES [ ] [ ]
EXERCICE 1 : On realise une pile par l'association de 2 demi-piles : Une demi-pile est obtenue en trempant le métal dans sa solution et on relie les 2 ...
 DS no8 Piles accumulateurs & électrolyse Exercice 1 – La pile sous
DS no8 Piles accumulateurs & électrolyse Exercice 1 – La pile sous
%20accu%20%26%20e%CC%81lectrolyse-Complet.pdf
 Electrochimie Exercice n° 1 :
Electrochimie Exercice n° 1 :
On réalise la pile Daniell en utilisant : - un bécher renfermant 100cm3 d'une solution molaire de sulfate de cuivre dans laquelle plonge une plaque de cuivre ;
 Exercices
Exercices
Demi-pile zinc : Zn(s) = Zn2+. (aq) + 2 e– (oxydation) b. La borne positive est la lame de cuivre. Exercice 38 corrigé à la fin du manuel de l'élève.
 Exercices sur les piles et loxydore duction Exercices sur les piles et
Exercices sur les piles et loxydore duction Exercices sur les piles et
L'ion argent Ag+ est l'oxydant de la pile Nickel-Argent* mettant en jeu les couples Ag+/Ag et Corrige des exercices sur les piles et l'oxydore duction.
 CHIMIE PHYSIQUE + - Corrigé
CHIMIE PHYSIQUE + - Corrigé
La double flèche est exigée pour l'écriture de l'équation chimique associée à cette pile. PHYSIQUE. Commentaires. EXERCICE 1. A- 1- uR(t) = Ri(t) B.
 04 - Étude dune pile Ag Zn
04 - Étude dune pile Ag Zn
Corrigé exercice 4. ÉTUDE D'UNE PILE le pôle + de la pile est donc l'électrode de gauche (argent) et le pôle ? l'électrode de droite. (zinc).
 EXERCICE I. La pile sous toutes ses faces (65pts)
EXERCICE I. La pile sous toutes ses faces (65pts)
Daniell ;. - un accumulateur rechargeable ;. - une pile à combustible. Les trois parties de cet exercice sont indépendantes. 1. La pile Daniell. Conçue en 1836
En partenariat avec :
Fiche téléchargée sur www.studyrama.com
LE TALENT C'EST D'AVOIR ENVIE
CHIMIESérie SNº : 37004
Fiche Corrigés
1) 2) Ni (s) = Ni2+(aq)
+ 2 e (× 3) Al3+(aq)
+ 3 e = Al (s) (× 2) __________________________ 3 Ni (s) + 2 Al3+(aq)
= 3 Ni2+(aq)
+ 2 Al (s) 3)Il faut calculer [Ni2+]i et [Al3+]i
A.N. :
12 3 - i2Lmol 0 18,610 115016,0) 432,1(58,70 0,2 ][Ni
VMm 2 Vn 2Vn ][Al
3423423423
)(SOlA )(SOlA )(SOlA lA i3A.N. :
12 3 - i3 Lmol 0 17,790 115016,0)) 432,1(327,02 (0 0,22 ][Al 2 i33 i2 ir, ][Al][Ni QA.N. : 1,11)0 19 7,7()0 11 6,8( Q
2232ir, Q donc la réaction avance spontanément dans le sens indirect de l'équation. 4)
On en déduit qu'il y a oxydation de l'aluminium et réduction des ions nickel. Ainsi la lame d'aluminium est l'anode et la lame de
nickel est la cathode. 2En partenariat avec :
Fiche téléchargée sur www.studyrama.com
LE TALENT C'EST D'AVOIR ENVIE
CHIMIESérie SNº : 37004
Fiche Corrigés
5) Dans une pile, l'anode s'enrichit en électrons, ici par la réaction Al (s) = Al3+(aq)
+ 3 e , donc il s'agit de la borne -. La cathode s'appauvrit en électrons, ici par la réaction Ni2+(aq)
+ 2 e = Ni (s) , donc il s'agit de la borne +. 6)Hors de la pile, le courant électrique circule de la borne + vers la borne -, donc de la demi pile au nickel vers la demi pile à
l'aluminium. Les électrons circulent en sens inverse : de la demi pile à l'aluminium vers la demi pile au nickel. Dans la pile, les cations
circulent de la demi pile à l'aluminium vers la demi pile au nickel et les anions en sens inverse.
1)Les électrons circulent dans le sens contraire du courant électrique, donc de la demi pile au cuivre vers la demi pile à l'or. Dans
la pile les anions vont de la demi pile à l'or vers la demi pile au cuivre et les cations dans l'autre sens.
2)Les électrons arrivent sur l'électrode d'or, ils y sont donc transformés, il y a réduction :
Au3+(aq)
+ 3 e = Au (s) Les électrons sont libérés sur l'électrode de cuivre, donc il y a oxydation : Cu (s) = Cu2+(aq)
+ 2 e L'équation de fonctionnement de la pile dans le sens direct est : 3 Cu (s) + 2 Au3+(aq)
= 3 Cu2+(aq)
+ 2 Au (s) L'anode est l'électrode de cuivre et la cathode est l'électrode d'or. 3) 2 i33 i2 ir, ][Au][Cu QA.N. :
2- 2131ir,
0 18,9)0 10,3()0 10,2( Q
Q par conséquent la réaction de fonctionnement avance bien dans le sens direct. 1)Les couples sont Zn
2+ /Zn et MnO 2 /MnO(OH). A l'anode Zn = Zn 2+ + 2e et à la cathode MnO 2 + H 3 O + e = MnO(OH) + H 2 O.Pour le fonctionnement de la pile :
Zn + 2 MnO
2 + 2 H 3 O = Zn 2+ + 2 MnO(OH) avec le nombre stoechiométrique d'échange d'électrons z = 2. 2) Q max = z · x max· F donc
FzQ x
max maxOr dans la situation considquotesdbs_dbs1.pdfusesText_1
[PDF] exercice placer des points sur un cercle trigonométrique
[PDF] exercice poésie lyrique 4ème
[PDF] exercice pour ouverture du troisième oeil pdf
[PDF] exercice pourcentage 1ere es
[PDF] exercice pourcentage 1ere es pdf
[PDF] exercice pourcentage 3eme
[PDF] exercice pourcentage 4ème
[PDF] exercice pourcentage 5ème
[PDF] exercice pourcentage pdf
[PDF] exercice pourcentage seconde
[PDF] exercice powerpoint 2013
[PDF] exercice powerpoint 2013 pdf
[PDF] exercice présent de l indicatif tous les groupes
[PDF] exercice présent de l'indicatif 6ème ? imprimer