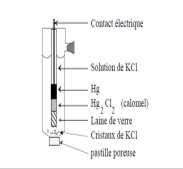
 Electrochimie Exercice n° 1 :
Electrochimie Exercice n° 1 :
On réalise la pile Daniell en utilisant : - un bécher renfermant 100cm3 d'une solution molaire de sulfate de cuivre dans laquelle plonge une plaque de cuivre ;
 CORRECTION EXERCICES SUR OXYDO-REDUCTION / PILES [ ] [ ]
CORRECTION EXERCICES SUR OXYDO-REDUCTION / PILES [ ] [ ]
EXERCICE 1 : Couples en présence : Fe. 2+. /Fe. E o. 1 = – 044 V. Ag. +. /Ag. E o. 2 ) On realise une pile par l'association de 2 demi-piles : Une demi-pile ...
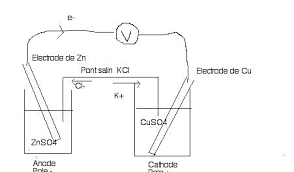 Corrigé de lexamen du 20 juin 2007 2 heures
Corrigé de lexamen du 20 juin 2007 2 heures
20 juin 2007 b) - Le pont salin est une solution de KCl. Quel est son rôle et comment les ions du sel KCl migrent ils lors du fonctionnement de la pile ?
 Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
▻ Exercice n°2. 1) Les électrons circulent dans le sens contraire du courant électrique donc de la demi pile au cuivre vers la demi pile à l'or. Dans la
 Examen du baccalauréat. Section : Mathématiques. Corrigé de l
Examen du baccalauréat. Section : Mathématiques. Corrigé de l
CHIMIE. Corrigé. Chimie. Exercice N°2. 1 –. 2 -. On sait qu'à la température 25°C la force électromotrice d'une pile analogue à la pile DANIELL
 CH.5.6 PILE et SYNTHÈSE – Correction - sujet A
CH.5.6 PILE et SYNTHÈSE – Correction - sujet A
➁ Exercice 2 : Le jus de citron contient de l'acide citrique. 1. Quel est l'ion nécessairement présent dans cette boisson ? Justifier. C'est un acide ; il
 BACCALAURÉAT TECHNOLOGIQUE SCIENCES ET
BACCALAURÉAT TECHNOLOGIQUE SCIENCES ET
La pile Daniell vient corriger certains défauts de la pile Volta : elle est simple de L'objectif de cet exercice est d'étudier une pile Daniell réalisée au ...
 BACCALAURÉAT TECHNOLOGIQUE SCIENCES ET
BACCALAURÉAT TECHNOLOGIQUE SCIENCES ET
La pile Daniell vient corriger certains défauts de la pile Volta : elle est simple de L'objectif de cet exercice est d'étudier une pile Daniell réalisée au ...
 Exercices
Exercices
Exercice 36 corrigé à la fin du manuel de l'élève. 37 a. Demi-pile cuivre : Cu2+. (aq) + 2 e– = Cu(s) (
 DS no8 Piles accumulateurs & électrolyse Exercice 1 – La pile sous
DS no8 Piles accumulateurs & électrolyse Exercice 1 – La pile sous
%20accu%20%26%20e%CC%81lectrolyse-Complet.pdf
 CORRECTION EXERCICES SUR OXYDO-REDUCTION / PILES [ ] [ ]
CORRECTION EXERCICES SUR OXYDO-REDUCTION / PILES [ ] [ ]
EXERCICE 1 : On realise une pile par l'association de 2 demi-piles : Une demi-pile est obtenue en trempant le métal dans sa solution et on relie les 2 ...
 DS no8 Piles accumulateurs & électrolyse Exercice 1 – La pile sous
DS no8 Piles accumulateurs & électrolyse Exercice 1 – La pile sous
%20accu%20%26%20e%CC%81lectrolyse-Complet.pdf
 Electrochimie Exercice n° 1 :
Electrochimie Exercice n° 1 :
On réalise la pile Daniell en utilisant : - un bécher renfermant 100cm3 d'une solution molaire de sulfate de cuivre dans laquelle plonge une plaque de cuivre ;
 Exercices
Exercices
Demi-pile zinc : Zn(s) = Zn2+. (aq) + 2 e– (oxydation) b. La borne positive est la lame de cuivre. Exercice 38 corrigé à la fin du manuel de l'élève.
 Exercices sur les piles et loxydore duction Exercices sur les piles et
Exercices sur les piles et loxydore duction Exercices sur les piles et
L'ion argent Ag+ est l'oxydant de la pile Nickel-Argent* mettant en jeu les couples Ag+/Ag et Corrige des exercices sur les piles et l'oxydore duction.
 CHIMIE PHYSIQUE + - Corrigé
CHIMIE PHYSIQUE + - Corrigé
La double flèche est exigée pour l'écriture de l'équation chimique associée à cette pile. PHYSIQUE. Commentaires. EXERCICE 1. A- 1- uR(t) = Ri(t) B.
 04 - Étude dune pile Ag Zn
04 - Étude dune pile Ag Zn
Corrigé exercice 4. ÉTUDE D'UNE PILE le pôle + de la pile est donc l'électrode de gauche (argent) et le pôle ? l'électrode de droite. (zinc).
 EXERCICE I. La pile sous toutes ses faces (65pts)
EXERCICE I. La pile sous toutes ses faces (65pts)
Daniell ;. - un accumulateur rechargeable ;. - une pile à combustible. Les trois parties de cet exercice sont indépendantes. 1. La pile Daniell. Conçue en 1836
Amérique du sud 11/2008
Depuis la découverte de la pile par Alessandro Volta en 1800, de nombreux scientifiques ont cherché (et cherchent
encore) à fabriquer des piles de plus en plus performantes (transport plus facile, encombrement plus faible, durée
de fonctionnement plus longue, intensité débitée plus grande...).On se propose dans cet exercice détudier quelques caractéristiques de trois modèles de piles :
- une pile "classique ", celle de J. Daniell ; - un accumulateur rechargeable ; - une pile à combustible. Les trois parties de cet exercice sont indépendantes.1. La pile Daniell.
Conçue en 1836 par le physicien britannique John Daniell, elle met en jeu les deux couples Zn2+(aq) / Zn(s) et
Cu2+(aq) / Cu(s). Elle offre lavantage sur la pile de Volta de délivrer un courant constant. Initialement, les deux
solutions étaient séparées par une paroi en terre poreuse. Cette paroi fut remplacée par une feuille de parchemin
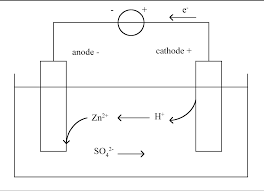
permettant à la pile de débiter un courant plus intense.Le modèle présenté sur la feuille annexe, à rendre avec la copie, est constitué de deux demi-piles reliées par un
pont salin au nitrate de potassium K+(aq) + NO3 (aq).Les solutions aqueuses de sulfate de zinc et de sulfate de cuivre utilisées ont la même concentration molaire en
ions zinc et en ions cuivre : [ Cu2+ ] = [ Zn2+ ] = 1,0 mol.L-1 Lélectrode positive de cette pile est lélectrode de cuivre.1.1. Légender le schéma de la figure 1 de la feuille en annexe, à rendre avec la copie, en indiquant :
- la nature de chaque électrode ; - la nature des ions métalliques présents dans les béchers ; - le sens conventionnel du courant et le sens du mouvement des électrons.1.2. Écrire les équations des réactions qui se produisent aux électrodes en précisant pour chacune delles sil sagit
dune oxydation ou dune réduction.1.3. En déduire équation de la réaction de fonctionnement de la pile.
1.4.1. Donner lexpression littérale du quotient de réaction associé à la réaction dont léquation a été donnée en
réponse à la question 1.3.1.4.2. Calculer sa valeur Qr,i , dans létat initial du système.
1.4.3. Cette valeur est-elle en accord avec la polarité de sa pile indiquée dans lénoncé ? Justifier.
Donnée : Pour la réaction déquation Cu2+(aq) + Zn(s) = Cu(s) + Zn2+(aq), la constante déquilibre vaut K =1,91037.
1.5. Comment évoluent les concentrations des ions métalliques dans chacun des béchers ?
1.6. En déduire le sens du mouvement des ions présents dans le pont salin.
2. Laccumulateur au plomb.
Laccumulateur au plomb a été inventé en 1859 par Gaston Planté. Robuste et bon marché, il peut débiter des
courants de très grandes intensités (plusieurs centaines dampères). Cest pourquoi il est utilisé pour alimenter les
démarreurs des moteurs thermiques (voitures et camions).Un élément daccumulateur est constitué de deux électrodes, lune en plomb Pb(s), lautre en plomb recouverte
doxyde de plomb PbO2(s). Ces deux électrodes sont immergées dans une solution aqueuse dacide sulfurique.
Léquation de la réaction de fonctionnement de laccumulateur en générateur sécrit : PbO2(s) + 4 H+(aq) + Pb(s) = Pb2+(aq) + Pb2+(aq) + 2 H2O(l)2.1. Identifier les deux couples oxydant/réducteur qui interviennent dans le fonctionnement de ce générateur.
On sintéresse dans ce qui suit à la charge de laccumulateur.Lors de la charge, laccumulateur joue le rôle délectrolyseur. Un générateur de charge, de force électromotrice
supérieure à celle de laccumulateur impose le sens du courant (voir figure 2 de la feuille en annexe, à rendre
avec la copie).2.2. Sur la figure 2, indiquer lanode et la cathode de laccumulateur.
2.3. La transformation est-elle spontanée ou forcée ?
2.4. Écrire léquation de la réaction chimique qui modélise dans le sens direct la transformation chimique qui se
produit lors de la charge.2.5. Comment évolue le quotient de cette réaction par rapport à la constante déquilibre lors de cette
transformation ?3. La pile à combustible à hydrogène
les années 1950 que Francis T. Bacon réalise les premiers prototypes. Les piles à hydrogène alimentaient en
EXERCICE I. La pile sous toutes ses faces (6,5pts) chimiephysiquescience.wordpress.com Page 2électrolyte
H+(aq)
H2(g) O2(g)
électrodes poreuses
Accumulateur
au plombFigure 2
Générateur
(chargeur) iélectricité les missions Apollo qui permirent aux astronautes américains de se poser sur la Lune. Elles équipent
encore actuellement les navettes spatiales. Convertisseur dénergie non polluant, la pile à hydrogène serait le
générateur idéal des voitures à moteur électrique mais le coût de fabrication élevé (les électrodes contiennent du
platine qui joue le rôle de catalyseur) et la difficulté de stocker le dihydrogène freinent son développement. Une cellule de pile à hydrogène est constituée de deux électrodes poreuses séparées par un électrolyte (acide dans le cas présent). À la borne négative, le dihydrogène réagit suivant léquation :H2(g) = 2 H+(aq) + 2 e
À la borne positive, le dioxygène réagit suivant léquation :O2(g) + 4 H+(aq)+ 4 e = 2 H2O(l)
Léquation de fonctionnement de la pile sécrit alors :O2(g) + 2 H2(g) = 2 H2O(l)
Des essais montrent quune voiture munie dun moteur électrique alimenté par une pile à hydrogène consomme
2,5 kg de dihydrogène pour parcourir 500 km en 6 h 40 min.
3.1. Calculer la quantité de matière de dihydrogène consommée pendant la durée du trajet.
3.2. En déduire la quantité délectrons (en mol) qui circule dans le circuit extérieur (on pourra saider dun tableau
descriptif de lévolution du système).3.3. Calculer la quantité délectricité totale débitée par la pile, puis lintensité du courant, supposée constante
pendant la durée du trajet.Remarque : lintensité calculée, très grande, ne correspond pas à la réalité car, dans une voiture, plusieurs
éléments de pile sont montés en série. Données : Masse molaire atomique de lhydrogène M(H) = 1,00 g.mol-11 faraday (1F) = 9,65104 C.mol-1
Constante dAvogadro : NA =6,02 1023 mol-1
Charge électrique élémentaire : e = 1,60 10 19 CÀ RENDRE AVEC LA COPIE
Figure 1
()24SO aq()2
4SO aq( ) ( )3K aq NO aq
résistance R + EXERCICE I. La pile sous toutes ses faces (6,5pts) chimiephysiquescience.wordpress.com Page 3 EXERCICE I. LA PILE SOUS TOUTES SES FACES (6,5 points)Amérique du sud 11/2008 CORRECTION ©
1. La pile Daniell.
1.1. Voir figure 1 ci-contre.
énoncé :" Lélectrode positive de cette pile est lélectrode de cuivre. »1.2. oxydation anodique : Zn(s) = Zn2+(aq) + 2 e
réduction cathodique : Cu2+(aq) + 2 e = Cu(s)1.3. Équation de la réaction de fonctionnement de la pile
Cu2+(aq) + Zn(s) = Cu(s) + Zn2+(aq)
1.4.1. Qr =
2 2 Zn aq Cu aq1.4.2. Qr,i =
2 i 2 i Zn aq Cu aq = 11.4.3. Qr,i < K, le système chimique évolue spontanément dans le sens direct .
Le zinc se transforme en ions zinc (II) et libère des électrons, la plaque de zinc est la borne négative de la pile.
1.5. 2+, donc [Cu2+(aq)] diminue.
2+, alors [Zn2+(aq)] augmente.
1.6. Les cations K+ se déplacent vers la cathode. Les anions NO3 anode.2. Laccumulateur au plomb.
réaction fonctionnement accumulateur en générateur : PbO2(s) + 4 H+(aq) + Pb(s) = Pb2+(aq) + Pb2+(aq) + 2 H2O(l)
2.1. couple Pb2+(aq)/Pb(s) oxydation du plomb Pb(s) = Pb2+(aq) + 2 e
couple PbO2(s) / Pb2+(aq) PbO2(s) + 4 H+ + 2 e = Pb2+(aq) + 2H2O(l)Remarque : les demi-équations ne sont pas demandées, mais elles sont nécessaires pour vérifier la cohérence
On sintéresse dans ce qui suit à la charge de laccumulateur. 2.2. 2.3. 2.4.2.5. Spontanément, le système chimique évoluerait dans le sens inverse de la réaction ci-dessus. Qr > K.
Qr diminuerait pour tendre vers K.
La transformation étant forcée, le quotient de réaction augmente et .3. La pile à combustible à hydrogène
3.1. n(H2) =
2H m M avec m en g. n(H2) =32 5 10
2 100 u = 1,25103 mol = 1,3103 mol3.2. -équa2 : n(H2) =
()ne 2 , ou n(e ) = 2.n(H2). n(e ) = 21,25103 = 2,5103 mol3.3. Q = n(e ).F
Q = 2,5103 9,65104 = 2,4108 C
Q = I.t
I = Q t , I = ,82 4125 106 3600 40 60
u u = 1,0104 A on utilise la valeur non arrondie de Q, on convertit t en sFigure 1
()24SO aq()2
4SO aq( ) ( )3K aq NO aq
ions Zn2+(aq) ions Cu2+(aq)R + anode
Zn cathode Cu I eAccumulateur
au plomb Figure 2Générateur
(chargeur) i e consommation des e apportés, il se produit une réduction. cathode. il se produit une oxydation. anode.quotesdbs_dbs1.pdfusesText_1[PDF] exercice placer des points sur un cercle trigonométrique
[PDF] exercice poésie lyrique 4ème
[PDF] exercice pour ouverture du troisième oeil pdf
[PDF] exercice pourcentage 1ere es
[PDF] exercice pourcentage 1ere es pdf
[PDF] exercice pourcentage 3eme
[PDF] exercice pourcentage 4ème
[PDF] exercice pourcentage 5ème
[PDF] exercice pourcentage pdf
[PDF] exercice pourcentage seconde
[PDF] exercice powerpoint 2013
[PDF] exercice powerpoint 2013 pdf
[PDF] exercice présent de l indicatif tous les groupes
[PDF] exercice présent de l'indicatif 6ème ? imprimer
