 Ilyess ben jamaa 1 97274010 Série n°8 : le spectre atomique
Ilyess ben jamaa 1 97274010 Série n°8 : le spectre atomique
Série n°8 : le spectre atomique. Exercice n°1. Page 2. Ilyess ben jamaa. 2. 97274010. Correction. Exercice n°2. Page 3. Ilyess ben jamaa. 3. 97274010.
 Physique atomique et spectroscopie optique
Physique atomique et spectroscopie optique
générale et astrophysique problèmes et exercices corrigés (Denis Gialis & François-. Xavier Désert) • Méthodes numériques appliquées pour le scientifique et
 BAC.ORG.TN
BAC.ORG.TN
Exercice N°2 : (Principale 2: Le diagramme de la figure de l'atome de sodium OIJ."' des etats excites. Dans une lam $> ' v.-a dium
 Atomistique et Chimie Organique Cours et Exercices Corrigés
Atomistique et Chimie Organique Cours et Exercices Corrigés
Spectre d'émission de l'atome d'hydrogène……………………………………… 1.8 ... 1 orbitale atomique 2s + 1 orbitale atomique 2p. 2 orbitales atomiques hybrides sp.
 Notes de cours de PHYSIQUE ATOMIQUE
Notes de cours de PHYSIQUE ATOMIQUE
Plus précisément la spectroscopie atomique consiste en l'étude du spectre 145). 27. Page 31. Dr. M. T. Rouabah. Physique Atomique. 2.5 Exercices. Exercice 1.
 TRAVAUX PRATIQUES DE PHYSIQUE ATOMIQUE ET
TRAVAUX PRATIQUES DE PHYSIQUE ATOMIQUE ET
Comparer ce spectre au spectre d'absorption. L'état 4T2 En déduire un nouveau jeu de valeurs corrigées pour les longueurs d'onde de l'hydrogène atomique.
 Polycopies-En: Spectroscopie Optique et RMN
Polycopies-En: Spectroscopie Optique et RMN
Une série d'exercices corrigés est donnée à la fin de chaque chapitre. Le polycopié est composé de quatre chapitres : • Chapitre I : Rappel sur la structure de
 Exercice corrige chimie atomistique pdf
Exercice corrige chimie atomistique pdf
AccueilSMPC1TD et Exercices corrigés Atomistique Smpc 1 PDF TD et Exercices corrigés -Modèle classique : Modèle de Rutherford Modèle de Bohr Spectre atomique ...
 Exercices corrigés de chimie atomistique pdf
Exercices corrigés de chimie atomistique pdf
-Modèle classique : Modèle de Rutherford Modèle de Bohr Spectre atomique d'émission. -Modèle quantique : Equation de Schrödinger (Résolution) nombres
 Physique atomique et spectroscopie optique
Physique atomique et spectroscopie optique
générale et astrophysique problèmes et exercices corrigés (Denis Gialis & François-. Xavier Désert) • Méthodes numériques appliquées pour le scientifique et
 Chapitre 5 : Physique moderne
Chapitre 5 : Physique moderne
Spectre d'émission de l'atome Corrigé des exercices sur la physique ... peu près la même (1 uma = 1 unité de masse atomique = 1.67 * 10-27 kg) que celle ...
 Expérience n°12 – Spectroscopie
Expérience n°12 – Spectroscopie
13 sept. 2017 expérience on cherchera à déterminer la composition de lampes spectrales atomiques à partir de l'observation de leur spectre d'émission.
 Examen Méthodes spectroscopiques 2
Examen Méthodes spectroscopiques 2
16 déc. 2010 Exercice 1 (3 pts – 10min). Il est possible de doser simultanément par spectroscopie UV-?Visible le cobalt et le nickel dans une.
 Exercices : autour des spectres démission et dabsorption
Exercices : autour des spectres démission et dabsorption
Exercice 6 : spectroscopie d'émission de l'atome d'hydrogène 2) Déterminer le numéro atomique et le nom de l'élément responsable de cette émission.
 Cours de Chimie Structure de la matière
Cours de Chimie Structure de la matière
chapitres avec des exercices corrigés dans chaque chapitre. Corrigés des exercices Chapitre I ... I. Production des spectres d'émission atomique.
 Notes de cours de PHYSIQUE ATOMIQUE
Notes de cours de PHYSIQUE ATOMIQUE
Plus précisément la spectroscopie atomique consiste en l'étude du spectre nécessaire de considérer la constante de Rydberg corrigée pour chaque élément.
 Physique atomique et spectroscopie optique
Physique atomique et spectroscopie optique
éléments fournis par les auteurs (spectre orbitales atomiques
 PHOTOIONISATION SIMPLE ET MULTIPLE DANS LES ATOMES
PHOTOIONISATION SIMPLE ET MULTIPLE DANS LES ATOMES
1 janv. 1978 L. U. R. E. et E. R. Spectroscopie Atomique et Ionique ... phiques toriques corrigés d'astigmatisme peut per- mettre d'espérer amener ...
 Expérience n°2 - CONSTANTE DE STEFAN-BOLTZMANN
Expérience n°2 - CONSTANTE DE STEFAN-BOLTZMANN
température T le spectre d'émission se déplace vers le visible
 Untitled
Untitled
1) Donner le principe de la spectroscopie d'absorption atomique. 2) 5 mL d'une solution de l'échantillon de concentration inconnue sont dilués à 100 mL.
Republique Algerienne Democratique et Populaire
Ministere de l'Enseignement Superieur et de la Recherche ScientiqueUniversite des Freres Mentouri de Constantine
Faculte des Sciences Exactes
Departement de Physique
Notes de cours de
PHYSIQUE ATOMIQUE
pour etudiants deLicence en Physique
Manuscrit prepare par :
Dr. MOHAMED TAHA ROUABAH
rouabah.taha@umc.edu.dzDr. M. T. Rouabah Physique Atomique
Preface
Ce manuscrit de cours initialement prepare suivant le certicat de conformite de la Licence de Physique Fondamentale aupres du Departement de Physique de l'Universite des Freres Mentouri Constantine 1, est etablie de maniere a le rendre accessible a tous les etudiants ayant passe par un tronc commun en sciences exactes. L'objectif du cours et de familiariser les etudiants avec la structure interne de l'atome ainsi que l'interaction de l'atome avec un rayonnement electroma- gnetique. Le modele de Bohr est presente en premier lieux pour l'etude de l'atome d'Hydrogene et des atomes a un seul electron (atomes hydrogeno de). Une ana- lyse ondulatoire est aussi presentee pour l'etude de ces atomes an de mettre en evidence la structure interne atomique et constater les lacunes du modele de Bohr. Par la suite il sera sujet des proprietes des atomes a plusieurs elec- trons a travers l'approximation du champ central moyen. Une fois la structure electronique des atomes expliquee, nous nous interesserons aux regles de transi- tions atomiques regissant les transitions des electrons entre les dierents niveaux d'energie de l'atome. Des notions fondamentales sur les rayons X sont presentees au dernier chapitre de ce manuscrit. Ce cours realise par Dr. Mohamed Taha Rouabah, Maitre de Conference a l'Universite des Freres Mentouri de Constantine, a ete enseigne aux etudiants de Licence (3 eme annee) Physique Fondamentale durant le second semestre des annees universitaires 2015/2016, 2016/2017, 2017/2018 et 2018/2019. iTable des matieres
1 Introduction
11.1 Atome . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
11.2 Interaction Atome - Photon . . . . . . . . . . . . . . . . . . . . .
32 Atome d'Hydrogene et Atomes hydrogeno
des42.1 Modele de Bohr . . . . . . . . . . . . . . . . . . . . . . . . . . . .
42.2 Au-dela du modele de Bohr . . . . . . . . . . . . . . . . . . . . .
102.3 Analyse ondulatoire . . . . . . . . . . . . . . . . . . . . . . . . .
122.4 Solutions de l'equation de Schr
odinger stationnaire . . . . . . . .192.5 Exercices . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
283 Atomes a Plusieurs
Electrons3 0
3.1 Approximation champ moyen central . . . . . . . . . . . . . . . .
313.2 Principe d'exclusion de Pauli . . . . . . . . . . . . . . . . . . . .
323.3 Modele en couches . . . . . . . . . . . . . . . . . . . . . . . . . .
323.4 Conguration electronique . . . . . . . . . . . . . . . . . . . . . .
333.5 Tableau periodique . . . . . . . . . . . . . . . . . . . . . . . . . .
343.6 Moments angulaires atomiques . . . . . . . . . . . . . . . . . . .
354 Transitions Radiatives
3 64.1 Regles de selection des transitions atomiques . . . . . . . . . . .
364.2 Probabilites de transitions . . . . . . . . . . . . . . . . . . . . . .
374.3 Forme des raies spectrales . . . . . . . . . . . . . . . . . . . . . .
375 Rayons X
4 15.1 Le spectre des rayons X . . . . . . . . . . . . . . . . . . . . . . .
415.2 Loi de Moseley . . . . . . . . . . . . . . . . . . . . . . . . . . . .
435.3 L'eet Auger . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
43ii
Chapitre 1
Introduction
Dans ce chapitre nous rappelons quelques notions preliminaires an d'assu- rer une meilleurs comprehension de la suite du cours. Dans ce sens, ce chapitre est accompagne de seances de projections video dans lesquelles un magnique documentaire retracant l'histoire des premiers pas vers l'exploration du monde subatomique, realise par le brillant theoricien anglais Prof. Jim Alkhalili, est visionne et debattu. Ces seances permettent aux etudiants de connaitre le contexte historique et scientique des decouvertes et theories qu'ils auront a etudier dans ce cours. Ces seances de cours video sont aussi l'occasion pour les etudiants de mettre les noms sur les visages de plusieurs scientiques qui ont marque l'histoire de la physique atomique et de connaitre les endroits et les circonstances dans lesquelles ils ont realise leurs decouvertes. Les reproductions a l'identique de certaines experiences qui ont joue un r^ole cruciale dans la decouverte et l'exploration des proprietes atomiques, tel que l'experience de Rutherford, sont aussi presentees dans le documentaire. La vi- deo est interrompu plusieurs fois pendant la seance pour donner des explications supplementaires et passer la parole aux etudiants an de poser leurs questions et de debattre autour des theories et experiences presentees. Nous avons pu constater pendant les trois annees durant lesquelles nous avons assure ce cours que ces seances video permette de destresser les etudiants vis-a-vis du module \Physique Atomique" et leurs donne un grand engouement pour suivre le reste du cours.1.1 Atome
Des l'antiquite les philosophes grecques emettent l'hypothese que la matiere soit composee de minuscules composants indivisibles appeles atomes. Mais ils etaient bien conscients que les atomes etaient tres petits pour ^etre observes m^eme avec le plus puissant des microscopes. Au milieu du 19 eme siecle la vapeur se trouve au cur de la revolution indus- trielle. La qu^ete de l'optimisation de son utilisation pour des besoins militaires et industrielles soulevent la question de comprendre et de predire le comporte- 1Dr. M. T. Rouabah Physique Atomique
ment des particules de l'eau et de la vapeur a pression et temperature elevee. A la n du 19 eme siecle, Boltzmann et ces collaborateurs ont montre qu'en representant la vapeur comme composee d'un grand nombre de petites spheres dures et minuscules il etait possible de deriver de puissantes equations mathe- matiques qui permettent de prevoir le comportement de la vapeur avec une incroyable precision. Cependant la theorie de Boltzmann, juge materialiste et absurde, trouve du mal a se faire accepter par les physiciens de l'epoque et il ni par se pendre an 1906. En 1905, un an avant le suicide de Boltzmann, Einstein publie un article dans lequel il explique le mouvement d'agitation inni des grains de pollen dans l'eau, dit mouvement Brownien, comme etant d^u aux collisions entre ces grains et d'inmes particules constituant l'eau qui s'agitent elles m^eme et qui sont en perpetuelles collisions entre elles et avec les grains de pollen : les atomes. Ein- stein prouve mathematiquement que la taille de l'atome est autour de 10 7mm. L'article d'Einstein clos denitivement le debat sur l'existence de l'atome qui n'est plus mise en doute. \All things are made of atoms : little particles that move around in perpetual motion, attracting each other when they are a little distance apart, but repelling upon being squeezed into one another. The atoms are 1 or 2 angstroms (A) in radius. Another way to remember their size is this : if an apple is magnied to the size of the earth, then the atoms in the apple are approximately the size of the original apple" [1]. 2Dr. M. T. Rouabah Physique Atomique
1.2 Interaction Atome - Photon
1.2.1 Spectre electromagnetique
Le spectre electromagnetique est le terme designant toutes les frequences connues du photon (lumiere ou radiation electromagnetique) et leurs longueurs d'ondes correspondantes. D'autre part, le spectre electromagnetique d'un objet designe l'ensemble des radiations emises ou absorbees par cet objet.1.2.2 Spectroscopie
La spectroscopie consiste en l'etude de l'interaction entre la matiere et la radiation electromagnetique (lumiere) en fonction de sa frequence ou longueur d'onde. Historiquement la spectroscopie a commence par l'etude de la dispersion de la lumiere visible suivant sa longueur d'onde par un prisme. Plus precisement, la spectroscopie atomique consiste en l'etude du spectre electromagnetique absorbe ou emis par un atome. Cela sont appelees les lignes spectrales atomiques. Elle sont dues aux transitions deselectrons de la couche ex- terieure entre les dierents niveaux d'energie. Les atomes d'elements chimiques dierents donnent des spectres dierents. La spectroscopie atomique est ainsi utilisee pour explorer la composante des elements chimiques.1.2.3 Eet photo-electrique
Il consiste en la liberation d'electrons d'un metal lorsque ce dernier est illu- mine par de la lumiere. L'experience montre que les electrons sont emis du metal seulement si la frequence des photons depasse un certain seuil. En dessous de ce seuil aucun electron n'est emis quelque soit l'intensite de la lumiere ou le temps d'illumination.1.2.4 Quantication de l'energie de la radiation electro-
magnetique Pour expliquer l'eet photo-electrique, Albert Einstein a propose l'idee que la radiation electromagnetique (lumiere) soit composee de particules elementaires appeleesphotonouquanta. Le photon se deplace dans le vide a une vitesse c'3108m/s dite vitesse de la lumiere dans le vide et sa masse au repos est nulle. Comme toutes les particules elementaires, le photon montre une dualite onde-corpuscule. Chaque photon possede une energieEqui depend uniquement de sa frequenceet qui prend des valeurs quantiees. Elle est donnee parE=h=hc
;(1.1) ouest la longueur d'onde de la radiation eth= 6:6231034J.s est la constante de Planck. L'energie du photon n'est donc pas continue mais quanti- ee. 3Chapitre 2
Atome d'Hydrogene et
Atomes hydrogeno
des Dans ce chapitre nous abordons l'etude de l'atome d'Hydrogene a travers le modele de quantication de Bohr. Ce modele permet d'expliquer les resultats experimentaux revelant des spectres atomiques discontinues. Nous verrons par la suite que les relations de Bohr s'appliquent aussi sur les atomes a un seul electron dits atomes Hydrogeno des. Il sera sujet aussi des moments cinetique et magnetique de l'electron et du noyau et leurs repercutions sur le diagramme d'energie atomique.2.1 Modele de Bohr
2.1.1 Le spectre de l'atome d'Hydrogene
Le plus leger et le plus simple des atomes est l'atome d'Hydrogene qui se compose d'un noyau et d'un seul electron. Il est alors pas surprenant que les resultats des mesures spectroscopiques montrent que l'Hydrogene possede le spectre le plus simple de tous les elements. Rappelons que le spectre atomique represente l'ensemble des radiations lumineuses emises par l'electron excite de l'atome lors de son retour vers des niveaux d'energie moins eleves. Les resultats experimentaux montrent quetoutesles longueurs d'ondes des lignes spectrales de l'atome d'Hydrogene peuvent ^etre obtenues par une relation empirique unique ditela formule de Rydberg: 1 =R1n 211n22
;(2.1) ouR= 1:09677103A1est la constante de Rydberg etn1;n2sont des entiers representant respectivement le niveau d'energie d'arrivee et de depart de la ligne spectrale. De plus, il a ete trouve experimentalement que les dierentes lignes spectrales dans les regions visibles et non-visibles du spectre de l'atome d'Hydrogene sont systematiquement regroupees dans plusieurs series suivant les combinaisons sui- vantes : 4
Dr. M. T. Rouabah Physique Atomique
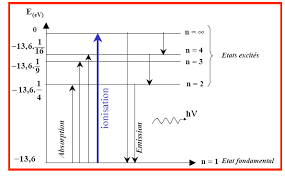
Figure 2.1.Spectre d'emission (diagramme des longueurs d'ondes emises) de l'atome d'Hydrogene incluant les quatre premieres series. Le nombre quantique principal de chaque niveau ainsi que les energies potentielles correspondantes en eVsont indiques a gauche et a droite de l'image respectivement [2]. |n1= 1 etn2= 2;3;4;:::donnent la serie de Lyman (region de l'ultra- violet), |n1= 2 etn2= 3;4;5;:::donnent la serie de Balmer (region visible), |n1= 3 etn2= 4;5;6;:::donnent la serie de Paschen (region infrarouge), |n1= 4 etn2= 5;6;7;:::donnent la serie de Brakett (region infrarouge lointain), et ainsi de suite pour d'autres series dans l'infrarouge plus lointain (voir Fig. 2.12.1.2 Modele de Bohr pour l'atome d'Hydrogene
Rutherford et ses collaborateurs ont conclus, suite a leurs experience realisee en 1911, que l'atome est constitue d'un noyau positivement charge, concentrant l'essentiel de la masse de l'atome dans un rayon environ 100.000 fois plus petit que l'atome lui-m^eme, et d'electrons negativement charges tournant en orbite autour de ce noyau sous l'action de l'interaction electrostatique. Ainsi, dans le modele de Rutherford l'electron se deplace dans le champ de Coulomb du noyau en orbite tel un systeme planetaire. L'electron etant une particule chargee en mouvement circulaire, il est accelere sous l'eet de la force de Lorentz :F=eE+evB;(2.2)
avecevB=mev2=rouEetBsont les champs electrique et magnetique,e;vet m esont la charge, la vitesse et la masse de l'electron respectivement etrrepre- sente la distance entre le noyau et l'electron. D'autre part, il est connu qu'une particule chargee acceleree perd de l'energie en emettant des ondes electroma- gnetiques. Si les lois de la physique classique (loi de Newton et les equations de Maxwell) sont appliquees au modele de Rutherford, elles impliqueront que dans 5Dr. M. T. Rouabah Physique Atomique
un temps de l'ordre de 1010s, l'atome aura emit toute son energie et l'electron
s'ecrasera sur le noyau. Cela est clairement contradictoire avec les resultats ex- perimentaux de Rutherford et constitue une preuve que les lois de la physique classique doivent ^etre modiees a l'echelle atomique. Un autre resultat experimental non explicable par le modele de Ruther- ford consiste en les mesures du spectre d'emission discret de l'Hydrogene entre autre (voir Fig. 2.1 ), alors que la theorie classique prevoit naturellement que les spectres doivent ^etre continus et non pas divises en raies avec les longueurs d'ondes donnee par la formule de Rydberg. En 1913 Niels Bohr a developpe une theorie pour l'atome d'Hydrogene a partir de laquelle la formule de Rydberg peut ^etre derivee. Le modele de Bohr se base sur une image planetaire de l'atome d'Hydrogene dans laquelle un leger electron charge negativement tourne autour d'un noyau lourd charge positive- mentsur des orbites speciques autoriseessupposes ^etre circulaires de rayonr. La force attractive de CoulombF=kZe2r
2;(2.3)
aveck= 1=4"0= 9:0109Nm2=C2,"0la permittivite de l'air etZle nombre atomique (nombre de protons dans le noyau), maintien l'electron sur son orbite. Sur les orbites autorises, la vitesse orbitale de l'electron est donnee en fonc- tion du rayon de son orbite par la relation v2=kZe2m
er:(2.4) L'energie totale de l'electron sur son orbite (energie potentielle + energie cinetique) est donnee parE=kZe22r:(2.5)
Quantication :Nous arrivons a present la ou le modele de Bohr se distingue radicalement de l'image classique que nous avons evoque precedemment : la quantication. Vu que l'electron se deplace sur son orbite avec une quantite de mouvementmev, une onde de De Breglie lui sera associee avec une longueur d'onde=h=mev. La theorie de Bohr consiste a dire qu'une onde ne peut ^etre associee a une orbite electronique sauf si la circonference de l'orbite est un multiple entier de la longueur d'onde. Ainsi le rayon des orbites autorisees est quantie tel que 2r=n; =nhm ev;(2.6) 6Dr. M. T. Rouabah Physique Atomique
La quantiteL=mevrrepresente le moment cinetique de l'electron se deplacant sur son orbite de rayonr. Elle est alors donnee par :L=mevr;
=nh2; =n~:(2.7) Ainsi, dans la theorie de Bohr le moment cinetique estquantiea travers la relationL=n~oun= 1,2,3, ...est un entier positif.En resolvant les equations (
2.4 2.5 ) et ( 2.7 ) pour les inconnusr,Eetv nous arrivons a : r n=r0Z n2; r0=~2m e4"0e2;(2.8)
v n=Zv01n ; v0=1~ e24"0;(2.9)
E n=Z2E01n2; E0=me2~2
e24"0 2 :(2.10) L'etat d'energie minimale (n= 1) est appeleetat fondamental. Notez quer0 correspondant au rayon de l'etat fondamental de l'atome d'Hydrogene est aussi notea0et appele rayon de Bohr. Le modele de Bohr postule que sur les orbites preferentielles autorisees de l'atome, speciees par les equations ( 2.8 2.10 ) et ( 2.9 ), l'electron n'emet pas de radiation. L'electron emet une radiation si il se deplace d'une orbite autori- see donnee vers une autre orbite autorisee d'energie inferieur. Le processus de radiation sera discute dans la section suivante. Nous pouvons remarquer que les quantitesr0,E0etv0dependent unique- ment des constantes"0;e;meet~. En utilisant les valeurs numeriques de ces constantes nous obtenons r0= 0:529A; v0=c137
; E0= 13:58 eV:(2.11) Pour l'atome d'Hydrogene (Z= 1) a l'etat fondamental (n= 1) nous obte- nonsr1=r0(dit rayon de Bohr),E1=E0etv1=v0. Il est a noter que ces valeurs donnees par la theorie de Bohr sont en accord avec les resultats experi- mentaux mesurant le rayon et l'energie d'ionisation de l'atome d'Hydrogene. 2.1.3Emission de radiation dans le modele de Bohr
Bohr postule qu'un atome emet une radiation uniquement quand un electron initialement sur l'une des orbites autorisees d'energieEn2passe a une autre orbite autorisee avec une energie inferieureEn1< En2. L'energie du photon emis lors de cette transition sera egale a la dierence d'energie entre les deux 7Dr. M. T. Rouabah Physique Atomique
niveaux d'energie de l'electron, E =En2En1 =h hc :(2.12) Ainsi la longueur d'onde du photon emis sera deduite comme suit 1 =1hc (En2En1):(2.13) En substituant les valeurs des energies orbitales donnees par l'eq.( 2.10 ) nous obtenons 1 =22k2e4meZ2h 3c 1n 211n22
=R1Z21n 211n
22
;(2.14) avec R
1=22k2e4mec2(hc)3= 1:09737103A1;(2.15)
la constante de Rydberg. Masse reduite :Dans cette analyse pour obtenirR1il est suppose que le noyau charge positivement est tellement lourd compare a l'electron qu'il peut ^etre considere comme inniment lourd (masse innie).R1est alors appelee la constante de Rydberg pour les atomes lourds. Si la masse nie du noyau est prise en consideration, le mouvement du systeme compose de l'electron de masseme et du noyau de masseMest equivalent au mouvement d'une particule de masse reduite =meMm e+M; me1 +me=M;M1 +M=me;(2.16)
orbitant autour du centre de masse du systeme noyau-electron. Dans ce cas il est necessaire de considerer la constante de Rydberg corrigee pour chaque element de noyau de masseMtel que : RM=R11 +me=M;(2.17)
Par example,me=MH= 1=1836 et la constante de Rydberg pour l'atome d'Hydrogene est donnee par RH=R11 +me=MH;
1:09737103A11 + 1=1836;
= 1:0968103A1:(2.18) 8Dr. M. T. Rouabah Physique Atomique
Cette valeur est en accord avec la valeur experimentale precedemment utilisee dans l'equation ( 2.1 R expH= 1:0967758103A1:(2.19)
2.1.4 Diagramme des niveaux d'energie dans le modele de
BohrL'eq.(
2.10 ) determine les etats d'energie autorises pour chaque atomes. Ces etats d'energie composent lediagrammes des niveaux d'energiede l'atome. Les niveaux d'energie autorises pour l'atome d'Hydrogene (Z= 1) sont traces sur la Fig. 2.1Les transitions atomiques sont indiquees par des
eches entre le niveau d'energie de depart (initial)n2et le niveau d'energie d'arrivee (nal)n1. L'en- semble des radiations emises par ces transitions constituent le spectre de l'atome d'Hydrogene. NB: Le niveau d'energie de l'atome correspond aux niveaux d'energie de ces electrons.2.1.5 Modele de Bohr pour les atomes hydrogeno
desUn atome hydrogeno
de est un atome qui a perdu tous ses electrons sauf un seul. Ainsi les atomes hydroginoquotesdbs_dbs18.pdfusesText_24[PDF] exercices corrigés statistiques 3eme pdf
[PDF] exercices corrigés statistiques descriptives pdf
[PDF] exercices corrigés statistiques seconde bac pro
[PDF] exercices corrigés suites 1ere s pdf
[PDF] exercices corrigés suites numériques 1ère s pdf
[PDF] exercices corrigés suites terminale es pdf
[PDF] exercices corrigés sur l'entropie et le second principe
[PDF] exercices corrigés sur l'entropie pdf
[PDF] exercices corrigés sur la constitution des sociétés pdf
[PDF] exercices corrigés sur la gestion des approvisionnements et des stocks
[PDF] exercices corrigés sur la loi de student pdf
[PDF] exercices corrigés sur la nomenclature des complexes de coordination
[PDF] exercices corrigés sur la normalité et la molarité(pdf)
[PDF] exercices corrigés sur la ponctuation pdf
