 Activité expérimentale 2 détermination de constantes déquilibre par
Activité expérimentale 2 détermination de constantes déquilibre par
Sa valeur se trouve dans la littérature. Détermination du. pKA de l'acide éthanoïque par conductimétrie.
 Activité expérimentale détermination de constantes déquilibre par
Activité expérimentale détermination de constantes déquilibre par
Sa valeur se trouve dans la littérature. Détermination du. pKA de l'acide éthanoïque par conductimétrie.
 CHIM105B – DS1 – Corrigé
CHIM105B – DS1 – Corrigé
1) Détermination du pKa de l'acide fluorhydrique par conductimétrie. La conductivité de solutions d'acide fluorhydrique de diverses concentrations a été
 AH A AH.A ln10 dpH dn t + × = =
AH A AH.A ln10 dpH dn t + × = =
Ceci étant donné que le pKa de l'acide éthanoïque vaut 475. • Le pouvoir tampon est donné par : Détermination de la concentration des solutions :.
 D M 1 5 S A 1 DM15 • Mélange dacides et dosages
D M 1 5 S A 1 DM15 • Mélange dacides et dosages
3) Comment retrouver le pKa de l'acide éthano?que `a partir de la courbe de expérimentale permettant de réaliser ce dosage est la conductimétrie.
 DETERMINATION DUNE CONSTANTE DEQUILIBRE CHIMIQUE
DETERMINATION DUNE CONSTANTE DEQUILIBRE CHIMIQUE
CONDUCTIMETRIE. OBJECTIFS. ? Déterminer la constante d'équilibre de la réaction d'un acide avec l'eau conductimétrique) de surface S distantes de ?
 BAC2018 SR/SM BAC2018 SN/SM
BAC2018 SR/SM BAC2018 SN/SM
acide. • La détermination de la valeur du pKA du couple HCOOH(aq)/HCOO(aq) 2-Etude de la réaction du benzoate de sodium avec l'acide éthanoïque.
 Fiche de synthèse n°2 - Réactions acido-basiques en solution
Fiche de synthèse n°2 - Réactions acido-basiques en solution
Si pH = pKa [A?]f = [AH]f : les espèces acide et basique ont la même concentration en solution. -. Si pH <pKa
 Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
détermination de la concentration d'une espèce à l'aide d'un titrage direct (voir Extrait 8 À quel couple acide/base appartient l'ion hydroxyde HO– ?
 Titrages acido-basiques en TP dinvestigation
Titrages acido-basiques en TP dinvestigation
1) Titrage de l'acide maléique et détermination de pKa. Proposer une méthode permettant et d'acide éthanoïque à doser ; mélange d'acide phosphorique et.
 [PDF] Activité expérimentale 2 détermination de constantes déquilibre par
[PDF] Activité expérimentale 2 détermination de constantes déquilibre par
détermination de constantes d'équilibre par spectrophotométrie et conductimétrie Rappel : la constante d'acidité d'un couple acide-?base est la constante
 [PDF] Problème I- Acide éthanoïque (pH et conductimétrie) Enoncé - Free
[PDF] Problème I- Acide éthanoïque (pH et conductimétrie) Enoncé - Free
On dose par une solution d'hydroxyde de sodium (Na+ + OH-) de concentration Cb Le dosage est suivi par conductimétrie On trace la conductivité de la solution
 [PDF] TP Chimie - Maxime Champion
[PDF] TP Chimie - Maxime Champion
Après des dilutions mesurer la conductivité ? d'une solution d'acide éthanoïque pour des concen- trations c valant 10?1 mol/L 10?2 mol/L et 10?3 mol/L > À
 [PDF] BAC2018 SR/SM - Chimie Physique
[PDF] BAC2018 SR/SM - Chimie Physique
La détermination de la valeur du pKA du couple HCOOH(aq)/HCOO(aq) solution aqueuse (S) d'acide méthanoïque de concentration molaire C et de volume VS=1L
 [PDF] D M 1 5 S A 1 DM15 • Mélange dacides et dosages
[PDF] D M 1 5 S A 1 DM15 • Mélange dacides et dosages
3) Comment retrouver le pKa de l'acide éthano?que `a partir de la courbe de titrage ? 4) D'apr`es la courbe quelle est la valeur du pH au début du dosage?
 [PDF] Fiche 2 : équilibres acidobasiques - Studyrama
[PDF] Fiche 2 : équilibres acidobasiques - Studyrama
On souhaite déterminer la constante l'acidité du couple acide éthanoïque/ion éthanoate à l'aide d'une mesure conductimétrique On appelle constante de cellule k
 [PDF] Correction TP8 Ch13 Détermination dune constante dacidité KA
[PDF] Correction TP8 Ch13 Détermination dune constante dacidité KA
I DETERMINATION DE CONCENTRATIONS D'IONS PAR CONDUCTIMETRIE • Conductivité ? d'une solution aqueuse S d'acide méthanoïque HCO2H (aq) de concentration
 [PDF] TP de Chimie n°5 - Meck-anique
[PDF] TP de Chimie n°5 - Meck-anique
TP de Chimie n°5 Détermination conductimétrique d'une constante d'équilibre Terminale Objectifs: Mesurer la conductivité de solutions d'acide éthanoïque
 Chimie 6-DOSAGE_DUN_ACIDE_FAIBLE
Chimie 6-DOSAGE_DUN_ACIDE_FAIBLE
Une solution tampon renferme un acide faible et sa base conjuguée en concentrations égales ou voisines On sait que pH = pKa + log Si [ Base ] = [ Acide ]
 [PDF] TP 21 DOSAGE PAR TITRAGE - SIMULATION
[PDF] TP 21 DOSAGE PAR TITRAGE - SIMULATION
Déterminer le crit`ere permettant de choisir un indicateur coloré adapté au titrage de l'acide éthano?que B Titrage d'une solution de soude Le dosage d'une
Quel est le pKa de l'acide éthanoïque ?
FormuleC2H4O2 [Isomères] Masse molaire 60,052 ± 0,002 5 g/mol C 40 %, H 6,71 %, O 53,29 %, pKa 4,76 à 25 °C Moment dipolaire 1,70 ± 0,03 D Comment déterminer la valeur du pKa ?
Le pKa d'un couple acide base est défini par la relation suivante : pKa = - Log (Ka).Comment montrer que l'acide éthanoïque est un acide faible ?
Toutes les molécules CH3COOH de l'acide éthanoïque ne réagissent pas avec l'eau : on dit que l'acide éthanoïque est un acide faible. Par rapport à un acide fort, de même concentration, la solution d'acide éthanoïque est moins acide et présente donc un pH plus élevé.- On l'appelle point de demi-équivalence car il correspond à la situation dans laquelle la moitité de l'acide initialement présent a réagi avec HO- pour donner sa base conjuguée. On a alors égalité de concentration entre l'acide titré et sa base conjuguée, d'où pH=pKa .
DM15•SA1
DM15•M´elange d"acides et dosages
I Dosage pH-m´etrique
On veut r´ealiser le dosagepH-m´etrique d"un m´elange d"acide fort, l"acide chlorhydrique, de
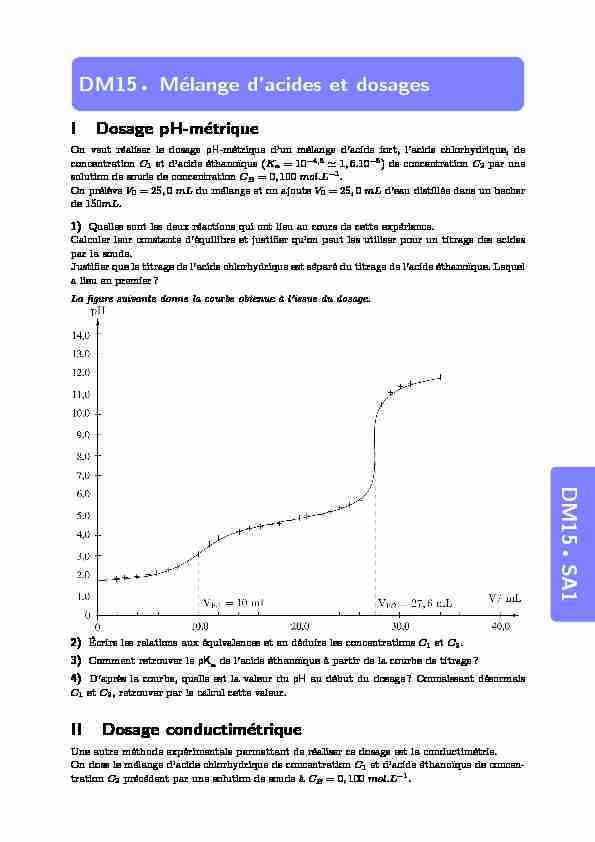
concentrationC1et d"acide ´ethano¨ıque (Ka= 10-4,8?1,6.10-5) de concentrationC2par une solution de soude de concentrationCB= 0,100mol.L-1. On pr´el`eveV0= 25,0mLdu m´elange et on ajouteV0= 25,0mLd"eau distill´ee dans un becher de 150mL.1)Quelles sont les deux r´eactions qui ont lieu au cours de cette exp´erience.
Calculer leur constante d"´equilibre et justifier qu"on peut les utiliser pour un titrage des acides
par la soude.Justifier que le titrage de l"acide chlorhydrique est s´epar´e du titrage de l"acide ´ethano¨ıque. Lequel
a lieu en premier? La figure suivante donne la courbe obtenue `a l"issue du dosage.2)´Ecrire les relations aux ´equivalences et en d´eduire les concentrationsC1etC2.
3)Comment retrouver lepKade l"acide ´ethano¨ıque `a partir de la courbe de titrage?
4)D"apr`es la courbe, quelle est la valeur dupHau d´ebut du dosage? Connaissant d´esormais
C1etC2, retrouver par le calcul cette valeur.
II Dosage conductim´etrique
Une autre m´ethode exp´erimentale permettant de r´ealiserce dosage est la conductim´etrie.
On dose le m´elange d"acide chlorhydrique de concentrationC1et d"acide ´ethano¨ıque de concen-
trationC2pr´ec´edent par une solution de soude `aCB= 0,100mol.L-1.DM15•SA1
Trois approches du dosage d"un m´elange acides [ENSTIM 10]2012-2013On pr´el`eveV0= 25,0 mL du m´elange et on ajouteV?0= 175,0 mL d"eau distill´ee dans un becher
de 250 mL. La conductivit´e de la solution en fonction du volume de titrant est repr´esent´ee sur
la courbe de la figure suivante :5)D´eterminer les volumes ´equivalentsVE1etVE2par cette m´ethode et en d´eduire les concen-
trationsC1etC2obtenues.6)En vous appuyant sur les conductivit´es ioniques molaires limites propos´ees, justifier le signe
et les variations des pentes des diff´erentes parties de la courbe de dosage.7)Quel est l"int´erˆet d"ajouter un volumeV?0important d"eau distill´ee pour r´ealiser ce dosage.
8)Quels avantages apporte la conductim´etrie par rapport `a la pH-m´etrie? (pr´ecision, nombre
de points de mesure, ...). On donne les conductivit´es ioniques molaires limites suivantes : ion H3O+HO-Cl-Na+CH3COO- λ◦(mS·m2·mol-1) 35,0 19,9 5,01 7,63 4,09III M´ethode de Gran
L"une des difficult´es pour obtenir avec pr´ecision les concentrations des acides est la d´etermination
pr´ecise des volumes ´equivalents. Le premier saut depHn"est pas tr`es important ici, le premier
volume ´equivalent est donc assez approximatif. Pour augmenter la pr´ecision du dosage on peut lin´eariser la courbe depHpar la m´ethode de Gran.9)Grˆace `a un tableau d"avancement de la premi`ere r´eactionde dosage avant l"´equivalence,
d´eterminer la concentration en ion H3O+pour un volume de soude ajout´e 0< V < VE1.
10)Montrer que si l"on trace (2V0+V)·10-pHen fonction deVon obtient une droite qui
coupe l"axe des abscisses au volume ´equivalent :V=VE1. Que repr´esente le coefficient directeur de cette droite?2http://atelierprepa.over-blog.com/Qadri J.-Ph.|PTSI
2012-2013
DM15•SA1
Trois approches du dosage d"un m´elange acides [ENSTIM 10]11)On a trac´e (2V0+V)·10-pH=f(V) sur la courbe suivante.
D´eterminer le volume ´equivalent et recalculer la concentrationC1obtenue.12)En utilisant un tableau d"avancement de la deuxi`eme r´eaction de dosage, d´eterminer pour
V E1< V < VE2la concentration en ion H3O+de la solution.13)On noteV?=V-VE1. Montrer que la courbeV?·10-pHen fonction deV?est une droite
qui coupe l"axe des abscisses enV?=VE2-VE1.14)Sur la figure 3, on a repr´esent´e 104·V?·10-pHen fonction deV?.
D´eterminerVE2et recalculer la valeur deC2correspondante.15)Quel est l"avantage de la m´ethode de Gran par rapport `a la m´ethode classique utilisant la
courbe du pH en fonction du volume de titrant?16)Peut-on d´eterminer leKade l"acide ´ethano¨ıque `a partir de la figure ci-dessus?
Si oui, pr´eciser la m´ethode et donner le r´esultat obtenu.Coh´erence du r´esultat? Qadri J.-Ph.|PTSIhttp://atelierprepa.over-blog.com/3DM15•SA1
Trois approches du dosage d"un m´elange acides [ENSTIM 10]2012-2013Solution
1)Pr´ealablement au titrage, l"acide chlorhydrique est un acide fort donc enti`erement dissoci´e :
on peut consid´erer qu"il s"agit d"ion oxonium `a la concentrationC1. NotonsAHla formule chimique de l"acide ´ethano¨ıque (CH3COOH). Les ´equations des r´eactions de titrage sont donc :1?H3O++HO---??--2H2O avec :K1=1
Ke= 1014>103
2?AH +HO---??--H2O +A-avec :K2=Ka
Ke= 1014-4,8= 109,2>103
Les valeurs des constantes d"´equilibre sont ´elev´ees :les r´eactions sont quantitativeset ont peu
les utiliser pour un titrage des acides par la soude. CommeK1>103.K2, la r´eaction1?aura lieu avant la r´eaction2?: on titre d"abord l"acide chlorhydrique puis l"acide ´ethano¨ıque.2)...Ce qui est mis en ´evidence parles deux sauts depH.
•`A la 1`ere´equivalence (V=VE1), les r´eactifs sont introduits dans les proportions stoechiom´etriques
de la r´eaction1?: n0(H3O+)
ν(H3O+)=n(HO-)´eq1ν(HO-)?C1.V0=CB.VE1?C1=CB.VE1V0= 0,040mol.L-1 •`A la 2nde´equivalence (V=VE2), les r´eactifs sont introduits dans les proportions stoe-chiom´etriques de la r´eaction2?, mais il faut tenir compte de la soude vers´ee `a la 1`ere´equivalence :
n 0(AH) ?C2=CB.(VE2-VE1)V0= 0,070mol.L-1
3)`A la seconde demi-´equivalence, seule la moiti´e de la souden´ecessaire pour neutraliser AH a
´et´e vers´ee, donc [AH] = [A
-] et pH=pKa+ log?[A-] [AH]? =pKa Rq :Le volume de soude vers´e vaut alors :V=VE1+VE2-VE12=VE2+VE12= 18,8mL
4)On litpH?1,7
Cette valeur ´etant sup´erieure `a 6,5, on peut n´egliger les ions H3O+issus de l"autoprotolyse de
l"eau. La pr´esence des ions H3O+est due `a la seule dissociation des acides indroduits en solution.
On remarque que cette valeur est inf´erieure `a pK a-1 = 3,8 : l"acide ´ethano¨ıque est donc tr`es majoritaire, il n"a quasiment pas ´et´e dissoci´e. Par cons´equent, lepHest seulement dˆu `a la dissociation totale de l"acide chlorhydrique qui est un acide fort :CH3COOHCH3COO-
4,83,82,81,7
pHsolpKapH [H3O+] =n(HCl)introduitsVtotal=C1.V02V0=C12= 0,020mol.L-1 ? -log[H3O+] =-log(2.10-2) =-log(2)-log(10-2)? -0,3 + 2 = 1,7Soit :pH?1,7
4http://atelierprepa.over-blog.com/Qadri J.-Ph.|PTSI
2012-2013
DM15•SA1
Trois approches du dosage d"un m´elange acides [ENSTIM 10]5)En dehors des zones proches des ´equivalences, les variations de la conductivit´e peuvent ˆetre
mod´elis´ees par des segments de droite, car la dilution de la solution dans le b´echer est n´egligeable
au cours du dosage (voir7)). Les points d"´equivalence sont situ´es aux intersections deux `a deux
des segments de droite trac´es.On obtient :VE1= 10,0mL
etVE2= 27,6mL Les expressions des concentrations ´etablies pr´ec´edemment sont toujours valables : C1=CB.VE1
V0= 0,040mol.L-1etC2=CB.(VE2-VE1)V0= 0,070mol0.L-16)•Avant la 1`ere´equivalence, la r´eaction1?se r´ealise, donc les ions H3O+pr´esents dans le b´echer
sont consomm´es avec les HO -de la soude vers´e. L"ajout de soude se traduit aussi par un ajout d"ions Na +qui ne sont pas consomm´es. Donc la variation de conductivit´e est proportionnelle `a la diff´erenceλ◦Na+-λ◦H3O+=-27,37mS.m2.mol-1<0•Entre la 1`ereet la 2nde´equivalence, la r´eaction2?se r´ealise, donc AH est consomm´e par HO-
pour former A -dont la concentration augmente dans le b´echer. L"ajout de soude se traduit aussi par un ajout d"ions Na +qui ne sont pas consomm´es. Donc la variation de conductivit´e est proportionnelle `a la sommeλ◦Na++λ◦A-= 11,72mS.m2.mol-1>0•Apr`es la 2nde´equivalence, la soude est ajout´ee en exc`es donc les concentrations en ions
Na +et HO-augmentent. Donc la variation de conductivit´e est proportionnelle `a la sommeNa++λ◦HO-= 27,53mS.m2.mol-1>0
Qualitativement, ces pr´evisions sont conformes aux mesures exp´erimentales.7)L"ajout d"un grand volume d"eauV?0dans le b´echer pr´ealablement au dosage permet de faire
en sorte que le volume de solution dans le b´echer ne varie quede fa¸con n´egligeable par ajout de
soude :Vtotal=V?0+V0+V?=V0+V?0carV0+V?0?V.Dans ce cas, la conductivit´e n"a pas besoin d"ˆetre corrig´ee de la dilution pour que la mod´elisation
par segments de droite soit possible.8)•Dans cet exemple, la conductim´etrie permet une grande pr´ecision pour le rep´erage des
deux ´equivalences, au contraire de lapH-m´etrie pour laquelle le premier saut depHn"est pas tr`es marqu´e.•De plus, la conductim´etrie, grˆace `a une mod´elisation par des segments de droite, n´ecessite un
petit nombre de points de mesure, au contraire de lapH-m´etrie, qui n´ecessite un resserrage des
points de mesure autour des ´equivalences pour avoir un jolitrac´e.9)Tableau d"avancement pour 0< V < VE1:
1?H3O++HO--→2H2OK1
tiC1V0CB.Vsolv. tfC1V0-CBV ?solv. ?[H3O+] =n(H3O+)restantsVtotalSoit : [H
3O+] =C1V0-CBV
2V0+V10)?f(V) = (2V0+V).[H3O+] =C1V0-CBV=b+a.V
•La fonctionf(V) est donc affine, ce qui se traduit graphiquement par une droite moyenne `a partir des points de mesure, dont le coefficient directeur est´egale `aa=-CB. •De plus, quandV=VE1, on af(VE1) =C1V0-CBVE1= 0 Cl :donc la droite moyenne coupe l"axe des abscisses quandV=VE1 , c"est-`a-dire `a la 1`ere´equivalence.
Qadri J.-Ph.|PTSIhttp://atelierprepa.over-blog.com/5DM15•SA1
Trois approches du dosage d"un m´elange acides [ENSTIM 10]2012-201311)On lit :VE1= 10,2mL?C1=CB.VE1V0= 0,0408mol.L-1
12)Avant la 2nde´equivalence, HO-est le r´eactif limitant de la r´eaction2?que l"on consid`ere
quantitative. Soit le tableau d"avancement, en tenant compte de la quantit´e de HO-introduite pour la 1`ere´equivalence :
2?AH +HO--→A-+ H2OK2
tiC2V0CB.(V-VE1) 0solv. tfC2V0-CB(V-VE1)? CB(V-VE1)solv. Comme :Ka=[A-][H3O+][AH]=n(A-)[H3O+]n(AH)=CB(V-VE1)C2V0-CB(V-VE1).[H3O+]On en d´eduit : [H
3O+] =C2V0-CB(V-VE1)
CB(V-VE1).Ka
13)AvecV?=V-VE1, la relation devient :
[H3O+] =C2V0-CB.V?
CB.V?.Ka?g(V?) =V?.[H3O+] =KaCB.(C2V0-CB.V?) =b?+a?.V •La fonctiong(V?) est donc affine, ce qui se traduit graphiquement par une droite moyenne `a partir des points de mesure, dont le coefficient directeur est´egale `aa?=-Ka. •De plus, quandV?=VE2-VE1, on ag(VE2-VE1) =KaCB(C2V0-CB(VE2-VE1)) = 0
Cl :donc la droite moyenne coupe l"axe des abscisses quandV=VE2 , c"est-`a-dire `a la 2nde´equivalence.
14)On lit, `a la 2nde´equivalence :V?= 17,7mL
?VE2= 27,9mL ?C2=CB.(VE2-VE1)V0=CB.V?V0= 0,0708mol.L-115)Pour la m´ethode de Gran, verser la solution titrante avant (et jusqu"`a) l"´equivalence suffit
`a d´eterminer pr´ecis´ement le point d"´equivalence.La m´ethode classique n´ecessite de relever aussi lepHapr`es l"´equivalence pour d´eterminer pr´ecis´ement
la position du point d"inflexion.16)Sur la figure, l"ordonn´ee `a l"origine est ´egale `ab?=Ka.C2V0
CB...mais elle n"est pas lisible
sur le graphe. En revanche, la pente de la droite moyenne est ´egale `aa?=-Ka! Graphiquement, avec deux points relev´es sur la droite moyenne pour calculer l"oppos´e de la pente : |a?|=Ka=????1,5.10-4-010-17,7????
= 1,9.10-5?Ka?1,9.10-5= 10-4,7 →La valeur obtenue est conforme `a celle donn´ee dans l"´enonc´e.6http://atelierprepa.over-blog.com/Qadri J.-Ph.|PTSI
quotesdbs_dbs29.pdfusesText_35[PDF] déterminer pka expérimentalement
[PDF] inhibiteur compétitif ki
[PDF] calcul ki inhibition compétitive
[PDF] calculer ki
[PDF] enzymologie cours pdf
[PDF] inhibiteur compétitif exemple
[PDF] comment calculer la latitude et la longitude sur une carte
[PDF] comment calculer la latitude d'un lieu
[PDF] qu'est ce que la latitude et la longitude
[PDF] comprendre les latitudes et longitudes
[PDF] calcul latitude longitude distance
[PDF] calculer latitude et longitude d'une ville
[PDF] mesure longitude
[PDF] calculer le volume de dioxygène nécessaire ? la combustion
