 Exercices sur les combustions et les combustibles
Exercices sur les combustions et les combustibles
2° question : a) Écrire l'équation-bilan de la combustion complète du butane. b) Calculer le volume. 2. O. V de dioxygène nécessaire à la combustion
 INTERROGATION N°2 SUR CME4 (SUR 5) CORRECTION
INTERROGATION N°2 SUR CME4 (SUR 5) CORRECTION
dioxygène nécessaire pour brûler tout le gaz de la bouteille en supposant que la réaction de combustion est complète. a) Calculer la masse molaire du
 BTS MAVA chimie 2003
BTS MAVA chimie 2003
b) Calculer le volume de dioxygène nécessaire à la combustion complète de tout le gas-oil. En déduire le volume d'air correspondant. c) Quel est le volume de
 EXERCICE N°1 : 1) Equilibrer les équations suivantes. (combustion
EXERCICE N°1 : 1) Equilibrer les équations suivantes. (combustion
(combustion d'alcanes dans le dioxygène de l'air on obtient du dioxyde de Calculer le volume de dioxygène nécessaire à la combustion complète de ...
 4ch3c.pdf
4ch3c.pdf
Si Ia quantité de dioxygène est insuffisante la combustion est .. ..........jncomplèJe. ... ir Calcule le volume de butane nécessaire si le profes-.
 Thème 1 : Confort dans lhabitat
Thème 1 : Confort dans lhabitat
un combustible un comburant et une énergie d'activation. Par application de poudres sur un feu
 érie dexercices N°3
érie dexercices N°3
c) Calculer dans les CNTP le volume de dioxygène nécessaire à la combustion. Exercice 3 : L'oxyde de cuivre réagit avec le carbone selon l'équation :.
 ????? ?????: ????? ?????????? ? ??????
????? ?????: ????? ?????????? ? ??????
2- Calculer la masse molaire des oxydes de fer et d'aluminium. 2- Calculer le volume de dioxygène nécessaire à la combustion de 1 kg d'acétylène.
 Exercice N°1 : Exercice N°2 : Exercice N°3 : Exercice N°4 : Exercice
Exercice N°1 : Exercice N°2 : Exercice N°3 : Exercice N°4 : Exercice
Déterminer le volume de dioxygène nécessaire à la combustion de 255 g d'ammoniac. ? Calculer la masse d'eau obtenue après combustion complète de l'ammoniac
 Exercices dapplication sur le chapitre « Diagramme dOstwald »
Exercices dapplication sur le chapitre « Diagramme dOstwald »
2° question : Déterminer le volume d'air nécessaire à la combustion dans les Pour calculer ce volume il faut d'abord calculer la quantité de dioxygène ...
 [PDF] COMBUSTION
[PDF] COMBUSTION
La combustion peut être définie comme la réaction chimique qui a lieu lors de Avec : VO2 = Volume d'oxygène nécessaire Calculer son facteur d'air
 [PDF] Exercices sur les combustions et les combustibles - Nicole Cortial
[PDF] Exercices sur les combustions et les combustibles - Nicole Cortial
2° question : Calculer le volume de dioxygène nécessaire à la combustion complète d'une mole de ce gaz ? En déduire le volume d'air « stœchiométrique » 3°
 [PDF] Combustion-EMSEpdf
[PDF] Combustion-EMSEpdf
PC = quantité de chaleur dégagée par la combustion complète d'une unité de combustible (kg ou mol) les éléments nécessaires à la combustion et les produits de
 [PDF] 4ch3cpdf
[PDF] 4ch3cpdf
ir Calcule le volume de butane nécessaire si le profes- seur utilise un volume oe 5 75 L de dioxygène va= vots s = !;7] : oat e oF os olr
 [PDF] Les combustions
[PDF] Les combustions
Le dioxygène de l'air est en excès dans le cas d'une cheminée aussi l'énergie produite lors de la combustion est plus importante si plusieurs bûches ont brûlé
 combustion - Chimix
combustion - Chimix
La chaudière fonctionne 1 heure calculer : la quantité de matière de méthane (moles); la masse et le volume de dioxygène nécessaire; le volume d'air
 [PDF] I Combustion - E-learning
[PDF] I Combustion - E-learning
quantité d'énergie dégagée par unité de masse (respectivement de volume) du Commençons par calculer la masse de dioxygène nécessaire à la combustion d'
 [PDF] Une réaction chimique : la combustion du méthane - AC Nancy Metz
[PDF] Une réaction chimique : la combustion du méthane - AC Nancy Metz
Pour que le gaz méthane brûle il faut que des molécules de dioxygène et des molécules de méthane soient mélangées Sous l'effet de la chaleur (qui est un
 Volume dair necessaire pour une combustion - Forum FS Generation
Volume dair necessaire pour une combustion - Forum FS Generation
Bonjour J'ai l'exercice suivant à faire mais impossible de trouver le raisonnement Pourriez vous me donnez une piste?
 [PDF] Matière et matériaux Combustions Exercice 1 : Bois de chauffage
[PDF] Matière et matériaux Combustions Exercice 1 : Bois de chauffage
combustion le volume molaire est VM = 240 L/mol (une mole de gaz occupe un volume contenue dans le ballon calculer la durée nécessaire ?t pour porter
Comment calculer le volume de dioxygène nécessaire à la combustion ?
Le volume de dioxygène consommé (VO2) se calcule comme la différence entre le volume de O2 inspiré (VO2insp) et le volume de O2 expiré (VO2exp). Le volume de O2 est le volume d'air multiplié par la concentration en dioxygène dans cet air.Quel est le volume de dioxygène nécessaire à la combustion de 2 5 kg de charbon de bois ?
conclusion : pour 2125 grammes de Carbone, il faut donc 21250 Litres d' air ( = 21,25 m3 ), soit 4250 Litres de dioxygène ( = 4,25 m3 ) .Comment calculer la combustion ?
L'énergie libérée lors d'une combustion dépend de la quantité de combustible. Pour la calculer, il faut donc multiplier l'énergie molaire de réaction (pour 1 mole) par la quantité de matière du combustible.
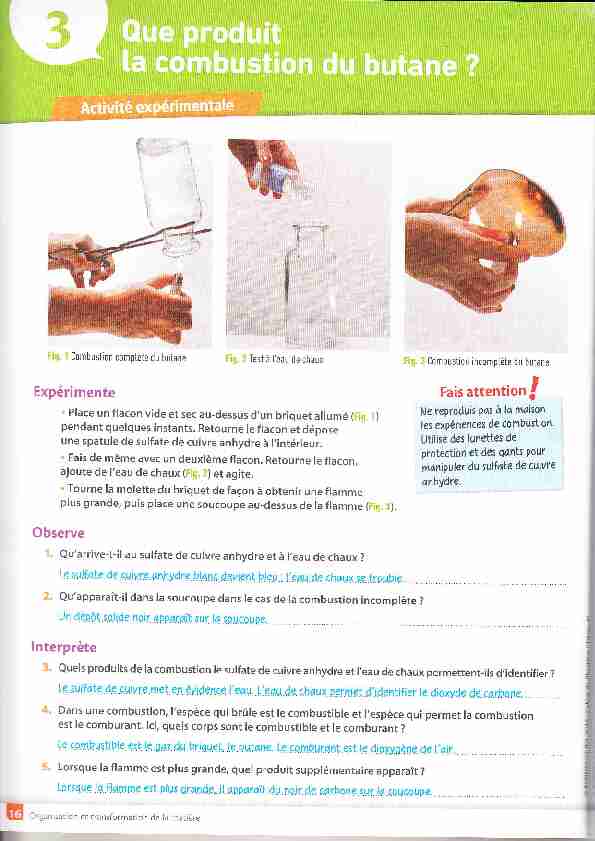 Combustion complète du bulaneTest à teau de chaux
Combustion complète du bulaneTest à teau de chaux Expérimente
Pla Fais de même avec un deuxième flacon. Retourne le flacon,ajoute de l'eau de chaux ( ) et agite. Tourne lâ molette du briquet de façon à obtenir une flammeplus grande, puis place une sou(oupe au-dessus de lâ flamme ( ). Quels produitsde la combustion re surfate de cuivrê anhydre et |eau de chaux permettent-irs d,identifier ? Le sqlf4le dÉ cuiÿlre me\ 9r'.êvideûçq r'e..u. i. e,,iu de q.h4ux pe!'met d'ièçt1\)î)et le àiaxy4.e ie cqrbaîe. Dans une !e ç9mbqslipie çsl le gq1àubriqget. te bula\e. i,? cofihurqnt €§t te di))tysëlte 4ç j,qv -:'! dlune.-comDustio.n.incomptète..i{.s€ fo.rme dç..1'.eau".du diaxyàe 4e.e4!:honç..m4is oussi.du çqrhone. consommés; il se forme du ...djo.xy.de.de.c4rb0le .. .. .. et de .. ..... ....!:e4u...... . . Le bilan de la combustion s'écrit: butane + . ..dioxySène.................. ) .........dtoryde.dc cqrbone......... ) Si Ia quantité de dioxygène est insuffisante, la combustion est ..... ..........jncomplèJe.............. .. Du .. €4f.b.of e.... ............ .. est obtenu et parfois un gaz très toxique, le monoryde de ) Le butane et le dioxygène sont les réactifs de Ia transformation chimique ; le dioxyde de carbone et l'eauObserve
Qu'arrive-t-il au sulfate de cuivre anhydre et à I,eau de chaux ? '.q \uilate àe ahÿ\e 6î hydrq 9iqnc devient ble!, ,I'eÇ\q. eq Ch4l1)\ ,e irouble_ Qu'apparaît-il dans la soucoupe dâns Ie ca5 de la combustion incomplète ? Ur déilôt ra|dE f.alr" app.irdît sqi iq soucc|t.ç lnterprète Cornbuslon incomplàle du butane
Fais attention !
Ne reproduis Pas à ld maison
les expériences de combu§tion. Utilise des lunettes de
proteciion et des qants Pour manipuler du sulf4te de cuiÿr€ onhydre. G':..,., "" ",,,,,,,forn,êr oi.ieta ri:,rèreI § Légende
Complète le schéma ci dessous avec les mots : edu de chqux; eau ; cotburant ; dioxy'de de carbone. -),1... eau .àe. chaux Trouble:
droryde .de.cqr.hone. lri.,L: rrM,. i:i! . iJ, wwû,bordarrêqâud vêntô.fr Rédige ta conclusion
-:'5 dlune.Çomhustio.n.comBlèJe..les produits sont de lle6u.et du dioxyde àe cqtbone. I ........... e4ÿ... .. .. .. .. .. .. .
Co.he la ou les réponse(s) correcte(s).
a. Lors de la combustion du butane, les réactifs sont: Complète le texte avec les mots suivants : /rsuffisorte; réoctifs ; combustible ; incamplète ; prcduits ; comburont ; intoxication. a. Au cours de la combustion du butane,le butane est le comoqJtiule. . et le dioxygène est ie comburgnt... . b, Le risque des combustions est l' irttoxic4lion. .. au monoxyde de carbone. (. Si la quantité de dioxygène est !4suffis4nte. .. ., la combustion est incomplète . .. . ,1, L'eau etle dioxyde de carbone sont les p..rnduit§. . de la transformation chimique entre le butane et le dioxygène. Ces derniers sont les !:é4ctifs ffi netie Dans le cas de la combustion du butane, associe
.haque mot de la colonne de gauche à un mot de la colonne de droite. p Fais le bon choix /Y le butane le dioxvde de carbone l'eâu X le dioxygène
b" Lors de la.ômbustion complète du butane, les produits formés sont: X le dioxyde de carbone ,X l'eâu
le butane le dioxyqène (, Dans un flacon rempli de dioxyde de carbone, le butane brûle:vivement X ne brûle pas très lentement en projetantdes étincelles dioxygène dioxyde dê cârbone l;l:;,' Un tystam" as (hauffage 0{PEpoermèlwohàs Ol Ot OS OIB
Un briquet contient du butane
liquide surmonté de gaz butane sous pression. En appuyant sur le bouton,le butane s'é.happe. En tournant la molette, uneétin
celle est créée et le gaz butane peut alors s'enflammer. Victor actionne un briquet. ll
met sa main à une dizaine de centimètres au dessus de la flamme. ll place ensuite un tube à essais sec au-dessus de la flamme.
ll verse de l'eau de chaux dans ce tube après avoir recueilli les produits de la combustion. L'eau de chaux se trouble. ,: Que constate Victor en plaçant sa main âu-dessus de la flamme ? 14 ÇomFustion .du.!ut4-e.éee\se delq ehaleur
r: Quelest le produit misenévidence parleiestà l,eau de chàux ? l.e \es| à.1' equ.d.e. chs!,tx.nto-ntre 14 fornation le dloxy.de. Ae cqrbone. . Un second produit obtenu est mis en évidence par le test au sulfatede cuivre anhydre. euelestce second produit ? Le lesJ cq sulf4te de e qiu(.e.4r1.hydrp.nanlrP
la lotr(.tqljstt 4.: e-4!).. r:l Complète le modèle suivant du bilan de lâ combus- tion. hut4ne.,. diaxysèse.-" diof,yle.d9..çqrbone-.r.eq!) Ti.i Des combustions différentes
02l,liliserdèsrutihdelciièmntd0donnles Ot OF Os Oln
Un professeur de physique-chimie réalise des combus- tions complètes du gaz butane avec quatre groupes d'élèves. ll fournit à chaque groupe des volumes ini- iiàux différents de butàne et de dioxygène. Ces volumes sont rassemblés dans le tableau suivant : volule vBd:lutane (Ll , ot]o , otr9,, otlo qr9 l de dioxygène (L) o'o5 1 95 3-25 r'5\ ,; 6.5 6.5 6.5 6.5yB,, ir. Calcule le) quorienls h da ns le tableau. Deduis envP 'une relation numérique entre yo et yB. -Le volÿt\e.de.bu\qnç.e: le.yolurne de dioxysèle . ... . sont p(opollannel§.;..Y4.= 6,5./8. ir Calcule le volume de butane nécessaire si le profes- seur utilise un volume oe 5.75 L de dioxygène. .va=..vots.s.=.!;7] .: .o,at e.. oF os olr E "u,Inisàrlon er transformarion de la ma!ière illllliiill Barbe.ue aans Ie garage - danger ! ûaïErdesmùrlusiois Ol
Lors d'un barbe-
cue, Axel utilise deux brûleurs à gaz butane, reliés à une bouteille de
gaz de 13 kg. La pluie arrivè... ll décide de poursuivre la cuisson à l'intérieur de son garage, ce quiest très dangereux. Le garage est une pièce hermétique contenant 80 m3 d'air. i), Écris le bilan de la combustion complète du butane. hut4ne..r .dioxysène.- ) éioxyde 4e cqrïone t eqv h, Son barbecue consomme650 g de butane par heure. Pendant combien de temps Axel pourraii-il utiliser son barbecue dans sonjardin ?,3ooo:zoot 650
Axel pourrait ut.lrser son barbeçue
pet'danf 2A,0 heures._ r, La combustion des650 g de butane nécessiteenvi- ron 1,6 m3 de dioxygène. Au bout de combien de temps la combustion s'arrêtera-t elle dans le garage ? 1ap4ns le qdrage. il y a 80 - 20 fi1 ée dioxygène
L4 çsmbustion.(o,nspmr)p 1.6 ï\: 49 digxygèîe p4't h, ..4 =r,n16 Ar bout de:li.h,ll ne resler4.plur dq.diaxysèxe dqns le sqr.qge .1.4 combustion s'drrêtera. liilll Quels volumes de produits ? 02 Uülis*des lulilsd âcqlisilion dè dlines Ol OF OS OTB
Samia réalise plusieurs fois I'expérience de la combus- tion complète du butane. Elle mesure lesvolumes d'eau et de dioxydede cêrbone produits et place ses résultats sur un graphique: N volume de dioxyde de carbone (L) 0 ne peuvent pas être utilisés dans les mêmes conditions. Sandra achète une bou-
teille de propàne et une de butane. Elle.hoisit de stoc- ker ses bouteilles dehors. Sandra a-t-elle raison de plaRédige ta réponse argumentée.0123
Quels sont les réactifs et les produits de cette conrbustion ? .es réd(t.is lort ,e butar,e el e do'.ÿqène i.e.s produil§ sort.l€ drcxyde..de Çd.rrone -eJ.lle..ali.. .. .. Si Samia obtient un volume d'un litre de dioxyde de carbone, quel volume d'eau s'attend-elle à irouver ? Butane
rfur (.c) - 138 188
rvae fc) 0 42
Dqr leclqr-e ar4phiq)e, §4mia pourr4 obtelir . . .. L utiiis4lion dlulre Doutelll€ de.o4r.nècessite de fair.c .. sort i.ce[r.i .eide 14 bouteille, §i l4 temptrqture est lîlé"Êute b 0 oC en h,ÿer, le bùlane Ae se ÿapot sera pds l.e but4ne dolt don(.Ctr.e.s!o(ké à.!lirrtérieur.. .. . . 19 ,Dropafe peut ?trs stsEke à.llextéJieur eqr: il..§É. . .. .
v4pon§e14 du:de§§us dÈ., .42.?ç..l4'ndrs 4 àonc.lar|. .. Pav' e hv\lîa
Deux sour(es d'énergie
03 5 tumldéH (éieqie de hçn esrmsbl! Ol OF Os OTB
Sur la photographie de gauche, le gaz alimentanl le brûieur est du méthane. Sur la photographie de droite, le gaz alimentânt le brûleur est du butâne. Explique pourqLroi Ia flamme n'ô pâs le même aspect sur les deux photographies. La.ombustionde 1.0 mrde méthane nécessite 10 rnr d'air et lâ combustion de 1,0 m3 de butane nécessite 32,5 rnr d'âir. p.4rs le !4J du brû.!.eu!i.ou .ryréth4ne, 14 fl4.mm9.-eJt bLeu€ ç4r.1 .ç0m.PqsJipn est.!o.mplète, Dsn! l€.c4s.. . .. du.Pri\)?ur ^a bu\qrc,lq tlqn.\te esl i\une.ç^r . lq.çor"ibustion est.irrçomp!ète. Il n:! 4.p4s 4ssez dl4ir dan§ la plèee. qn.-ejfet,..dlsârèJ le§.d.onnéej,ll faut .. . b€4ucoup.plus.d.l4i!:.pourhrûler. un..mètre cuPe de. .. . butqne 4ue pouL Erûler un mètre cube-.de .méth4l1le. )n vclufie à'eau d'enyiron 1.2 L El Une histoire de proportion
0( l4etE sr ewE des démarches pr0prcs iux$i!n@s Ol Ot OS OiE
I\4arc a lu que pourfaire brûler complètement 58 g de gaz butâne, il faut 208 g de dioxygène. Calcule la masse de dioxygène nécessaire pour réaliser la com- bustion complète de I7 q de butane. -4 m4sse de dioxyqène ré(€Js4rr€ çst de.-6j s, . . .. .. Iüârc a aussi lu que la combustion de 58 g de gaz butane produisait 96 L de dioxyde de carbone. Calcule e volume de dioxyde de carbone obtenu en faisant brûler complètement 25 g de butane. valuïte àe èiaxÿdQ. ae E4tP.çle.able-rq -e.s\. àe 41 L. t Solution p.128 À l'intérieur ou à l'extérieur ?
ll litenrtler d6 rélulhh er!Édneilau O Ol OS Om Les bouteilles vendues dans les magasin5 sont rem
plies de butane (bouteille dorée) ou de propane (bou teille rouqe), à l'état liquide. Le butane et Ie propâne ae f'lasse d€ butane (g) üalle de dioxy!ène (en q)
*,1csse de butare (q)quotesdbs_dbs29.pdfusesText_35
[PDF] calcul de flottabilité d'un bateau
[PDF] exemple programme hp prime
[PDF] tutoriel hp prime
[PDF] exercice lecture graphique de limites
[PDF] langage de programmation hp prime
[PDF] produire une expression littérale 5eme
[PDF] exemple calcul littéral 5ème
[PDF] calcul littéral reduire une expression
[PDF] brevet maths
[PDF] calcul littéral 3ème developper
[PDF] cours calcul littéral 3ème
[PDF] exercice math 4eme calcul littéral pdf
[PDF] exercice corrige expression litterale
[PDF] partie littérale définition math
