 chimie générale réactions acide – base. solution tampon
chimie générale réactions acide – base. solution tampon
3.4 Pourquoi la solution est acide à l'équivalence. IV. Solutions tampons. 1. Composition d'une solution tampon. Au cours de la réaction entre un acide faible
 Une solution tampon est constituée par le mélange dun acide faible
Une solution tampon est constituée par le mélange dun acide faible
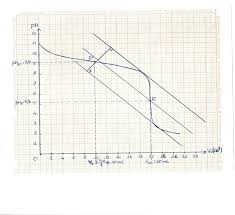
Conclusion : Le pH de la solution tampon ne varie pas par dilution. III-Limites de l'effet tampon : Si on continue de verser l'acide fort ou la base forte à
 Solutions tampons
Solutions tampons
Définition : Une solution tampon est une solution dont la composition est telle que son pH varie peu soit par addition de petites quantités d'acide ou de base
 MAEC et SIE : une solution en bordure de cours deau ?
MAEC et SIE : une solution en bordure de cours deau ?
25 janv. 2016 Zones tampons vis-à-vis des produits phytopharmaceutiques. Page 14. • Bordure d'une eau de surface : Zone tampon minimale de 6 mètres.
 Solution Tampon
Solution Tampon
Solution Tampon. • Ajout de base ou d'acide et dilution: impacts sur le PH. Page 2. Dosages. Page 3. Dosages (II). Page 4. Acide + Base. Page 5. Récapitulatif
 Fiche de Données de Sécurité: Solution tampon
Fiche de Données de Sécurité: Solution tampon
Solution tampon pH 1000 ±0
 Fiche de Données de Sécurité: Solution tampon pH 688 ±0
Fiche de Données de Sécurité: Solution tampon pH 688 ±0
https://www.carlroth.com/medias/SDB-T185-CH-FR.pdf?context=bWFzdGVyfHNlY3VyaXR5RGF0YXNoZWV0c3wyNDg0MjR8YXBwbGljYXRpb24vcGRmfHNlY3VyaXR5RGF0YXNoZWV0cy9oZTAvaGIyLzkwNTU0Mjk2NTY2MDYucGRmfDk5ZWY2ZGE4NDg4ZDVhYmUyYjQ2MWM4ZjZkODQ2N2Q0NGU2YzdjNTIxODQxN2UyNDJjOGE2NTVlYTc4OWZlZjc
 La chimie
La chimie
Les solutions tampons. • une solution tampon est une solution constituée. • d'un acide faible ou d'une base faible. • d'un sel de cet acide ou de cette base.
 Solutions tampons
Solutions tampons
(tampon à la dilution). Ainsi les solutions d'acide fort ou de base forte ne constituent pas de bonnes solutions tampons car si ce sont des tampons
 COURS DE CHIMIE GENERALE Semestre 1 SVI
COURS DE CHIMIE GENERALE Semestre 1 SVI
Solutions tampon. 3.1. Définition de la ST. 3.2. Propriété de la ST. 3.3. Préparation de la ST. 3.4. Calcul du pH de ST. 4. Titrages acide-base.
 Transformations chimiques en solution aqueuse
Transformations chimiques en solution aqueuse
Cours de chimie de seconde période de PCSI PSI UNE SOLUTION TAMPON EST UNE SOLUTION DONT LE PH VARIE PEU PAR UN APPORT MODERE D'ACIDE OU.
 Chapitre 1 Acides et bases
Chapitre 1 Acides et bases
Le pH (“potentiel hydrogène”) d'une solution défini par Søren Sørensen en 1909
 Chimie Chapitre 1 Terminale S
Chimie Chapitre 1 Terminale S
Pour les solutions aqueuses diluées le pH est égal à l'opposé du Une solution tampon est une solution dont le pH varie peu lorsqu'on y ajoute une ...
 reactions-acido-basiques.pdf
reactions-acido-basiques.pdf
TS – PHYSIQUE-CHIMIE – REACTIONS ACIDO-BASIQUES – COURS. 3. Echelle de p.H. Solution acide. p.H < 7. H3O+ > HO?. Solution neutre. p.H = 7. H3O+ = HO?.
 Solution Tampon
Solution Tampon
Solution Tampon. • Ajout de base ou d'acide et dilution: impacts sur le PH. Page 2. Dosages. Page 3. Dosages (II). Page 4. Acide + Base. Page 5
 Les Acides Aminés
Les Acides Aminés
Une solution tampon est une solution dont le pH varie peu soit pas addition d'acide soit par addition de base ou par dilution dans de l'eau. Le pouvoir tampn
 Solutions tampon Nancy
Solutions tampon Nancy
Une solution tampon est souvent un mélange d'acide faible et de sa base conjuguée Mobiliser les connaissances acquises au cours de l'activité 1 pour.
 [PDF] Solutions tampons
[PDF] Solutions tampons
Définition : Une solution tampon est une solution dont la composition est telle que son pH varie peu soit par addition de petites quantités d'acide ou de base
 [PDF] Les solutions tampons - La chimie
[PDF] Les solutions tampons - La chimie
Les solutions tampons • une solution tampon est une solution constituée • d'un acide faible ou d'une base faible • d'un sel de cet acide ou de cette base
 [PDF] Solutions tampon Nancy
[PDF] Solutions tampon Nancy
Une solution tampon peut être constituée d'un mélange d'acide faible et de sa base conjuguée Elle a un pH qui ne varie pas par ajout limité d'acide ou de base
 [PDF] Equilibre acidobasique
[PDF] Equilibre acidobasique
instantanés » automatiques : systèmes tampons Produit ionique de l'eau (toute solution aqueuse) : Appliquée au système tampon « bicarbonates /
 [PDF] Solution Tampon
[PDF] Solution Tampon
Solution Tampon • Ajout de base ou d'acide et dilution: impacts sur le PH Page 2 Dosages Page 3 Dosages (II) Page 4 Acide + Base Page 5
 [PDF] grenoble_première_CBSV_thème 1_Solutions tampon
[PDF] grenoble_première_CBSV_thème 1_Solutions tampon
L'objectif de cette activité est de préparer une solution tampon de pH donné et de montrer l'effet tampon Mots clés de recherche : tampon solution tampon
 [PDF] SOLUTIONS TAMPONS
[PDF] SOLUTIONS TAMPONS
SOLUTIONS TAMPONS 1) Définition Une solution tampon est une solution dont le pH varie peu par addition modérée d'un acide d'une base ou d'eau
 [PDF] Étude de solutions tampons (Manipulation de TCE ou TD)
[PDF] Étude de solutions tampons (Manipulation de TCE ou TD)
Nous allons ici étudier les variations de pH d'une solution tampon lors d'un ajout d'acide fort ou de base forte 2 ÉTUDE EXPÉRIMENTALE 2 1 Préparation des
 62 – Solutions tampons – La Chimie Générale pour les Gee-Gees
62 – Solutions tampons – La Chimie Générale pour les Gee-Gees
6 2 – Solutions tampons · 1 Un bon mélange tampon doit avoir des concentrations à peu près égales de ses deux composants · 2 Une solution tampon a généralement
 [PDF] Filière Sciences de la Matière Chimie Cours Chimie des Solutions
[PDF] Filière Sciences de la Matière Chimie Cours Chimie des Solutions
Solutions tampon 3 1 Définition de la ST 3 2 Propriété de la ST 3 3 Préparation de la ST 3 4 Calcul du pH de ST 4 Titrages acide-base
Quel est le principe d'une solution tampon ?
Une solution tampon est un mélange d'acide faible et de sa base conjuguée ou d'une base faible et de son acide conjugué. On utilise des solutions tampons pour maintenir stable la valeur du pH d'une autre solution mélangée avec le tampon.Comment préparer une solution tampon PDF ?
Dissoudre les solides dans environ 100 mL d'eau distillée. Agiter. Quand tout est dissous, ajuster au trait de jauge avec de l'eau distillée; homogénéiser. Cette solution constitue la solution tampon.Quel est le rôle du tampon ?
Définition de tampon ??? nom masculin. Petite masse dure ou d'une matière souple pressée, qui sert à boucher un trou, à emp?her l'écoulement d'un liquide.- Préparation d'une solution tampon
Lorsque l'on est en présence d'un mélange équimolaire [A-] = [AH] , la relation pH = pKa + log[A-]/[AH] devient pH = pKa. La solution tampon a donc un pH égal au pKa du couple acide base mis en jeu. En chimie des solutions, elles sont notamment utilisées pour étalonner le pH-mètre.
L-basique et
Les solutions tampons
une solution tampon est une solution constituée une solution tampon a la capacité de maintenir son pH presque dans un organisme vivant, les solutions tampons jouent un rôle critique ex.; le pH du sang reste plus ou moins constant grâce à un système tamponLes solutions tampons
on utilise donc un couple acide-base conjuguéeCH3COOH et du CH3
se font très peu, i.e., les réactifs restent intacts dans une solution tampon, ces hydrolyses deviennent même moins importantes, car selon le principe de le Chatelier: le CH3COO-3COOH(aq) le CH33COO-(aq) (l)OH COOH(aq)CHO(l)H(aq)COOCH (aq)OH (aq)COOCHO(l)H COOH(aq)CH 3233323
om om
Les solutions tampons
une solution tampon comme notre système CH3COO-/CH3COOH est capable de garder le pH plus ou moins constant car, lors de +(aq) ou OH-(aq), les réactions suivantes se produisent i.e., le CH3COO-neutralise les H+(aq) et le CH3COOH neutralise les OH-(aq) donc le pH de la solution tampon ne change pas le pouvoir tampon est la capacité de la solution tampon àO(l)H (aq)COOCH(aq)OH COOH(aq)CH
COOH(aq)CH (aq)H(aq)COOCH
23333
o o
Les solutions tampons
Exemple: Lesquelles des solutions suivantes sont des systèmes tampons? (a) KF/HF, (b) KCl/HCl, (c) Na2CO3/NaHCO3Solution:
(a) HF est un acide faible, et F-est sa base conjuguée, donc (b) HCl est un acide fort, donc sa base conjuguée, Cl-, ne peut (c) CO32-est une base faible, et HCO3-est son acide conjugué,Les solutions tampons
Exemple: Calculez le pH du système tampon suivant: NH3à 0.30 M/NH4NaOH à dans 80.0 mL de la solution tampon?
Solution:
9.17pH 106.7][H
(0.30) )(0.36)10(5.6 ][NH ][NHK][H ][NH ]][NH[HK105.6K (aq)NH(aq)H (aq)NH
10 10 3 4a 4 3 a 10 a34 ?u u ? u omLes solutions tampons
la solution tampon: on ajoute (0.020 L)(0.050 mol/L) = 0.0010 mol de OH- on avait (0.080 L)(0.30 mol/L) = 0.0240 mol de NH3 on avait (0.080 L)(0.36 mol/L) = 0.0288 mol de NH4+ le OH-4+et produire le NH39.21pH 106.2][NH
][NHK][HM 0.278L 0.100
mol 0.0010)(0.0288][NHM 0.250L 0.100
mol 0.0010)(0.0240][NHO(l)H (aq)NH(aq)NH (aq)OH
10 3 4a 4 3 234?u o
Les solutions tampons
quantité de OH- [OH-] = (0.0010 mol)/(0.100 L) = 0.01 M si [OH-] = 0.01 M, [H+] = 1.0 x 10-12M, donc le pH = 12.00 dans la solution tampon, on va de pH = 9.17 à pH = 9.21 une solution tampon est très efficace pour maintenir le pH constant -Hasselbach on introduit le pKa= -log Ka -Hasselbach ][A [HA]loglogK]log[H ][A [HA]Klog]log[H ][A [HA]K][H [HA] ]][A[HK a a a a [HA] ][AlogpKpHa -Hasselbach N.B. une solution tampon est surtout efficace lorsque [HA] [A-] ou lorsque un système tampon est donc surtout efficace lorsque pH pKa aapK[HA] ][AlogpKpH0.0log(1.0)[HA]
][Alog CH3COOH et 0.47 M en NaCH3COO. On ajoute 0.10 mol de HCl à cetteCH3COOH est 1.8 x 10-5.
3COOH. On
3COOH est 1.8 x 10-5.
Le titrage acide fort-base forte
ex.; où des quantités équimolaires cas, pH= 7.00)O(l)H (aq)H (aq)OH
ouO(l)HNaCl(aq)
HCl(aq) NaOH(aq)
2 2 o oLe titrage acide faible-base forte
ex.; -a neutralisé tout le CH3COOH tout le CH3COOH est converti en CH3COO- parce que le CH3COO-(aq) est une base un pH supérieur à 7O(l)H (aq)COOCH
(aq)OH COOH(aq)CH ouO(l)H COONa(aq)CH
NaOH(aq) COOH(aq)CH
233 23
3 o o
Le titrage acide fort-base faible
ex.; +a neutralisé tout le NH3 tout le NH3est converti en NH4+ parce que le NH4+est un acide faible, pH inférieur à 7 (aq)NH (aq)NH (aq)H ouCl(aq)NH (aq)NH HCl(aq)
4343
o o
Les indicateurs acido-basiques
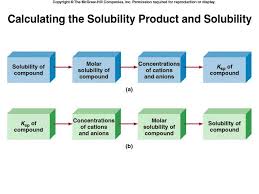
-base est souvent indiqué par un indicateur est habituellement un acide ou une base organique faible où la forme acide et la forme basique ont des couleurs différentes dans un milieu acide, la solution prend la couleur de la forme dans un milieu basique, la solution prend la couleur de la forme le zone de virage (zone de pH où la couleur change) correspond au pKa pour un titrage donné, on veut choisir un indicateur où la zone de 4(s) solubilité, Ks (aq)SO (aq)Ba (s)BaSO2 4 2 4 om ]][[)1( ]][[2 4 2 2 4 2 4 242SOBaSOBa
a aaK BaSO SOBa ]][SO[BaK2 4 2 sLe produit de solubilité
molaires des ions qui le constituent, chacune de ces concentrations N.B. plus la valeur de Ksest petite, moins le composé est soluble dans 234 32
s 3 4 2 243
2 3 2 s 2 332
22
s 2 2 ][PO][CaK (aq)PO 2 (aq)Ca 3(s))(POCa ][CO][AgK (aq)CO (aq)Ag 2 (s)COAg ]][F[MgK (aq)F 2 (aq)Mg(s)MgF eg.; om om om
La solubilité molaire et la solubilité
Ksest une mesure de solubilité
il est souvent difficile de comparer la solubilité de deux composés à partir des Kssest différente si la stoechiométrie de la dissociation est différente (i.e., un nombre différent de cations/anions sont produits) la solubilité molaire est le nombre de moles de soluté par litre de solution saturée la solubilité est le nombre de grammes de soluté par litre de solution saturéeLa solubilité molaire et la solubilité
La solubilité molaire et la solubilité
Exemple: La solubilité molaire du fluorure de baryum (BaF2) est de 7.5 x 10-3M. Quel est le produit de solubilité de ce composé? Solution: Si la concentration de BaF2est 7.5 x 10-3M et BaF2se dissocie en solution aqueusequotesdbs_dbs22.pdfusesText_28[PDF] (pib) au prix du marché
[PDF] pib réel et pib nominal formule
[PDF] calculer le taux d'inflation
[PDF] toutes les formules de macroéconomie
[PDF] toutes les formules de macroéconomie pdf
[PDF] déflateur du pib formule
[PDF] macroéconomie pour les nuls pdf
[PDF] calculer ka
[PDF] pka acide fort
[PDF] pka base faible
[PDF] poids santé weight watchers
[PDF] poids ideal pour femme
[PDF] calcul poids idéal homme
[PDF] poids santé femme 50 ans