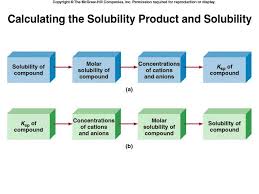
 Les solutions tampons
Les solutions tampons
solution tampon ne change pas appréciablement lorsqu'on ajoute des acides et des bases. • le pouvoir tampon est la capacité de la solution tampon à.
 chimie générale réactions acide – base. solution tampon
chimie générale réactions acide – base. solution tampon
3.4 Pourquoi la solution est acide à l'équivalence. IV. Solutions tampons. 1. Composition d'une solution tampon. Au cours de la réaction entre un acide faible
 Une solution tampon est constituée par le mélange dun acide faible
Une solution tampon est constituée par le mélange dun acide faible
Conclusion : Le pH de la solution tampon ne varie pas par dilution. III-Limites de l'effet tampon : Si on continue de verser l'acide fort ou la base forte à
 Solutions tampons
Solutions tampons
Définition : Une solution tampon est une solution dont la composition est telle que son pH varie peu soit par addition de petites quantités d'acide ou de base
 MAEC et SIE : une solution en bordure de cours deau ?
MAEC et SIE : une solution en bordure de cours deau ?
25 janv. 2016 Zones tampons vis-à-vis des produits phytopharmaceutiques. Page 14. • Bordure d'une eau de surface : Zone tampon minimale de 6 mètres.
 Solution Tampon
Solution Tampon
Solution Tampon. • Ajout de base ou d'acide et dilution: impacts sur le PH. Page 2. Dosages. Page 3. Dosages (II). Page 4. Acide + Base. Page 5. Récapitulatif
 Fiche de Données de Sécurité: Solution tampon
Fiche de Données de Sécurité: Solution tampon
Solution tampon pH 1000 ±0
 Fiche de Données de Sécurité: Solution tampon pH 688 ±0
Fiche de Données de Sécurité: Solution tampon pH 688 ±0
https://www.carlroth.com/medias/SDB-T185-CH-FR.pdf?context=bWFzdGVyfHNlY3VyaXR5RGF0YXNoZWV0c3wyNDg0MjR8YXBwbGljYXRpb24vcGRmfHNlY3VyaXR5RGF0YXNoZWV0cy9oZTAvaGIyLzkwNTU0Mjk2NTY2MDYucGRmfDk5ZWY2ZGE4NDg4ZDVhYmUyYjQ2MWM4ZjZkODQ2N2Q0NGU2YzdjNTIxODQxN2UyNDJjOGE2NTVlYTc4OWZlZjc
 La chimie
La chimie
Les solutions tampons. • une solution tampon est une solution constituée. • d'un acide faible ou d'une base faible. • d'un sel de cet acide ou de cette base.
 Solutions tampons
Solutions tampons
(tampon à la dilution). Ainsi les solutions d'acide fort ou de base forte ne constituent pas de bonnes solutions tampons car si ce sont des tampons
 COURS DE CHIMIE GENERALE Semestre 1 SVI
COURS DE CHIMIE GENERALE Semestre 1 SVI
Solutions tampon. 3.1. Définition de la ST. 3.2. Propriété de la ST. 3.3. Préparation de la ST. 3.4. Calcul du pH de ST. 4. Titrages acide-base.
 Transformations chimiques en solution aqueuse
Transformations chimiques en solution aqueuse
Cours de chimie de seconde période de PCSI PSI UNE SOLUTION TAMPON EST UNE SOLUTION DONT LE PH VARIE PEU PAR UN APPORT MODERE D'ACIDE OU.
 Chapitre 1 Acides et bases
Chapitre 1 Acides et bases
Le pH (“potentiel hydrogène”) d'une solution défini par Søren Sørensen en 1909
 Chimie Chapitre 1 Terminale S
Chimie Chapitre 1 Terminale S
Pour les solutions aqueuses diluées le pH est égal à l'opposé du Une solution tampon est une solution dont le pH varie peu lorsqu'on y ajoute une ...
 reactions-acido-basiques.pdf
reactions-acido-basiques.pdf
TS – PHYSIQUE-CHIMIE – REACTIONS ACIDO-BASIQUES – COURS. 3. Echelle de p.H. Solution acide. p.H < 7. H3O+ > HO?. Solution neutre. p.H = 7. H3O+ = HO?.
 Solution Tampon
Solution Tampon
Solution Tampon. • Ajout de base ou d'acide et dilution: impacts sur le PH. Page 2. Dosages. Page 3. Dosages (II). Page 4. Acide + Base. Page 5
 Les Acides Aminés
Les Acides Aminés
Une solution tampon est une solution dont le pH varie peu soit pas addition d'acide soit par addition de base ou par dilution dans de l'eau. Le pouvoir tampn
 Solutions tampon Nancy
Solutions tampon Nancy
Une solution tampon est souvent un mélange d'acide faible et de sa base conjuguée Mobiliser les connaissances acquises au cours de l'activité 1 pour.
 [PDF] Solutions tampons
[PDF] Solutions tampons
Définition : Une solution tampon est une solution dont la composition est telle que son pH varie peu soit par addition de petites quantités d'acide ou de base
 [PDF] Les solutions tampons - La chimie
[PDF] Les solutions tampons - La chimie
Les solutions tampons • une solution tampon est une solution constituée • d'un acide faible ou d'une base faible • d'un sel de cet acide ou de cette base
 [PDF] Solutions tampon Nancy
[PDF] Solutions tampon Nancy
Une solution tampon peut être constituée d'un mélange d'acide faible et de sa base conjuguée Elle a un pH qui ne varie pas par ajout limité d'acide ou de base
 [PDF] Equilibre acidobasique
[PDF] Equilibre acidobasique
instantanés » automatiques : systèmes tampons Produit ionique de l'eau (toute solution aqueuse) : Appliquée au système tampon « bicarbonates /
 [PDF] Solution Tampon
[PDF] Solution Tampon
Solution Tampon • Ajout de base ou d'acide et dilution: impacts sur le PH Page 2 Dosages Page 3 Dosages (II) Page 4 Acide + Base Page 5
 [PDF] grenoble_première_CBSV_thème 1_Solutions tampon
[PDF] grenoble_première_CBSV_thème 1_Solutions tampon
L'objectif de cette activité est de préparer une solution tampon de pH donné et de montrer l'effet tampon Mots clés de recherche : tampon solution tampon
 [PDF] SOLUTIONS TAMPONS
[PDF] SOLUTIONS TAMPONS
SOLUTIONS TAMPONS 1) Définition Une solution tampon est une solution dont le pH varie peu par addition modérée d'un acide d'une base ou d'eau
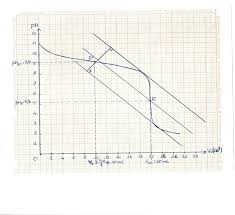
 [PDF] Étude de solutions tampons (Manipulation de TCE ou TD)
[PDF] Étude de solutions tampons (Manipulation de TCE ou TD)
Nous allons ici étudier les variations de pH d'une solution tampon lors d'un ajout d'acide fort ou de base forte 2 ÉTUDE EXPÉRIMENTALE 2 1 Préparation des
 62 – Solutions tampons – La Chimie Générale pour les Gee-Gees
62 – Solutions tampons – La Chimie Générale pour les Gee-Gees
6 2 – Solutions tampons · 1 Un bon mélange tampon doit avoir des concentrations à peu près égales de ses deux composants · 2 Une solution tampon a généralement
 [PDF] Filière Sciences de la Matière Chimie Cours Chimie des Solutions
[PDF] Filière Sciences de la Matière Chimie Cours Chimie des Solutions
Solutions tampon 3 1 Définition de la ST 3 2 Propriété de la ST 3 3 Préparation de la ST 3 4 Calcul du pH de ST 4 Titrages acide-base
Quel est le principe d'une solution tampon ?
Une solution tampon est un mélange d'acide faible et de sa base conjuguée ou d'une base faible et de son acide conjugué. On utilise des solutions tampons pour maintenir stable la valeur du pH d'une autre solution mélangée avec le tampon.Comment préparer une solution tampon PDF ?
Dissoudre les solides dans environ 100 mL d'eau distillée. Agiter. Quand tout est dissous, ajuster au trait de jauge avec de l'eau distillée; homogénéiser. Cette solution constitue la solution tampon.Quel est le rôle du tampon ?
Définition de tampon ??? nom masculin. Petite masse dure ou d'une matière souple pressée, qui sert à boucher un trou, à emp?her l'écoulement d'un liquide.- Préparation d'une solution tampon
Lorsque l'on est en présence d'un mélange équimolaire [A-] = [AH] , la relation pH = pKa + log[A-]/[AH] devient pH = pKa. La solution tampon a donc un pH égal au pKa du couple acide base mis en jeu. En chimie des solutions, elles sont notamment utilisées pour étalonner le pH-mètre.
 COMPRENDRE Page 1 sur 10 Réaction chimique par échange de proton
COMPRENDRE Page 1 sur 10 Réaction chimique par échange de proton Chimie, Chapitre 1 Terminale S
REACTIONS ACIDO-BASIQUES
I NOTION DE REACTIONS ACIDO-BASIQUES
1) Acides, bases et couples acide / base
Quand un acide AH a libéré un proton, il donne naissance à une base A-. Quand une base B a capté un proton, elle donne naissance à un acide BH+. - forment un couple acide/base noté AH/A- (ou BH+/B). On dit que AH et A- (ou BH+ et B) sont des espèces conjuguées. demi-équation acido-basique :
Exemples : = + acide éthanoïque ion éthanoate proton ion ammonium ammoniac proton2) La réaction acido-basique et son équation
Une réaction acido-basique fait intervenir un acide A1H et une base A2- appartenant à deuxcouples acide/base différents A1H/A1- et A2H/A2-. Elle est caractérisée par un transfert de
proton 1H et la base A2-.II - LE pH ET SA MESURE
1) Définition du pH
Pour les solutions aqueuses diluées, le pHnombre réel sans dimension égal à la concentration en ion oxonium H3O+ exprimée en mol.L-1 :
Remarques :
9 (1868- potentiel hydrogène ».9 Les grandeurs pH et H3O+ varient en sens inverse :
3O+] est multiplié par 10 ;
3O+] est divisé par 10 ;
9A 25°C : une solution de pH = 7 est neutre
une solution de pH < 7 est acide une solution de pH > 7 est basique. [H3O+] (mol.L-1) pH 210-8 10-6 10-4 10-2
8 6 4Chimie Chapitre 1 : Réactions acido-basiques
COMPRENDRE Page 2 sur 10 Réaction chimique par échange de proton2) Mesure du pH
a) $ O·MLGH G·XQ LQGLŃMPHXU ŃRORUp QMPXUH GH OM VROXPLRQ de situer le pH de cette solution dans une échelle de valeurs. Ex : en versant quelques gouttes de BBT dans une solution aqueuse, on sait que son pH est : - inférieur à 6,0 si la couleur de la solution est jaune - supérieur à 7,6 si la couleur de la solution est bleue - compris entre 6,0 et 7,6 si la couleur de la solution est verte b) $ O·MLGH G·XQ SMSLHU S+ pYMOXMPLRQ GX S+ bandelette de papier pH (papier prépa geant de couleurs pour c) $ O·MLGH G·XQ S+-mètre, mesure et précision de la valeur trouvée¾ Description du pH-mètre
Un pH-
séparées. La tension U qui apparaît aux bornes de la sonde plongée dans une solution est une fonction affine du
pH = A B.pH Il est donc nécessaire le pH-mètre avant toute mesure.¾ Etalonnage du pH-mètre
pH connu .¾ Mesure du pH
distillée, puis plongée dans la solution étudiée. Après agitation et stabilisation de la mesure, la valeur du pH est relevée.¾ Incertitude des mesures de pH
ouvent donnée avec un chiffre après la virgule.Exemple :
Le pH du jus de citron est de 2,1.
¾ Incertitude sur la valeur de la concentration en ions oxoniumLa concentration en ions oxonium obtenue par la relation [H3O+] = 10-pH sera donnée avec au plus deux chiffres
significatifs lorsque le pH est donné avec un chiffre significatif après la virgule. Cette règle reste valable si le
pH est supérieur à 10 et donné avec trois chiffres significatifs.Exemples :
[H3O+] (en mol.L-1) 1,0.10-3 2,0.10-3 1,0.10-4 1,0.10-5 1,0.10-12 pHChimie Chapitre 1 : Réactions acido-basiques
COMPRENDRE Page 3 sur 10 Réaction chimique par échange de protonIII TRANSFORMATIONS TOTALES ET LIMITEES
totales.Remarque :
Quand on ne sait pas a priori si une transformation est totale ou limitée, on utilise le signe ֖
la réaction.IV FORCE DES ACIDES ET DES BASES
1) Mise en évidence expérimentale
a) Expérience9 -2 mol.L-1 : pHAC 2,0
9 concentration : pHAE 3,0
Les deux solutions possèdent un volume V = 1L
b) InterprétationAcide chlorhydrique :
État Avancement (mol) Quantités de matière (mol)Initial
Final9 Qinitiale :
9 Qonium présents dans la solution :
9 Quantité :
9 Conclusion :
Chimie Chapitre 1 : Réactions acido-basiques
COMPRENDRE Page 4 sur 10 Réaction chimique par échange de protonAcide éthanoïque :
État Avancement (mol) Quantités de matière (mol)Initial
Final9 Qinitiale
9 Qonium présents dans la solution :
9 :9 Conclusion :
2) Acides forts, bases fortes
a) DéfinitionsExemples :
La soude NaOH est une base forte : ܪܱܽܰ b) IH S+ G·XQH VROXPLRQ G·MŃLGH IRUP de concentration notée cÉtat Avancement
(mol)Quantités de matière
(mol)Initial 0 n =c.V Excès 0 0
Final xf 0 excès xf xf
9 :9 La concentration en ions oxonium est :
9 :Chimie Chapitre 1 : Réactions acido-basiques
COMPRENDRE Page 5 sur 10 Réaction chimique par échange de proton c) IH S+ G·XQH VROXPLRQ GH NMVH IRUPH9 de concentration
notée c :État Avancement
(mol)Quantités de matière
(mol)Initial 0 n = c.V Excès 0 0
Final xf 0 excès xf xf
9 :9 La concentration en ions hydroxyde est :
9 : solution de base forte de concentration molaire c peut alors être défini par : d) Réaction entre un acide fort et une base forte ¾ Quelle réaction entre un acide fort et une base forte ? contient de nombreuses espèces chimiques : Couple 1 : acide fort A1H / base très faible A1-(aq) A1H est totalement consommé, A1-(aq) est une base très faible donc elle ne peut pas réagir.3O+ est susceptible de réagir.
Couple 2 : acide très faible B2H+(aq) / base forte B2 B2 est totalement consommée, B2H+(aq) est un acide très faible donc il ne peut pas réagir. -(aq) est susceptible de réagir.¾ Aspect thermique de la réaction
précaution.¾ Règles de sécurité
99 Puisque la réaction entre un acide fort et une base forte est exothermique, préparer un tel mélange nécessite
9 Il ne faut ja
versées, provoquant une élévation rapide et importante de la température de cette eau et donc sa
vaporisation. Les vapeurs brûleraient alors tout ce qui serait à son contact.Chimie Chapitre 1 : Réactions acido-basiques
COMPRENDRE Page 6 sur 10 Réaction chimique par échange de proton3) Acide faible, base faible
a) Définition 9 concentration initiale en acide.9 Un acide faible a pour base conjuguée une base faible.
9 Une base B est qualifiée de faible
concentration initiale en base.Exemple :
[H3O+] = 10-pH = 10-7 mol.L-1. re, ne peuvent provenir que des molécules d'eau l existe donc, au sein dela solution, un échange de protons entre des molécules d'eau des deux couples H3O+(aq)/H2O(l) et H2O(l)/HO-(aq).
b) FRQVPMQPH G·MŃLGLPp G·XQ ŃRXSOH MŃLGR-basiqueRemarque :
A.Exemple :
le couple NH4+(aq) / NH3(aq)Exemples particuliers :
Cette constante appelée notée Ke au lieu de KA est associée à pKe = 14 un ampholyte, ou caractère amphotère.Chimie Chapitre 1 : Réactions acido-basiques
COMPRENDRE Page 7 sur 10 Réaction chimique par échange de proton c FRQVPUXŃPLRQ GH O·pŃOHOOH GH S+9 Une solution aqueuse est neutre si les quantités d'ions oxonium et hydroxyde sont égales :
9 Une solution aqueuse est acide si la quantité d'ions oxonium est supérieure à celle d'ions hydroxyde :
[H3O+] > [HO-]9 Une solution aqueuse est basique si la quantité d'ions oxonium est inférieure à celle d'ions hydroxyde
[H3O+]éq > [HO-]éq [HO-]éq < 1,0.10-7 mol.L-1 [H3O+]éq > 1,0.10-7 mol.L-1 [H 3O +] = [HO = 1,0.10 -7 mol.L -1 [H3O+]éq < [HO-]éq [H3O+]éq < 1,0.10-7 mol.L-1 [HO-]éq > 1,0.10-7 mol.L-1 pHSolutions basiques Solutions acides
14 7,0 0
pH < ½ . pKe [H3O+] > [HO- pH > ½ . pKeSolutions
neutresChimie Chapitre 1 : Réactions acido-basiques
COMPRENDRE Page 8 sur 10 Réaction chimique par échange de proton pKA 14Bases Acides
0HO- H2O
H2O H3O+
Force croissante
Force croissante
de la base pH au quotidienSubstance
Acide chlorhydrique
Batterie acide
Acide gastrique
Jus de citron
Coca cola
bière café théPluie acide
laitEau pure
Salive humaine
sangEau de mer
savon ammoniaqueHydroxyde de
sodium pH approximatif 0 <1,0 2,0 2,4 2,5 3,5 4,5 5,0 5,5 5,6 6,5 7,0 6,5 -7,4 7,3 -7,5 8,0 9,0 -10,0 11,5 14,0 d) FRQVPUXŃPLRQ GH O·pchelle des pKA GMQV O·HMXRemarque :
Les valeu
des pKA sont celles des pKA des e) Relation entre pH et pKA A :Chimie Chapitre 1 : Réactions acido-basiques
COMPRENDRE Page 9 sur 10 Réaction chimique par échange de proton f) Domaines de prédominance pour un couple acido-basique quelconqueUne espèce est prédominante devant une autre espèce si sa concentration dans la solution est supérieure à celle
de cette autre espèce.9 La forme acide A prédomine sur la forme basique B si [A]éq > [B]éq
9 La forme basique B prédomine sur la forme acide A si [B]éq > [A]éq
9 éq = [A]éq
9 Tracé du diagramme de prédominance :
V APPLICATION A QUELQUES FAMILLES DE COUPLES ACIDO-BASIQUESFAIBLES
Un acide-aminé possède au moins deux groupes caractéristiques présentant des propriétés acido-
basiques : un groupe carboxyle COOH et amine NH2 selon la formule générale suivante: -aminé, étudions celui des espèces chimiques possédant un seul de ces deux groupes.1) Acide carboxylique
Les acides carboxyliques sont en général des acides faibles. Leur base faible conjuguée, appelées ion
Le pKA du couple acide carboxylique/ion carboxylate est en général compris entre 2 et 5 Le diagramme de prédominance du couple R-CO2H /Exemples :
Acide carboxyliqueAcide méthanoïque
H-CO2H
Acide éthanoïque
CH3-CO2H
Acide benzoïque
C6H5-CO2H
Acide lactique
CH3-CH(OH)-CO2H
pKA 3,8 4,8 4,2 3,90 7,0 pKA1 14 pKA
R COOH R COO-(aq)
pHDomaine de prédominance
de la forme acide A [A]éq > [B]éq pKADomaine de prédominance
de la forme basique B [B]éq > [A]éq pH = pKA [A]éq = [B]éq CCOOH NH2 R HChimie Chapitre 1 : Réactions acido-basiques
COMPRENDRE Page 10 sur 10 Réaction chimique par échange de proton CCOOH NH2 R H2) Amine
-NH2 est appelé ion ammonium 2Fଷ>. Le couple ion ammonium/amine est
en général un couple acide faible/ base faible dont le pKA est compris entre 9 et 10.Le diagramme de prédominance du couple 2
Fଷ>ȀR-NH2 est :
Exemples :
Amine Méthylamine CH3-NH2 Diméthylamine (CH3)NH Triméthylamine (CH3)3N pKa 10,6 10,8 9,83) Acide -aminés
Les acides aminés ont pour formule générale : Les propriétés acido--aminé sont dues au groupe :9 carboxylique : couple R-CO2H / 4
9 amino :couple 2
Fଷ>ȀR-NH2 avec un pKa2 proche de 10
Les acides -aminés possédant deux groupes caractéristiques avec deux pKa différents, le diagramme de
prédominance possède 3 zones différentes :Remarque : La forme générale !
VI IMPORTANCE DU CONTROLE DU pH
1) Solution tampon
Une solution tampon est une solution dont le pH varie peuconjuguée A- à des concentrations voisines. Le couple acide/base est choisi de telle sorte que son pKa soit
éq éq AABpKpHlog
2) Rôle des milieux biologiques
9 Dans un corps humain sain, le pH du sang est maintenu dans une plage très étroite atour de 7,4. Cette
régulation est assurée par la présence de plusieurs couples acido-basiques, dissous dans le plasma sanguin,
qui exercent un effet tampon : citons, en particulier, le couple (CO2, H2O) / ࡴ{? dont le pKa vaut 6,3 à
37° C.
9maximale à un pH voisin de 8, proche de celui du milieu intestinal, alors que celle de la pepsine est
0 7,0 pKA2 14 pKA
CCOOH NH3 R H pKA1 CCOO- NH3 R H CCOO- NH2 R H0 7,0 pKA2 14 pKA
R NH3+(aq) R NH2
CCOOH NH2 R Hquotesdbs_dbs28.pdfusesText_34[PDF] (pib) au prix du marché
[PDF] pib réel et pib nominal formule
[PDF] calculer le taux d'inflation
[PDF] toutes les formules de macroéconomie
[PDF] toutes les formules de macroéconomie pdf
[PDF] déflateur du pib formule
[PDF] macroéconomie pour les nuls pdf
[PDF] calculer ka
[PDF] pka acide fort
[PDF] pka base faible
[PDF] poids santé weight watchers
[PDF] poids ideal pour femme
[PDF] calcul poids idéal homme
[PDF] poids santé femme 50 ans
