 EPREUVE DEXERCICES DAPPLICATION
EPREUVE DEXERCICES DAPPLICATION
D'après la Loi de Beer Lambert : ε.1.C. A = :ε coefficient d'absorption spécifique. 1 : trajet optique = 1 cm. C : concentration de la solution mesurée : g.L-1.
 EXERCICE RÉSOLU 2 - Suivi dune réaction par spectrophotométrie
EXERCICE RÉSOLU 2 - Suivi dune réaction par spectrophotométrie
La loi de Beer‐Lambert permet de déterminer le coefficient d'absorption molaire qui dépend de la longueur d'onde et de l'espèce colorée. Raisonner. La réaction
 Corrigé DS no 3 : Chimie : Dosage - Physique : Interactions
Corrigé DS no 3 : Chimie : Dosage - Physique : Interactions
14 déc. 2019 (b) La loi de Beer-Lambert est-elle vérifiée? La courbe obtenue est ... Exercice 3- De le Terre à la Lune (8 points). Dans l'un de ses ...
 Exercices du chapitre 2 : Dosage spectrophotométrique
Exercices du chapitre 2 : Dosage spectrophotométrique
1 oct. 2019 L'absorbance de cette solution est = 0140. 1- Définir la loi de Beer-Lambert. En déduire la valeur du coefficient de proportionnalité et ...
 Untitled
Untitled
Exercices. Exercices d'application. 5 minutes chrono ! 1. Mots manquants a D'après la loi de Beer-Lambert: Amax = E^lc donc Em. Sur le graphique
 exercices Loi de Beer Lambert (révison contrôle commun
exercices Loi de Beer Lambert (révison contrôle commun
Correction exercices : Loi de Beer Lambert (révision contrôle commun). Exercice 1: 1. D'après le spectre d'absorption KMnO4 absorbe les radiations autour
 Exercice III : Contrôles de la qualité dun lait (5 points)
Exercice III : Contrôles de la qualité dun lait (5 points)
Montrer en utilisant le document 2 et en complétant l'ANNEXE À RENDRE AVEC LA COPIE
 Une solution colorée (8 points) Exercice n°2 : Teinture pour
Une solution colorée (8 points) Exercice n°2 : Teinture pour
4) La loi de Lambert-‐Beer est elle vérifiée ? Justifier. 5) 0n mesure maintenant l'absorbance de la solution de teinture pour bois on obtient A = 1
 exercices Loi de Beer Lambert (révison contrôle commun)
exercices Loi de Beer Lambert (révison contrôle commun)
Exercices: Loi de Beer-Lambert. Exercice 1: Document 1 : Matériel disponible: - Solution étalon de permanganate de potassium. KMnO4 à 00500 mol/L
 Spécialité Physique-Chimie
Spécialité Physique-Chimie
EXERCICES NON A SOUMETTRE. Donnée : Cercle chromatique. Exercice 6 : Utiliser la représentation topologique Exercice 7 : Loi de Beer-Lambert. Le diiode I2 (aq) ...
 EPREUVE DEXERCICES DAPPLICATION
EPREUVE DEXERCICES DAPPLICATION
D'après la Loi de Beer Lambert : ?.1.C. A = :? coefficient d'absorption spécifique. 1 : trajet optique = 1 cm. C : concentration de la solution mesurée
 EXERCICE RÉSOLU 2
EXERCICE RÉSOLU 2
La loi de Beer Lambert est additive. Une solution. 1. On repère le maximum d'absorption sur le spectre de Cu2+ (courbe
 Exercice III : Contrôles de la qualité dun lait (5 points)
Exercice III : Contrôles de la qualité dun lait (5 points)
(175) Lorsque la loi de Beer-Lambert est vérifiée
 Corrigé DS no 3 : Chimie : Dosage - Physique : Interactions
Corrigé DS no 3 : Chimie : Dosage - Physique : Interactions
14 déc. 2019 (b) La loi de Beer-Lambert est-elle vérifiée? La courbe obtenue est une droite ... Exercice 2 - Dosage par titrage colorimétrique (4 points).
 Exercices du chapitre 2 : Dosage spectrophotométrique
Exercices du chapitre 2 : Dosage spectrophotométrique
1 oct. 2019 Exercices du chapitre 2 : Dosage spectrophotométrique. Exercice n°1. L'absorbance d'une solution S de ... 1- Définir la loi de Beer-Lambert.
 Corrigé type de lExamen « Méthodes modernes danalyses et de
Corrigé type de lExamen « Méthodes modernes danalyses et de
Exercice 1 : (4 pts) Donner l'expression de la loi de Beer Lambert ? ... La loi de Beer-Lambert est vérifiée car le graphe A = f (C) est une droite ...
 1 Méthodes danalyse et de dosage en Biologie : Module Solution
1 Méthodes danalyse et de dosage en Biologie : Module Solution
Solution de Série d'exercices N°1 : Spectrophotométrie UV-visible. Exercice N°1 : Selon la loi de Beer Lambert : A = ?.l.C. Sachant que : A : Absorbance.
 exercices Loi de Beer Lambert (révison contrôle commun
exercices Loi de Beer Lambert (révison contrôle commun
Correction exercices : Loi de Beer Lambert (révision contrôle commun). Exercice 1: 1. D'après le spectre d'absorption KMnO4 absorbe les radiations autour
 Exercices sur les matières colorées
Exercices sur les matières colorées
Donc A est proportionnelle à c c'est la loi de Beer Lambert : A = k × c. 3. Mesure de la concentration de la solution de dichromate de potassium :.
 Techniques danalyses biologiques Travaux dirigés avec corrigés
Techniques danalyses biologiques Travaux dirigés avec corrigés
Exercice 06 : 1) On applique la loi de Beer Lambert : Sel A. 510 nm. 575 nm ? (mol-1.l.cm-1) 476. 0

Dosage par étalonnage
4 Extraits de sujets corrigés du bac S
© http://labolycee.org
Notions et contenus Compétences exigibles
Contrôle de la qualité par
dosageDosages par étalonnage :
- spectrophotométrie ; loi deBeer-Lambert ;
- conductimétrie ; explication qualitative de la loi deKohlrausch, par analogie
avec la loi de Beer-Lambert. caractériser une espèce colorée. Pratiquer une démarche expérimentale pour déterminer la concentration d'une espèce à l'aide de courbes d'étalonnage en utilisant la spectrophotométrie et la conductimétrie, dans le domaine de la santé, de l'environnement ou du contrôle de la qualité. Résumé en vidéo (9 min) http://acver.fr/4xp Ces corrigés sont accessibles gratuitement et sans inscription sur http://labolycee.org Contacts : https://twitter.com/Labolycee ; https://www.facebook.com/labolycee/ ; labolycee@labolycee.org2005/11 Nouvelle Calédonie EXERCICE II. DEUX ANTISEPTIQUES (6,5 points)
Le Lugol est un antiseptique couramment utilisé. Les indications portées sur un flacon de solution
commerciale sont données dans le tableau ci-dessous.Lugol (solution S0)
Composition : iodine solution (eau iodée)
n pour déterminer le titre de la solution S0 de Lugol.On dispose de six solutions aqueuses de diiode de concentrations molaires apportées différentes. La
e avec un spectrophotomètre UVvisible = 500 nm.0 = 0 à
Amax = 2,00.
Parmi les espèces chimiques présentes le diiode est la seule espèce qui absorbe à 500 nm. Les ré-
AVEC LA COPIE.
1.1. par une relation de la forme A = k[I2].1.2. On note [I2]max la concentration molaire apportée en diiode au-
Déterminer graphiquement la valeur de [I2]max en faisant clairement apparaître la méthode utilisée sur
la Figure 1 deACCÈS À LA CORRECTION
2. Titre du Lugol
Pour déterminer le titre en diiode du Lugol, il est ici nécessaire de diluer dix fois la solution commer-
ciale S0. La solution obtenue est notée S0 Le matériel mis à disposition est le suivant : - bechers 50 mL, 100 mL, 250 mL ; - pipettes jaugées 5,0 mL, 10,0 mL, 20,0 mL ; - éprouvettes graduées 10 mL, 20 mL, 100 mL ; - fioles jaugées 100,0 mL, 250,0 mL, 500,0 mL.2.1. Choisir, sans justification, le matériel nécessaire pour préparer S0.
2.2. 0
'0SA = 1,00.2.2.1. Déterminer graphiquement sur la Figure 1 de la
concentration molaire apportée en diiode de la solution S0. On fera clairement apparaître la
méthode graphique utilisée.2.2.2. En déduire la concentration molaire apportée cL en diiode du Lugol (solution commerciale
S0)2.2.3. Pourquoi a-t-il été nécessaire de diluer le Lugol (solution commerciale S0) ?
ACCÈS À LA CORRECTION
Annexe
Bac S Antilles Session de remplacement 2014 http://labolycee.org (5 points) Accès à la correction ssentiellement de fer et de carbone) entouré de cuivre. Elle a un diamètre de 21,25 mm, une épaisseur de1,67 mm et une masse de 3,93 g.
telle pièce.Le cuivre, de masse molaire 63,5 g.mol-1, est un métal qui peut être totalement oxydé en ions cuivre (II) par un
3 Cu(s) + 8 H+(aq) + 2 NO3-(aq) 3 Cu2+(aq) + 4 H2O(l) + 2 NO(g)
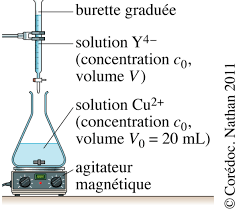
Les ions cuivre (II) formés se retrouvent intégralement dissous en solution gaz peu soluble.En pratique, on dépose une pièce de 5 centimes dans un erlenmeyer de 100 mL, on place cet erlenmeyer
sous la hotte et on met en fonctionnement la ventilation. -1. La pièce est alors assez vite oxydée et on obtient une solution notée S1.On transfère intégralement cette solution S1 dans une fiole jaugée de 100 mL et on complète cette dernière
2 qui contient également des ions
2 à 800 nm est mesurée, elle vaut 0,575.
1. Étalonnage.
1.1. pour - ?1.2. On fait subir à différents échantillons de métal cuivre pur le même traitement que celui décrit ci-dessus
pour la pièce. On obtient alors des Montrer, en utilisant le document 2 et en complétant que la loi de Beer-2. Détermination de la teneur en cuivre dans la pièce.
2.1. Déterminer
2.2. En déduire la teneur (ou " pourcentage massique ») en cuivre dans la pièce.
3. Incertitude.
lement la masse de cuivre présente dans 10 pièces de 5 centimes de même masse. Leurs résultats sont les suivants :Groupe 1 2 3 4 5 6 7 8 9 10
Masse de
cuivre (mg)260 270 265 263 264 265 262 261 269 267
3.1. Déterminer, grâce aux valeurs trouvées par
de 95 %) sur la mesure de la masse de cuivre dans une pièce. 3.2. niveau de confiance de 95 %.Accès à la correction
Document 1
On donne ci-
blanc » a été fait avec2+ de concentration 7,5×10-3 mol.L-1
II) Fe3+ de concentration 5,0×10-2 mol.L-1
couleur absorbée violet bleu vert jaune orange Rouge longueur (nm)400-424 424-491 491-575 575-585 585-647 647-850
couleur complémentaire jaune-vert jaune pourpre bleu vert-bleu bleu-vertDocument 2
A à 800 nm de solutions aqueuses contenant des ions cuivre (II), obtenues à partir de divers échantillons de métal cuivre pur : de cuivre (mg) 0 25,1 50,6 103,8 206,2 300,6 Concentration (mol.L-1) 0 3,95×10-3 7,97×10-3 1,63×10-2 3,25×10-2 4,74×10-2Absorbance 0 0,055 0,121 0,231 0,452 0,649
Document 3 : Incertitude sur un mesurage.
certitude sur le résultat du n valeurs {x1, x2 n} :Écart-type :
2 1quotesdbs_dbs2.pdfusesText_3[PDF] exercices sur la loi des mailles et des noeuds
[PDF] exercices sur la loi des mailles pdf
[PDF] exercices sur la loi des noeuds pdf
[PDF] exercices sur la mole
[PDF] exercices sur la mole seconde pdf
[PDF] exercices sur la nature des mots 1ère secondaire
[PDF] exercices sur la nature des mots 4eme primaire
[PDF] exercices sur la nature des mots ce1
[PDF] exercices sur la nature des mots cm1
[PDF] exercices sur la nature des mots cm2
[PDF] exercices sur la nature des mots pdf
[PDF] exercices sur la photosynthèse pdf
[PDF] exercices sur la réaction chimique seconde
[PDF] exercices sur la tension électrique seconde
