 ENZYMOLOGIE
ENZYMOLOGIE
Plan. Cinétique enzymatique. ▫ Calcul de l'équation de Michaélis-Mention. ▫ Détermination graphique de Km et Vmax. (représentation V en fonction de S
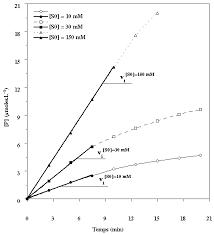
 Correction TD Série 2 (Enzymologie Partie 1) Correction. Exercice 1
Correction TD Série 2 (Enzymologie Partie 1) Correction. Exercice 1
Sur le graphique on voit que la réaction fonctionne en vitesse initiale On remarque que Vmax=Vmax app par contre Km est différent de Km apparent. Il ...
 TD 6 : Cinétique enzymatique (deuxième partie)
TD 6 : Cinétique enzymatique (deuxième partie)
4- Déterminer les 2 paramètres cinétiques Vmax et KM
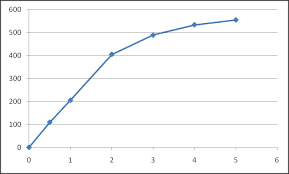
 Cours dEnzymologie
Cours dEnzymologie
La vitesse d'une réaction enzymatique a été mesurée pour plusieurs concentrations du substrat. Calculer les valeurs de KM et Vmax de cette réaction. [S] (μM) v0
 Chapitre 2: Spécificité enzymatique et régulation II-1-Spécificité
Chapitre 2: Spécificité enzymatique et régulation II-1-Spécificité
La détermination graphique de la Km et de vmax. 1-Pour déterminer les constantes Km déterminer graphiquement les valeurs de. Vmax et de Km plus précisément qu ...
 1Étude préliminaire de léquation de Michaelis-Mentens
1Étude préliminaire de léquation de Michaelis-Mentens
+ β o`u les constantes α et β sont `a déterminer. 10. Expliquer comment on peut déterminer graphiquement les param`etres KM et vmax `a partir de données.
 Travaux Dirigés : série n° 2
Travaux Dirigés : série n° 2
Déterminez les paramètres cinétiques (Vmax KM et kcat) et les paramètres cinétiques en présence de l'inhibiteur
 Untitled
Untitled
A partir du graphique reliant concentration plasmatique et temps déterminer la demi-vie terminale . a) Pour déterminer Km et Vmax
 ÉPREUVE DEXERCICES DAPPLICATION – Décembre 2015
ÉPREUVE DEXERCICES DAPPLICATION – Décembre 2015
a) Déterminer par une représentation graphique linéaire (Lineweaver-Burk ou Eadie-Hofstee). KM et Vmax dans le mélange B en précisant les unités des axes des
 Exercice 1 EPREUVE DEXERCICES DAPPLICATION 2008-2009
Exercice 1 EPREUVE DEXERCICES DAPPLICATION 2008-2009
1 – Déterminer graphiquement Km et Vmax (en 10-6mol.min-1.mg-1) du système enzyme- substrat en présence des inhibiteurs A et B. 2 – Déterminer les
 2- Modélisation de la vitesse initiale
2- Modélisation de la vitesse initiale
Pré-requis : savoir définir et déterminer une vitesse initiale (voir chapitre [S]0 +KM. Équation de Michaëlis-Menten. • pour [S]0 = KM : vi = vmax. KM.
 ENZYMOLOGIE
ENZYMOLOGIE
Plan. Cinétique enzymatique. ? Calcul de l'équation de Michaélis-Mention. ? Détermination graphique de Km et Vmax. (représentation V en fonction de S
 Exercice 3 EPREUVE DEXERCICES DAPPLICATION 2008-2009
Exercice 3 EPREUVE DEXERCICES DAPPLICATION 2008-2009
1 – Déterminer graphiquement Km et Vmax (en 10 2 – Déterminer les caractéristiques du système enzyme-substrat (Km et Vmax) en l'absence.
 Untitled
Untitled
Vmax = vitesse de catalyse = vitesse de la réaction lorsque toutes Pour déterminer Km il ... Déterminer graphiquement la Vmax et le Km de l'enzyme.
 DETERMINATION DE LA VITESSE INITIALE DUNE REACTION
DETERMINATION DE LA VITESSE INITIALE DUNE REACTION
-Déterminer l'équation de cette droite d'étalonnage A = a x n sucre inverti/tube + b. KM ET Vmax D'UNE REACTION ENZYMATIQUE. I. PAR METHODE CINETIQUE.
 Enzymologie théorique
Enzymologie théorique
Expérimentalement il n'est pas possible de déterminer Vmax ? on ne connaît Km grâce à différents traitements mathématiques
 Série TD Enzymologie N°2 Exercice1 La lactase (ß-galactosidase
Série TD Enzymologie N°2 Exercice1 La lactase (ß-galactosidase
Donner la signification de Vmax et Km. 4. Déterminer graphiquement les constantes cinétiques de cette enzyme. Exercice 3. Une enzyme catalyse la réaction :
 Chapitre V : Cinétique enzymatique 5.1 Phases de la réaction
Chapitre V : Cinétique enzymatique 5.1 Phases de la réaction
Km est la concentration de substrat nécessaire pour que l'enzyme atteint (1/2) Vmax. 5.3.1Représentation graphique de l'équation Michaelis-Menten. V = vmax.
 Travaux pratiques La cinétique enzymatique et son contrôle
Travaux pratiques La cinétique enzymatique et son contrôle
Vmax = vitesse de catalyse = vitesse de la réaction lorsque toutes les enzymes Déterminer graphiquement la Vmax et le Km de l'enzyme.
 1 BC 1 1 TP6 enz TP 6 : enzymologie Exercices de cinétique
1 BC 1 1 TP6 enz TP 6 : enzymologie Exercices de cinétique
choisir toujours la courbe en double inverse pour déterminer Km et Vmax. Déduire du tableau les Km et Vmax des deux enzymes sans construction graphique.
 [PDF] Correction TD Série 2 (Enzymologie Partie 1) Correction Exercice 1
[PDF] Correction TD Série 2 (Enzymologie Partie 1) Correction Exercice 1
Vous obtenez une droite pour chaque représentation A partir des deux représentations on détermine Km et Vmax pour les deux enzymes; Pour la Glucokinase
 [PDF] ENZYMOLOGIE
[PDF] ENZYMOLOGIE
Détermination graphique de Km et Vmax (représentation V en fonction de S selon Michaélis-Menton) ? Représentation en double inverse
 [PDF] DETERMINATION DE LA VITESSE INITIALE DUNE REACTION
[PDF] DETERMINATION DE LA VITESSE INITIALE DUNE REACTION
-Déterminer KM et Vmax -Comparer ces valeurs à celles obtenues la semaine précédente sans effecteur Remarque: les valeurs des pentes de chaque courbe de vi
 [PDF] Cinétique enzymatique - Faculté de Médecine dOran
[PDF] Cinétique enzymatique - Faculté de Médecine dOran
La cinétique enzymatique a pour but de déterminer les vitesses des réactions que l'enzyme catalyse et à mesurer son affinité pour les substrats
 La cinétique des enzymes michaeliennes et léquation de Michaelis
La cinétique des enzymes michaeliennes et léquation de Michaelis
22 nov 2012 · Pour déterminer les constantes KM et vmax il faut faire une étude cinétique Figure 2 - Vitesses initiales en fonction de la concentration en
 Représentations graphiques en enzymologie détermination de Km
Représentations graphiques en enzymologie détermination de Km
21 nov 2019 · Représentation graphique en cinétique enzymatique Linéarisation de l'équation de Michaelis Durée : 6:28Postée : 21 nov 2019
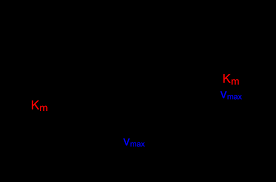
 [PDF] Cours dEnzymologie
[PDF] Cours dEnzymologie
On définit : ? Vmax : par le point d'intersection de la droite avec l'axe des ordonnés ? KM : par le point d'intersection de la droite avec l'axe des abscisses
 [PDF] 2- Modélisation de la vitesse initiale
[PDF] 2- Modélisation de la vitesse initiale
Pré-requis : savoir définir et déterminer une vitesse initiale (voir chapitre précédent) 1 Influence de la concentration en substrat sur la vitesse
 [PDF] Chapitre V : Cinétique enzymatique 51 Phases de la réaction
[PDF] Chapitre V : Cinétique enzymatique 51 Phases de la réaction
Km est la concentration de substrat nécessaire pour que l'enzyme atteint (1/2) Vmax 5 3 1Représentation graphique de l'équation Michaelis-Menten V = vmax
 [PDF] Mesure de lactivité enzymatique
[PDF] Mesure de lactivité enzymatique
déterminer la force ionique Vérifier que le tampon ne saturante [S] = 10 Km ( pour atteindre la Vmax) détermination graphique après réalisation
Comment déterminer km et Vmax ?
Il faut connaître la Vmax pour calculer l'activité molaire. Or [S] =1 x 10-2 M >> Km= 1 x 10-5 M (facteur 1000) donc on est en conditions saturantes de S. Cela signifie que la vitesse mesurée à cette concentration en S est la Vmax. Donc Vmax = 3 x10-5 M/min.Comment calculer le km en enzymologie ?
Km est égale à la concentration de substrat à laquelle la vitesse de la réaction est égale à la moitié de la vitesse maximum Vmax. V = Vmax/2, alors [S] = Km. La constante de Michaelis Km est une caractéristique fondamentale très utile d'un couple enzyme-substrat.Comment calculer la vitesse maximale d'une enzyme ?
À tout instant, la vitesse de réaction v est donnée par v=d[P]dt=k2[ES]–k?2[E][P].22 nov. 2012- Km et activité enzymatique
La constante de Michaelis Km est la concentration en substrat pour laquelle la vitesse initiale de la réaction est à la moitié de la vitesse initiale maximale. Cette constante est une concentration, elle a la même unité : mol. L-1.
[PDF] tp determination de la vitesse initiale d'une reaction enzymatique
[PDF] latis pro eurosmart
[PDF] latis pro analyse fourier
[PDF] calcul debit verin pneumatique
[PDF] calcul force d'un verin pneumatique
[PDF] tableau effort verin pneumatique
[PDF] calcul vitesse verin hydraulique
[PDF] tableau pourcentage vma temps distance
[PDF] vo2 max
[PDF] physiologie de l'effort pdf
[PDF] interpretation epreuve d'effort respiratoire
[PDF] epreuve d'effort vo2 max
[PDF] protocole de bruce tapis roulant
[PDF] epreuve deffort mets
