 Chapitre 1 La quantité de matière la concentration molaire et le
Chapitre 1 La quantité de matière la concentration molaire et le
des nombres d'atomes ou de molécules extrêmement grands veulent simplifier leurs calculs et inventent par commodité une nouvelle unité : la mole. En 1971
 1) Calculez le nombre dentités (N = nbr. de molécules atomes ou
1) Calculez le nombre dentités (N = nbr. de molécules atomes ou
Comment calculer la masse d'un corps pur (m) ? - Dans la table de Mendeleïev on reprend la masse molaire
 Calcul du nombre dinsaturations dune molécule
Calcul du nombre dinsaturations dune molécule
Le nombre d'insaturation d'une molécule est le nombre de cycles et de liaisons multiples qu'elle comporte. Une molécule organique qui possède nC atomes de
 Untitled
Untitled
Expliquer comment peut-on séparer les constituants des mélanges 112 1 de gaz quelconque contiennent. 3
 Calculer une quantité de matière
Calculer une quantité de matière
Une mole est un ensemble 602 × 1023 entités chimiques (atomes
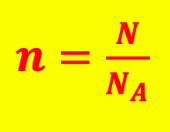 Chapitre 9 : Quantité de matière
Chapitre 9 : Quantité de matière
Exercice 8 : Calculer un nombre de molécules. On sait que : n = 66.10-3 mol Calcul du nombre de molécules de dioxyde d'azote par mètre cube d'air à ...
 1- La masse dune molécule est égale à
1- La masse dune molécule est égale à
2 – Calculer le nombre de gouttes d'eau dans un parallélépipède de volume. 100km ✕ 10km ✕ 100m. 1 Combien y a-t-il de molécules d'eau dans une goutte d'eau ?
 La définition et la mesure du nombre dAvogadro
La définition et la mesure du nombre dAvogadro
c'est le nombre de molécules contenues dans le volume constante universelle. 2. Déterminations expérimentales. - Les méthodes mises en oeuvre pour calculer le ...
 Spectrométrie de masse SM
Spectrométrie de masse SM
molécules par rapports à leur nombre de charge. Rapport masse sur charge : m z. Page 5. Comment peser une molécule ? Co. e t pese u e o écu e. Travailler en
 1) Calculez le nombre dentités (N = nbr. de molécules atomes ou
1) Calculez le nombre dentités (N = nbr. de molécules atomes ou
Comment calculer la masse d'un corps pur (m) ? - Dans la table de Mendeleïev on reprend la masse molaire
 Calcul du nombre dinsaturations dune molécule
Calcul du nombre dinsaturations dune molécule
Une molécule organique qui possède nC atomes de carbone est saturée lorsque elle possède. nH=(2n+2) atomes d'hydrogène ce qui correspond à la formule brute
 Module 1.1 : Révision
Module 1.1 : Révision
a) Calculer la masse molaire du PCl3 b) Extraire le nombre de molécule pour 300 g de PCl3 de M = m/n c) Déterminer le nombre d'atomes de chlore dans ce
 N 602×1023
N 602×1023
Chaque atome a une masse égale au nombre de nucléons ? 167×10?27 kg ( mn ). A : nombre total de nucléons 1 – Calculer le nombre de molécules d'eau.
 Chapitre 1 La quantité de matière la concentration molaire et le
Chapitre 1 La quantité de matière la concentration molaire et le
L'année dernière vous vous êtes « amusés » à calculer la quantité de matière d'une espèce chimique à partir de son nombre d'entités… Comment ça.
 EVALUATION BLANCHE
EVALUATION BLANCHE
Combien de molécules d'aspirine absorbe un patient qui prend un tel comprimé ? 3. Qu'est ce que la masse molaire moléculaire ? 4. Calculer la masse molaire
 Exercice sur la mole et la quantité de matière Niveau : seconde Thème
Exercice sur la mole et la quantité de matière Niveau : seconde Thème
L'ammoniac a comme formule brute NH3. 1. Calculer la masse d'une molécule d'ammoniac. 2. Déterminer le nombre N de molécules d'ammoniac contenues dans
 TP14 Correction
TP14 Correction
Réponses aux questions : 1. Quel est le nombre de molécules de glucose et de cholestérol contenues dans un litre de sang de Clara ? ? Masse d'une molécule
 M = 6x12+8x1+6x16=176 g.mol n = = = 57x10 mol n = nombre de
M = 6x12+8x1+6x16=176 g.mol n = = = 57x10 mol n = nombre de
27 mars 2006 a) calculer la masse molaire moléculaire de vitamine C. ... c)Calculer le nombre de molécules de vitamine C dans un cachet ainsi que le ...
 I/ Détermination dun nombre de molécules deau (9 points) II/ Chute
I/ Détermination dun nombre de molécules deau (9 points) II/ Chute
15 mars 2004 En notant y ce nombre de molécules d'eau la formule du sulfate de fer II hydraté est FeSO4
 [PDF] Chapitre 1 La quantité de matière la concentration molaire et le
[PDF] Chapitre 1 La quantité de matière la concentration molaire et le
L'année dernière vous vous êtes « amusés » à calculer la quantité de matière d'une espèce chimique à partir de son nombre d'entités Comment ça non ? Mais si
 [PDF] Calculer une quantité de matière
[PDF] Calculer une quantité de matière
Une mole est un ensemble 602 × 1023 entités chimiques (atomes ions ou molécules) Ce nombre est appelé « constante d'Avogadro » et est noté NA ? Le calcul d
 [PDF] 1) Calculez le nombre dentités (N = nbr de molécules atomes ou
[PDF] 1) Calculez le nombre dentités (N = nbr de molécules atomes ou
Comment calculer la masse d'un corps pur (m) ? - Dans la table de Mendeleïev on reprend la masse molaire ou masse d'une mole (M) - On reprend le nombre
 [PDF] Calcul du nombre dinsaturations dune molécule
[PDF] Calcul du nombre dinsaturations dune molécule
Le nombre d'insaturation d'une molécule est le nombre de cycles et de liaisons multiples qu'elle comporte Une molécule organique qui possède nC atomes de
 [PDF] la-mole-unite-de-quantite-de-matiere-exercices-corriges-2pdf
[PDF] la-mole-unite-de-quantite-de-matiere-exercices-corriges-2pdf
2) Calculer la masse molaire moléculaire M du méthacrylate de méthyle nombre y de molécules d'isoprène constituant la chaîne de cette macromolécule
 [PDF] Les molécules
[PDF] Les molécules
Une molécule est une particule électriquement neutre formé d'un nombre limité M(H) = 1 g/mol de l'oxygène est M(O) = 16 g/mol on peut calculer sa
 [PDF] Seconde Chapitre 6 Cours : La mole unité de quantité de matière
[PDF] Seconde Chapitre 6 Cours : La mole unité de quantité de matière
Pour pratiquer la chimie les chimistes doivent dénombrer le nombre d'atomes d'ions ou de molécules appelés « entités chimiques » (échelle microscopique)
 La mole : unité de quantité de matière - Maxicours
La mole : unité de quantité de matière - Maxicours
Une mole d'atomes de molécules ou d'ions contient donc 602 × 1023 atomes molécules ou ions Ce nombre est la constante d'Avogadro notée : NA = 602
 [PDF] 1- La masse dune molécule est égale à
[PDF] 1- La masse dune molécule est égale à
Une molécule est composée d'atomes Chaque atome a une masse égale au nombre de nucléons ? 167×10?27 kg ( mn ) A : nombre total de nucléons pour un seul
 [PDF] Chimie quantitative – mole masse molaire volume molaire
[PDF] Chimie quantitative – mole masse molaire volume molaire
1) Calculer la masse molaire du sulfate de cuivre hydraté 2497 g/mol Calcule le nombre de molécules contenues dans : 150 litres de NH3(g)
Comment on calcule le nombre de molécules ?
Une mole d'atomes, de molécules ou d'ions contient donc 6,02 × 1023 atomes, molécules ou ions. Ce nombre est la constante d'Avogadro, notée : NA = 6,02 × 1023 mol-1. Exemples : Dans une mole d'atomes d'oxygène, il y a 6,02 × 1023 atomes d'oxygène.Comment déterminer le nombre de molécules dans un échantillon ?
La quantité de matière, en mole (symbole : mol), d'une entité dans un échantillon contenant entités est . On en déduit donc que le nombre d'entités d'un échantillon dont la quantité de matière en entité est (en mol) est . 3 moles d'eau contiennent : = 3 × 6,02 × 1023 = 1,806 × 1024 molécules d'eau H2O.Comment déterminer le nombre de moles ?
Il suffit d'appliquer la relation n=m/M pour déterminer le nombre de mole.- Donc 2x1 (hydrogène) + 1x16 (oxygène) = 18g. 1 mole contient également le nombre d'Avagadro de molécules : environ 6.1023. Donc 1 cm3 d'eau correspond à 1 g d'eau, ce qui fait 6.1023/18, soit 3.1022 moleculesc'est beaucoup Une règle de 3 permet de calculer le nombre de molécules dans un volume donné

2CHDF - Correction des exercices1. Chimie quantitative
Module 1.1 : Révision
1.1.1.Combien y a-t-il d'atomes de chlore dans 3,00 g de trichlorure de phosphore,
composé de formule brute PCl3 ?Quelle est la masse de ces atomes de chlore ?
Stratégie :
a) Calculer la masse molaire du PCl3 b) Extraire le nombre de molécule pour 3,00 g de PCl3 de M = m/n c) Déterminer le nombre d'atomes de chlore dans ce même échantillon d) Extraire la masse de ces atomes de chlore de M = m/nRésolution :
a) M(PCl3) = 30,97 + 3 . 35,45 = 137,32 g/mol b) n = m/M = 3,00 g / 137,32 g/mol = 2,18 . 10-2 mol c) 3x plus de chlore que de molécules => 3,00 . 2,18 . 10-2 mol = 6,55 . 10-2 mol d) m = M . n = 35,45 g/mol . 6,55 . 10-2 mol = 2,32 g1.1.2.La caféine est un alcaloïde présent dans le café, le thé et la kola. Sa formule brute
est C8H10N4O2. La teneur en caféine varie selon la variété de café. Lorsque le café est
dit fort, il contient 6,55 . 10-3 mol de caféine par litre de café. a) Quelle masse de caféine y a-t-il dans un litre de café ? b) Combien de molécules de caféine y a-t-il dans une tasse (150 mL) de café fort ?Stratégie :
a) Calculer la masse molaire du C8H10N4O2 b) Trouver la masse dans 6,55 . 10-3 mol avec M = m/n c) Trouver le nombre de molécules dans 6,55 . 10-3 mol avec NA = N / n d) Trouver le nombre de molécules dans 150 mLRésolution :
a) M(C8H10N4O2) = 8 . 12,01 + 10 . 1,008 + 4 . 14,01 + 2 . 16,00 = 194,20 g/mol b) m = M . n = 194,20 g/mol . 6,55 . 10-3 mol = 1,27 g dans 1 L c) N = NA . n = 6,02 . 1023 molécules/mol . 6,55 . 10-3 mol = 3,94 . 1021 moléc. dans 1 L d) 3,94 . 1021 molécules / 1 L = x / 0,15 L => x = 5,91 . 1020 molécules dans 1 tasse 1/312CHDF - Correction des exercices1. Chimie quantitative
1.1.3.Le dioxyde de carbone est un des principaux gaz responsable de l'effet de serre.
Lors de la réaction de combustion du carbone dans l'air, il se forme du dioxyde de carbone selon l'équation suivante : 1 C + 1 O2 → 1 CO2 a) Combien d'atomes de carbone trouve-t-on dans 10,0 g de carbone pur ? b) Quelle masse de CO2 sera produite par la réaction complète de ces 10,0 g de C ?Stratégie :
a) Calculer le nombre de moles d'atomes dans 10 g de C avec M = m/n b) Calculer le nombre d'atomes avec NA = N / n c) Déterminer le nombre de mole de molécules de CO2 créés d) Calculer la masse molaire du CO2 e) Calculer la masse de CO2 avec M = m/nRésolution :
a) n = m / M = 10,0 g / (12,01 g/mol) = 8,33 . 10-1 mol b) N = NA . n = 6,02 . 1023 atomes / mol . 8,33 . 10-1 mol = 5,01 . 1023 atomes c) 1 C crée 1 CO2 => n(C) consommé = n(CO2) créé = 8,33 . 10-1 mol d) M(CO2) = 12,01 + 2 . 16,00 = 44,01 g/mol e) m = n . M = 8,33 . 10-1 mol . 44,01 g/mol = 36,7 g1.1.4.Lors d'une analyse d'un oxyde de cobalt, on détermine que le cobalt constitue 71 %
de la masse de ce composé. La formule brute de la molécule est-elle CoO ouCo2O3 ? Justifiez votre réponse par un calcul.
Stratégie :
Comparer la masse des Co contenus dans la molécule à la masse de la molécule a) Calculer la masse molaire du CoO et du Co2O3 b) Calculer le pourcentage de Co dans chacun des deux composésRésolution :
a) M(CoO) = 58,93 + 16,00 = 74,93 g/molM(Co2O3) = 2 . 58,93 + 3 . 16,00 = 165,86 g/mol
b) % Co dans CoO : 58,93 g/mol / 74,93 g/mol = 78,65 % % Co dans Co2O3 : 2 . 58,93 g/mol / 165,86 g/mol = 71,06 % => Il s'agit du Co2O3 2/312CHDF - Correction des exercices1. Chimie quantitative
1.1.5.Déterminer lequel de ces échantillon contient le plus d'atomes d'hydrogène : 730 mg
de HCl, 1,0 . 10-2 mol de sucre (C6H12O6) ou 1,00 mL d'eau.Stratégie :
Calculer le nombre de moles de molécules avec M = m / n Calculer le nombre de molécules avec NA = N / n Calculer le nombre d'atomes d'hydrogène correspondantRésolution :
a) M(HCl) = 35,45 g/mol + 1,008 g/mol = 36,46 g/mol n = m / M = 0,730 g / 36,46 g/mol = 2,00 . 10-2 mol N = n . NA = 2,00 . 10-2 mol . 6,02 . 1023 molécules/mol = 1,21 . 1022 molécules Il y a 1 H par HCl => N(H) = N(HCl) = 1,21 . 1022 atomes d'hydrogène b) N = n . NA = 1,0 . 10-2 mol . 6,02 . 1023 molécules/mol = 6,0 . 1021 molécules Il y a 12 H par C6H12O6 => N(H) = 12 . N(C6H12O6) = 7,2 . 1022 at. d'hydrogène c) 1,0 mL d'eau pèse 1,0 gMM(H2O) = 2 . 1,008 + 16,00 = 18,02 g/mol
n = m / M = 1 g / 18,02 g/mol = 5,55 . 10-2 mol N = n . NA = 5,55 . 10-2 mol . 6,02 . 1023 molécules/mol = 3,34 . 1022 molécules Il y a 2 H par H2O => N(H) = 2 . N(H2O) = 6,68 . 1022 atomes d'hydrogène d) L'échantillon d'eau possède le plus grand nombre d'atomes d'hydrogène1.1.6.Un des poisons chimique les plus virulents est la batrachotoxine (C31H42N2O6), qui a
été extraite de la peau de certaines grenouilles de Colombie. La dose mortelle de ce poison est de 0,20 mg pour un adulte. Calculez le nombre de molécules présentes dans cette dose.Stratégie :
a) Calculer la masse molaire du C31H42N2O6 b) Trouver le nombre de moles avec M = m/n c) Trouver le nombre de molécules avec NA = N / nRésolution :
a) M(C31H42N2O6 ) = 31 . 12,01 + 42 . 1,008 + 2 . 14,01 + 6 . 16,00 = 538,67 g/mol b) n = m / M = 2,0 . 10-4 g / 538,67 g/mol = 3,7 . 10-7 mol c) N = NA . n = 6,02 . 1023 molécules/mol . 3,7 . 10-7 mol = 2,2 . 1017 molécules 3/312CHDF - Correction des exercices1. Chimie quantitative
1.1.7.Le calcaire, de formule CaCO3, se décompose sous l'effet de la chaleur en gaz
caronique, CO2 et en oxyde de calcium CaO. a) Donnez l'équation de réaction. b) Quelle masse de CO2 sera libérée lorsque l'on chauffe 10,0 g de CaCO3 ?Stratégie :
a) Écrire et équilibrer l'équation de réaction b) Déterminer la masse molaire de CaCO3 b) Calculer le nombre de moles dans 10 g de CaCO3 avec M = m/n c) Déterminer le nombre de mole de molécules de CO2 créés d) Calculer la masse molaire du CO2 e) Calculer la masse de CO2 avec M = m/nRésolution :
a) CaCO3 → CaO + CO2 b) M(CaCO3) = 40,08 + 12,01 + 3 . 16,00 = 100,09 g/mol c) n = m / M = 10,0 g / 100,09 g/mol = 9,99 . 10-2 mol d) 1 CaCO3 crée 1 CO2 => n(CaCO3) consommé = n(CO2) créé = 9,99 . 10-2 mol d) M(CO2) = 12,01 + 2 . 16,00 = 44,01 g/mol e) m = n . M = 9,99 . 10-2 mol . 44,01 g/mol = 4,40 g1.1.8.Le fluor constitue 51 % de la masse d'un échantillon de fluorure de manganèse.
Déterminez si cet échantillon est constitué de fluorure de manganèse (II), de fluorure de manganèse (III) ou de fluorure de manganèse (IV).Stratégie :
Comparer la masse des F contenus dans la molécule à la masse de la molécule a) Calculer la masse molaire du MnF2, MnF3 et du MnF4 b) Calculer le pourcentage de F dans chacun des deux composésRésolution :
a) M(MnF2) = 54,94 + 2 . 19,00 = 92,94 g/molM(MnF3) = 54,94 + 3 . 19,00 = 111,94 g/mol
M(MnF4) = 54,94 + 4 . 19,00 = 130,94 g/mol
b) % F dans MnF2 : 2 . 19,00 g/mol / 92,94 g/mol = 40,88 % % F dans MnF3 : 3 . 19,00 g/mol / 111,94 g/mol = 50,92 % <= il s'agit de MnF3 % F dans MnF4 : 4 . 19,00 g/mol / 130,94 g/mol = 58,04 % 4/31quotesdbs_dbs28.pdfusesText_34[PDF] nombre d'atomes dans l'univers
[PDF] masse d'un atome de soufre
[PDF] que represente la masse molaire atomique du soufre
[PDF] ion sulfure composition
[PDF] formule sulfure de sodium
[PDF] nombre de charges positives dans le fer
[PDF] ion soufre formule
[PDF] ion lithium formule
[PDF] formule de l'ion iodure
[PDF] diametre primitif pignon chaine
[PDF] datedif ne fonctionne pas
[PDF] datedif excel 2010
[PDF] masse d'une mole de glucose
[PDF] lors d'un effort physique une partie du glucose stocké
