 Chapitre 1 La quantité de matière la concentration molaire et le
Chapitre 1 La quantité de matière la concentration molaire et le
des nombres d'atomes ou de molécules extrêmement grands veulent simplifier leurs calculs et inventent par commodité une nouvelle unité : la mole. En 1971
 1) Calculez le nombre dentités (N = nbr. de molécules atomes ou
1) Calculez le nombre dentités (N = nbr. de molécules atomes ou
Comment calculer la masse d'un corps pur (m) ? - Dans la table de Mendeleïev on reprend la masse molaire
 Calcul du nombre dinsaturations dune molécule
Calcul du nombre dinsaturations dune molécule
Le nombre d'insaturation d'une molécule est le nombre de cycles et de liaisons multiples qu'elle comporte. Une molécule organique qui possède nC atomes de
 Untitled
Untitled
Expliquer comment peut-on séparer les constituants des mélanges 112 1 de gaz quelconque contiennent. 3
 Module 1.1 : Révision
Module 1.1 : Révision
Quelle est la masse de ces atomes de chlore ? Stratégie : a) Calculer la masse molaire du PCl3 b) Extraire le nombre de molécule pour 300 g
 Calculer une quantité de matière
Calculer une quantité de matière
Une mole est un ensemble 602 × 1023 entités chimiques (atomes
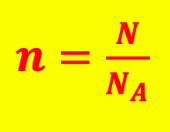 Chapitre 9 : Quantité de matière
Chapitre 9 : Quantité de matière
Exercice 8 : Calculer un nombre de molécules. On sait que : n = 66.10-3 mol Calcul du nombre de molécules de dioxyde d'azote par mètre cube d'air à ...
 1- La masse dune molécule est égale à
1- La masse dune molécule est égale à
2 – Calculer le nombre de gouttes d'eau dans un parallélépipède de volume. 100km ✕ 10km ✕ 100m. 1 Combien y a-t-il de molécules d'eau dans une goutte d'eau ?
 La définition et la mesure du nombre dAvogadro
La définition et la mesure du nombre dAvogadro
c'est le nombre de molécules contenues dans le volume constante universelle. 2. Déterminations expérimentales. - Les méthodes mises en oeuvre pour calculer le ...
 Spectrométrie de masse SM
Spectrométrie de masse SM
molécules par rapports à leur nombre de charge. Rapport masse sur charge : m z. Page 5. Comment peser une molécule ? Co. e t pese u e o écu e. Travailler en
 1) Calculez le nombre dentités (N = nbr. de molécules atomes ou
1) Calculez le nombre dentités (N = nbr. de molécules atomes ou
Comment calculer la masse d'un corps pur (m) ? - Dans la table de Mendeleïev on reprend la masse molaire
 Calcul du nombre dinsaturations dune molécule
Calcul du nombre dinsaturations dune molécule
Une molécule organique qui possède nC atomes de carbone est saturée lorsque elle possède. nH=(2n+2) atomes d'hydrogène ce qui correspond à la formule brute
 Module 1.1 : Révision
Module 1.1 : Révision
a) Calculer la masse molaire du PCl3 b) Extraire le nombre de molécule pour 300 g de PCl3 de M = m/n c) Déterminer le nombre d'atomes de chlore dans ce
 N 602×1023
N 602×1023
Chaque atome a une masse égale au nombre de nucléons ? 167×10?27 kg ( mn ). A : nombre total de nucléons 1 – Calculer le nombre de molécules d'eau.
 Chapitre 1 La quantité de matière la concentration molaire et le
Chapitre 1 La quantité de matière la concentration molaire et le
L'année dernière vous vous êtes « amusés » à calculer la quantité de matière d'une espèce chimique à partir de son nombre d'entités… Comment ça.
 EVALUATION BLANCHE
EVALUATION BLANCHE
Combien de molécules d'aspirine absorbe un patient qui prend un tel comprimé ? 3. Qu'est ce que la masse molaire moléculaire ? 4. Calculer la masse molaire
 Exercice sur la mole et la quantité de matière Niveau : seconde Thème
Exercice sur la mole et la quantité de matière Niveau : seconde Thème
L'ammoniac a comme formule brute NH3. 1. Calculer la masse d'une molécule d'ammoniac. 2. Déterminer le nombre N de molécules d'ammoniac contenues dans
 TP14 Correction
TP14 Correction
Réponses aux questions : 1. Quel est le nombre de molécules de glucose et de cholestérol contenues dans un litre de sang de Clara ? ? Masse d'une molécule
 M = 6x12+8x1+6x16=176 g.mol n = = = 57x10 mol n = nombre de
M = 6x12+8x1+6x16=176 g.mol n = = = 57x10 mol n = nombre de
27 mars 2006 a) calculer la masse molaire moléculaire de vitamine C. ... c)Calculer le nombre de molécules de vitamine C dans un cachet ainsi que le ...
 I/ Détermination dun nombre de molécules deau (9 points) II/ Chute
I/ Détermination dun nombre de molécules deau (9 points) II/ Chute
15 mars 2004 En notant y ce nombre de molécules d'eau la formule du sulfate de fer II hydraté est FeSO4
 [PDF] Chapitre 1 La quantité de matière la concentration molaire et le
[PDF] Chapitre 1 La quantité de matière la concentration molaire et le
L'année dernière vous vous êtes « amusés » à calculer la quantité de matière d'une espèce chimique à partir de son nombre d'entités Comment ça non ? Mais si
 [PDF] Calculer une quantité de matière
[PDF] Calculer une quantité de matière
Une mole est un ensemble 602 × 1023 entités chimiques (atomes ions ou molécules) Ce nombre est appelé « constante d'Avogadro » et est noté NA ? Le calcul d
 [PDF] 1) Calculez le nombre dentités (N = nbr de molécules atomes ou
[PDF] 1) Calculez le nombre dentités (N = nbr de molécules atomes ou
Comment calculer la masse d'un corps pur (m) ? - Dans la table de Mendeleïev on reprend la masse molaire ou masse d'une mole (M) - On reprend le nombre
 [PDF] Calcul du nombre dinsaturations dune molécule
[PDF] Calcul du nombre dinsaturations dune molécule
Le nombre d'insaturation d'une molécule est le nombre de cycles et de liaisons multiples qu'elle comporte Une molécule organique qui possède nC atomes de
 [PDF] la-mole-unite-de-quantite-de-matiere-exercices-corriges-2pdf
[PDF] la-mole-unite-de-quantite-de-matiere-exercices-corriges-2pdf
2) Calculer la masse molaire moléculaire M du méthacrylate de méthyle nombre y de molécules d'isoprène constituant la chaîne de cette macromolécule
 [PDF] Les molécules
[PDF] Les molécules
Une molécule est une particule électriquement neutre formé d'un nombre limité M(H) = 1 g/mol de l'oxygène est M(O) = 16 g/mol on peut calculer sa
 [PDF] Seconde Chapitre 6 Cours : La mole unité de quantité de matière
[PDF] Seconde Chapitre 6 Cours : La mole unité de quantité de matière
Pour pratiquer la chimie les chimistes doivent dénombrer le nombre d'atomes d'ions ou de molécules appelés « entités chimiques » (échelle microscopique)
 La mole : unité de quantité de matière - Maxicours
La mole : unité de quantité de matière - Maxicours
Une mole d'atomes de molécules ou d'ions contient donc 602 × 1023 atomes molécules ou ions Ce nombre est la constante d'Avogadro notée : NA = 602
 [PDF] 1- La masse dune molécule est égale à
[PDF] 1- La masse dune molécule est égale à
Une molécule est composée d'atomes Chaque atome a une masse égale au nombre de nucléons ? 167×10?27 kg ( mn ) A : nombre total de nucléons pour un seul
 [PDF] Chimie quantitative – mole masse molaire volume molaire
[PDF] Chimie quantitative – mole masse molaire volume molaire
1) Calculer la masse molaire du sulfate de cuivre hydraté 2497 g/mol Calcule le nombre de molécules contenues dans : 150 litres de NH3(g)
Comment on calcule le nombre de molécules ?
Une mole d'atomes, de molécules ou d'ions contient donc 6,02 × 1023 atomes, molécules ou ions. Ce nombre est la constante d'Avogadro, notée : NA = 6,02 × 1023 mol-1. Exemples : Dans une mole d'atomes d'oxygène, il y a 6,02 × 1023 atomes d'oxygène.Comment déterminer le nombre de molécules dans un échantillon ?
La quantité de matière, en mole (symbole : mol), d'une entité dans un échantillon contenant entités est . On en déduit donc que le nombre d'entités d'un échantillon dont la quantité de matière en entité est (en mol) est . 3 moles d'eau contiennent : = 3 × 6,02 × 1023 = 1,806 × 1024 molécules d'eau H2O.Comment déterminer le nombre de moles ?
Il suffit d'appliquer la relation n=m/M pour déterminer le nombre de mole.- Donc 2x1 (hydrogène) + 1x16 (oxygène) = 18g. 1 mole contient également le nombre d'Avagadro de molécules : environ 6.1023. Donc 1 cm3 d'eau correspond à 1 g d'eau, ce qui fait 6.1023/18, soit 3.1022 moleculesc'est beaucoup Une règle de 3 permet de calculer le nombre de molécules dans un volume donné

EVALUATIONBLANCHESavoirSavoir_Faire_1Savoir_Faire_2ObjectifsàvaliderS1S2S3SF1_1SF1_2SF1_3SF2_1SF2_2Chaquecalculserarédigécorrectement.Donnéespourtouslesexercices:M(H)=1,00g/mol;M(C)=12,0g/mol;M(O)=16,0g/molExercice1:Desmoléculesd'aspirineL'aspirineestunemoléculedontlaformuleestC9H8O4.Onpeuttrouverdel'aspirineencompriméouensachet.1. Qu'estcequelenombred'Avogadro?expliquer.2. Uncompriméd'aspirinecontient2,78×10-3moldemoléculesd'aspirine.Combiendemoléculesd'aspirineabsorbeunpatientquiprenduntelcomprimé?3. Qu'estcequelamassemolairemoléculaire?4. Calculerlamassemolairemoléculairedelamoléculed'aspirine.5. Quelleestlaquantitédematièred'aspirine(expriméeenmoles)dansunsachetde1,0gd'aspirine?S_1SF1_1S_2SF1_2S_3SF1_3Exercice2:DesmoléculesdesucreUnmorceaudesucrecontientdesmoléculesdesaccharosedeformuleC12H22O11.Calculerlaquantitédematièredemoléculesdesaccharosedansunmorceaudesucrede2,0g.SF2_1Exercice3:Desmoléculesd'eauDansunprotocoledechimieondoitpréparerunequantitédematièrede0,23mold'eau.Calculerlamassed'eauquecelareprésente.Onrappellequelamoléculed'eauapourformuleH2O.SF2_2
Exercice1:Desmoléculesd'aspirineL'aspirineestunemoléculedontlaformuleestC9H8O4.Onpeuttrouverdel'aspirineencompriméouensachet.1. Lenombred'Avogadroestégaleà6,02x1023,ilreprésentelaquantitéd'entités(atomesoumolécules)dansunemoled'entités.2. Onan=2,78×10-3moldemoléculesd'aspirineetonchercheNlenombredemoléculesd'aspirine.DoncN=2,78×10-3x6,02x1023=1,67x1021moléculesLenombredemoléculesd'aspirineestde1,67x1021molécules3. Lamassemolairemoléculaireestlamassed'unemoledemolécules.4. M(C9H8O4)=9xM(C)+8xM(H)+4xM(O)M(C9H8O4)=9x12+8x1+4x16M(C9H8O4)=180g/molLamassemolairedelamoléculed'aspirineestde180g/mol.5. Onam(C9H8O4)=1,0getM(C9H8O4)=180g/mol,oncherchen(C9H8O4)=?Larelationentren,metMestn=m/Mavecnenmol,mengetMeng/moln(C9H8O4)=m(C9H8O4)/M(C9H8O4)A.N.:n(C9H8O4)=1,0/180=5,6x10-3molLaquantitédematièredemoléculesd'aspirineestde5,6x10-3molS_1SF1_1S_2SF1_2S_3SF1_3Exercice2:DesmoléculesdesucreOncalculelamassemolairemoléculairedusaccharose:M(C12H22O11)=12xM(C)+22xM(H)+11xM(O)M(C12H22O11)=12x12,0+22x1,00+11x16,0M(C12H22O11)=342g/molOnaM(C12H22O11)=342g/mol,m(C12H22O11)=2,0g,oncherchen(C12H22O11)=?Larelationentren,metMestn=m/Mavecnenmol,mengetMeng/moln(C12H22O11)=m(C12H22O11)/M(C12H22O11)A.N.:n(C12H22O11)=2,0/342=5,8x10-3molLaquantitédematièredemoléculesdesaccharoseestde5,8x10-3molSF2_1Exercice3:Desmoléculesd'eauOncalculelamassemolairemoléculairedel'eau:M(H2O)=2xM(H)+M(O)M(H2O)=2x1,00+1x16,0M(H2O)=18,0g/molOnaM(H2O)=18,0g/mol,n(H2O)=0,23mol,oncherchem(H2O)=?Larelationentren,metMestn=m/Mavecnenmol,mengetMeng/molSF2_2
quotesdbs_dbs28.pdfusesText_34[PDF] nombre d'atomes dans l'univers
[PDF] masse d'un atome de soufre
[PDF] que represente la masse molaire atomique du soufre
[PDF] ion sulfure composition
[PDF] formule sulfure de sodium
[PDF] nombre de charges positives dans le fer
[PDF] ion soufre formule
[PDF] ion lithium formule
[PDF] formule de l'ion iodure
[PDF] diametre primitif pignon chaine
[PDF] datedif ne fonctionne pas
[PDF] datedif excel 2010
[PDF] masse d'une mole de glucose
[PDF] lors d'un effort physique une partie du glucose stocké
