 POLU1 - Emissions
POLU1 - Emissions
Exercice : Calculer la fraction molaire en ppm d'acide sulfurique H2SO4
 CHAPITRE I : GENERALITES SUR LES OPERATIONS UNITAIRES
CHAPITRE I : GENERALITES SUR LES OPERATIONS UNITAIRES
Exemple 1: On dissout 49g d'acide sulfurique dans 18g d'H2O. Calculer la ➢ Passage de la fraction molaire à la fraction massique. Soit un mélange de ...
 ⇒ ρ ρ ρ
⇒ ρ ρ ρ
Cela peut expliquer un écart de 4°C. Exercice N°6 – Volume molaire partiel Nous allons transformer la fraction massique w1 = wKCl en fraction molaire xKCl.
 Chapitre 1
Chapitre 1
Calculer la fraction molaire en méthanol et la fraction molaire en eau. 5 Exemple : mélange malaxage d'une pâte en continu
 Utilisation dans MATLAB
Utilisation dans MATLAB
PIB spécifiques au modèle du volume molaire liquide. CodeBinMixtureRules. 5 : Solubilité expérimentale de l'aspirine (fraction molaire) o x. : Solubilité ...
 Chapitre 0 Pré-requis
Chapitre 0 Pré-requis
exemple de soluté non ionique est le glucose C6H12O6. Les dipôles des molécules La fraction molaire d'un constituant i est égale au rapport du nombre de ...
 Fraction molaire pressions partielles
Fraction molaire pressions partielles
C un mélange de 2 moles d'oxygène et 5 moles d'azote est comprimé à 3 atm. Calculer la fraction molaire de l'oxygène
 Corrigé Type de la Série Numéro Trois
Corrigé Type de la Série Numéro Trois
Exercice 2 a) Fractions molaires de chaque constituant ? La fraction molaire Xi de chaque constituant i est calculée à partir de la relation suivante : où
 Biophysique des solutions
Biophysique des solutions
13 nov. 2018 Exemple. Déterminer la fraction molaire du soluté puis celle du solvant dans le sérum glucosé `a 5% la composition de la solution est : 5 ...
 1 CHIMIE II Chapitre I : les solutions
1 CHIMIE II Chapitre I : les solutions
La fraction molaire d'un constituant A est égale au rapport du nombre de moles de Exemple : calculer la fraction molaire de NaCl (l'exemple précédent).
 Biophysique des solutions
Biophysique des solutions
29 sept. 2014 Exemples. Les solutions. N.cheriet ... Exemple. Déterminer la fraction molaire du soluté puis celle du solvant dans le sérum glucosé `a 5% ...
 Travail dirigé 5 : La concentration dune solution
Travail dirigé 5 : La concentration dune solution
la fraction molaire. - la densité. - la masse volumique. Exercices : 1. On mélange deux volumes différents de solutions dont la teneur respective en glucose
 COURS DE CHIMIE GENERALE Semestre 1 SVI
COURS DE CHIMIE GENERALE Semestre 1 SVI
Pourcentage ou Fraction Exemple. 7. Mole et masse molaire. Une mole correspond à la quantité de ... xi : fraction molaire du constituant Ai; =.
 CHAPITRE I : GENERALITES SUR LES OPERATIONS UNITAIRES
CHAPITRE I : GENERALITES SUR LES OPERATIONS UNITAIRES
La somme des fractions molaires est égale à 1 : ? = 1. Exemple 1: On dissout 49g d'acide sulfurique dans 18g d'H2O. Calculer la fraction molaire de
 Les solutions
Les solutions
équivalent par litre eq.L-1 nombre de moles d'ions monovalents équivalents dissous dans un litre de solution fraction molaire. (titre molaire) x.
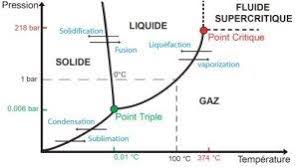
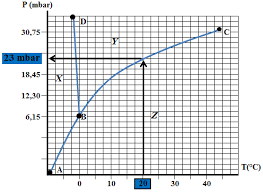
 Th3 - Changement de phase dun corps pur I. Quelques définitions
Th3 - Changement de phase dun corps pur I. Quelques définitions
De même pour x2 fraction massique de la phase 2 : x2 = m2 m . On a x1 + x2 = 1. On peut définir de même les fractions molaires
 I. Composition dune solution II. Différents types de solutions
I. Composition dune solution II. Différents types de solutions
Exemple : Quelle est la fraction molaire de chacun des composants dans une solution contenant 36 g d'eau et 46 g de glycérine [C3H5(OH)3] ?
 Chapitre 1
Chapitre 1
Exemple : Procédé continu de production d'esters méthyliques par catalyse La fraction molaire notée x ou le pourcentage molaire (x %) est une grandeur.
 LAIR ET LATMOSPHÈRE
LAIR ET LATMOSPHÈRE
Leurs concentrations types sont indiquées par les tableaux suivants. CONSTITUANTS PERMANENTS constituant fraction molaire azote (N2) oxygène (O2) argon (Ar).
I. solution
Une solution est un mélange homogène de deux ou plusieurs substances, initialement dans un état (solide, liquide, gazeux). Les constituants importants de la solution sont : le soluté et le solvant.Exemple :
- e - alliage or-cuivre = or + cuivre cuivre est le solvant. Pour connaître quel est le soluté ou le solvant dans la solution, il faut déterminer ainsi : - si le soluté et le solvant sont dans les mêmes états, la substance qui présente en plus grande quantité est le solvant et celle de plus petite quantité est le soluté. - si le soluté et le solvant sont dans les états différents, la substance deII. Différents types de solutions
état des substances : solutions de
gaz, de liquides ou de solides. Les solutés dans les solutions peuvent être des gaz, des liquides ou des solides.Solutions dans
différents étatsTypes de solutions Exemples
Solutions de
gazGaz dans les gaz -
diazote.Liquides dans les gaz -
Solides dans les gaz - I2
Solutions de
liquidesGaz dans les liquides - Eau gazeux (CO2
Liquides dans les liquides -
Solides dans les liquides -
Solutions de
solidesGaz dans les solides - H2 dans Pd
Liquides dans les solides - Hg dans Ag
Solides dans les solides - Alliage tel que Cu dans Zn II. Les solutions et la préparation des solutions 21III. Concentration des solutions
La soluté présent dans une quantité donnée de solution.3.1. Concentration en pourcentage
La parties de soluté sont présentes dans 100 parties de solution. La concentration en pourcentage se divise en 4 types : a) Pourcentage en masse par masse Un pourcentage en masse par masse est la masse de soluté dans 100 unités en masse de solution. Exemple : Une solution salée de 15 % en masse signifie que dans le pourcentage en masse par masse, on utilise la formule suivante : % en masse par masse = 100)()(gsolutionlademasse gsolutédumasse (masse de la solution = masse du soluté + masse du solvant) b) Pourcentage en masse par volume Un pourcentage en masse par volume est la masse de soluté dans 100 unités en volume de solution, par exemple, une solution de glucose à
20% en masse par volume veut dire que dans 100 mL de solution
contient 20 g de glucose. Pour calculer le pourcentage en masse par volume, on utilise la formule suivante : % en masse par volume = 100)()(mLsolutionladevolume gsolutédumasse c) Pourcentage en volume par masse Un pourcentage en volume par masse est le volume de soluté dans
100 g de solution, par exemple2SO4)
à 80% en volume par masse (v/m) veut dire que dans 100 g de solution contient 80 mL ou 80 cm3 de H2SO4. Pour calculer le pourcentage en volume par masse, on utilise la formule suivante : % en volume par masse = 100)()(gsolutionlademasse mLsolutéduvolume II. Les solutions et la préparation des solutions 22
d) Pourcentage en volume par volume Un pourcentage en volume par volume est le volume de soluté dans
100 unités en volume de solution.
Exemple 2SO4) à 80% en volume
par volume veut dire que dans 100 mL de solution masse, on utilise la formule suivante : % en volume par volume = 100)()(mLsolutionladevolume mLsolutéduvolume
3.2. La molarité ou concentration molaire volumique
La molarité est le nombre de soluté présent dans 1 L ou 100 mL de molar ou mol/dm3 ou mol/L ou M, tels que : - Si NaOH 40 g = 1 mol dissout dans 1 dm3 solution obtenue est 1 mol/dm3 ou on peut dire que la solution de NaOH de concentration 1 molar (1 M) contient 40 g de NaOH ou 1 mol.58,44 = 116,88 g.
On peut calculer la concentration molaire volumique par la formule suivante : LV molnCC : molarité en mol/L ou mol/dm3 ou M
n : nombre de moles de soluté (en mol)V : volume de la solution (en L)
Exemple : Calculer la molarité éparée en dissolvant 12 gétant de
1,50 L. (Données : H = 1 ; O = 16 ; Na = 23)
Solution
Pour calculer la molarité
de moles de NaOH. molg g M mNaOHn/40 12 = 0,3 molMolarité :
LV molnC L mol 5,1 3,0 = 0,2 mol/L II. Les solutions et la préparation des solutions 233.3. La molalité ou concentration en mole par kilogramme
La molalité est le nombre de moles de soluté dans 1 kg de solvant, molal ou mol/kg ou m, par exemple, la solution de glucose dans 1 kg ou 1000 g de solvant. On pourrait utiliser la formule suivante pour calculer la molalité :Molalité (m) =
Kgsolvantdumasse
molsolutédemolesdenombreExemple : On dissout 10 g de sucre (C12H22O11
est la molalité (concentration en mol/kg) de cette solution ? (Données : H = 1 ; C = 12 ; O = 16)Solution
Masse molaire du sucre = 342 g/mol
n (C12H22O11) = molg g M m /342 10 = 0,029 mol m (C12H22O11) = 125 g = 0,125 kgMolalité (m) =
Kgsolvantdumasse
molsolutédemolesdenombre kg mol 125,0029,0
= 0,232 mol/kg
3.4. La normalité (N)
La normalité, de symbole N, est définie comme le nombre de masse normal ou N telle que : - quotesdbs_dbs1.pdfusesText_1[PDF] fractions eduscol
[PDF] frais agence immobiliere vente century 21
[PDF] frais bancaire bmce
[PDF] frais bancaire credit mutuel etranger
[PDF] frais d inscription fac de droit limoges
[PDF] frais d inscription iut aix en provence
[PDF] frais d inscription iut limoges
[PDF] frais d'agence optimhome
[PDF] frais d'annulation cheque desjardins
[PDF] frais d'inscription lille 1
[PDF] frais d'inscription université aix en provence
[PDF] frais d'inscription université limoges
[PDF] frais de concours uir
[PDF] frais de constitution d'une sarl au maroc
