 ⇒ ρ ρ ρ
⇒ ρ ρ ρ
Exercice 3 - Diagramme binaire eau éthanol. On étudie le diagramme binaire isobare du mélange eau-éthanol établi en fonction des fractions molaires XA et YA
 Diagramme isobare diazote – dioxygène D1 D2 D3 C2 C1
Diagramme isobare diazote – dioxygène D1 D2 D3 C2 C1
Diagramme isobare diazote – dioxygène. Le diagramme d'ébullition du système binaire diazote – dioxygène sous pression atmosphérique. P = 1013 bar est
 Chimie PCSI
Chimie PCSI
Oct 3 2013 Mélange binaire diazote – dioxygène (CCP 2008) ... La distillation de l'air liquide nécessite aussi de connaître le diagramme binaire isobare du ...
 Binaires Centrale texte
Binaires Centrale texte
Diagramme binaire diazote - dioxygène. Le refroidissement de mélanges Tracer le diagramme binaire isobare liquide – vapeur de ce mélange binaire sous une.
 TD Série N°4
TD Série N°4
Exercice N°1 - Mélange binaire dioxygène-diazote volatilité des composés de ce mélange. Exercice 3 - Diagramme binaire eau éthanol. On étudie le diagramme ...
 Diagrammes liquide – vapeur isobare et isotherme pour un mélange
Diagrammes liquide – vapeur isobare et isotherme pour un mélange
Diagramme binaire diazote – dioxygène : corrigé. 1. 0. 0.2000. 0.4000. 0.6000. 0.8000. 70.0. 75.0. 80.0. 85.0. 90.0. 95.0. Fn 1. Fn 2. X(2). T(K). L = V. 4. 4:X
 A Tournez la page S.V.P.
A Tournez la page S.V.P.
Ce processus permet la conversion de l'ion ammonium en diazote gazeux en utilisant l'ion nitrite comme accepteur Représenter l'allure du diagramme binaire ...
 Partie A I- Lazote et loxygène
Partie A I- Lazote et loxygène
Dans ce cadre on envisage de construire le diagramme binaire O2–N2 qui trouve notamment une application pour la séparation de N2 et O2 par distillation de l'
 Concours National Commun dAdmission aux Grandes´Ecoles dIng
Concours National Commun dAdmission aux Grandes´Ecoles dIng
diazote. 1.5 Donner de même les structures de LEWIS ... considérer pour simplifier
 TD DE CHAPITRE III
TD DE CHAPITRE III
Masses molaires (en g·mol-1): O = 16 N = 14. Page 2. EXERCICE 2 : Le diagramme binaire de diazote sont identiques et la solution se comporte donc quasiment ...
 [PDF] Diagramme isobare diazote – dioxygène D1 D2 D3 C2 C1
[PDF] Diagramme isobare diazote – dioxygène D1 D2 D3 C2 C1
Le diagramme d'ébullition du système binaire diazote – dioxygène sous pression atmosphérique P = 1013 bar est représenté sur la figure ci-dessous
 [PDF] Diagramme déquilibre isobare des mélanges de dioxygène et de
[PDF] Diagramme déquilibre isobare des mélanges de dioxygène et de
Diagrammes Binaires Diagramme d'équilibre isobare des mélanges de dioxygène et de diazote Le diagramme d'équilibre isobare sous la pression atmosphérique
 [PDF] Binaires Centrale texte - chimiepce
[PDF] Binaires Centrale texte - chimiepce
Diagrammes liquide – vapeur isobare et isotherme pour un mélange A-B Diagramme binaire isobare eau-benzène Diagramme binaire diazote - dioxygène
 [PDF] Potentiel chimique Diagrammes binaires - Physique-Chimie – BCPST
[PDF] Potentiel chimique Diagrammes binaires - Physique-Chimie – BCPST
3 oct 2013 · Diagrammes binaires 1 Mélange binaire diazote – dioxygène (CCP 2008) Compte tenu des interactions mises en jeu entre les molécules de
 [PDF] Tous les exercices de Chimie MP-PSI-PT - ChercheInfo
[PDF] Tous les exercices de Chimie MP-PSI-PT - ChercheInfo
un système contenant du dihydrogène du diazote et de l'ammoniac à tempé- pur et le diagramme binaire ressemble à la juxtaposition de deux diagrammes
 [PDF] TD Chapitre 3 : Equilibre liquide-vapeur dun mélange binaire P(y2)
[PDF] TD Chapitre 3 : Equilibre liquide-vapeur dun mélange binaire P(y2)
Les mélanges binaires diazote-dioxygène sont des mélanges idéaux Le diagramme binaire isobare des constituants 1 et 2 est donné ci-contre
![[PDF] Diagramme déquilibre isobare des mélanges de dioxygène et de [PDF] Diagramme déquilibre isobare des mélanges de dioxygène et de](https://pdfprof.com/Listes/16/26343-16binaire05.pdf.pdf.jpg)
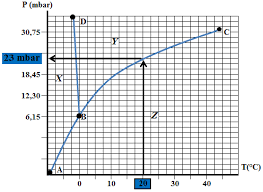
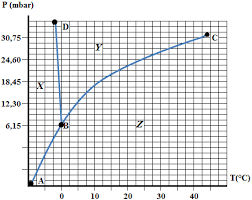
1 Diagrammes Binaires Diagramme d'équilibre isobare des mélanges de dioxygène et de diazote Le diagramme d'équilibre isobare, sous la pression atmosphérique des mélanges de dioxygène et de diazote est représenté La courbe inférieure (L) donne la composition de la phase liquide alors que la courbe supérieure (V) donne la composition de la phase vapeur. 1) Comment s'appellent les courbes (L) et (V) ? 2) Indiquer les domaines de stabilité du liquide et de la vapeur sur un schéma. Applications: liquéfaction de l'air et distillation fractionnée de l'air liquide: On refroidit de l'air sous la pression atmosphérique. En admettant en première approximation que l'air est un mélange binaire de dioxygène et de diazote dans lequel le pourcentage en volume du dioxygène est de 21 %: 3) Quelle sera la température Tl de liquéfaction commençante de l'air ? 4) Quelle sera la fraction molaire en dioxygène de la première goutte de liquide ? 5) En continuant à refroidir l'air, à quelle température l'air sera-t-il totalement liquéfié ? 6) Quelle sera la composition de ce liquide et de la vapeur correspondante ? On laisse maintenant bouillir de l'air liquide dans un vase non clos: 7) Le gaz qui s'échappe sera-t-il plus riche ou moins riche en diazote que l'air ambiant ? Justifier votre réponse. 8) Quelle sera l'influence sur la température d'ébullition du liquide restant ?
2 Distillation d'un vin. Le degré alcoolique d'un vin est le pourcentage volumique d'ethanol. 1) A 20°C, un vin titre 12°, Calculez la fraction molaire en éthanol (C
2 H 5 OH) dans ce vin. Le bouilleur de cru distille certain vin pour obtenir selon leur origine des eaux de vie diverses. Le diagramme binaire éthanol - eau est donné en annexe. 2) Nommez et identifiez les courbes composant ce diagramme 3) Nommez le point A, 4) Comment se comporte le point A lors d'un changement de Pression. 5) Schématisez et annotez le dispositif expérimental "moderne" utilisé pour réaliser cette distillation. 6) Donner la nature des phases recueillis dans le ballon et en tête de colonne 7) Quel titre alcoolique obtient le bouilleur de cru à la sortie de l'alambic? 5 moles d'un mélange de fraction molaire 0,6 en eau est amené à la température de 85°C 8) Donnez la nature et la fraction molaire des phases en présence à cette température. 9) Quelle quantité obtient on de chacune des phases?
3 Extractions des parfums- Les parfums naturels se trouvent notamment chez les plantes (dans les fleurs, les feuilles, les tiges, les fruits...) sous forme d'huiles essentielles: une huile essentielle est un mélange de substances odorantes liquides en général, assez volatiles et très peu solubles dans l'eau. On observe de grandes différences de qualité des essences suivant le procédé d'extraction mis en oeuvre. On va s'intéresser dans cette partie à deux importantes techniques d'extraction de ces huiles essentielles. A ." Distillation à la vapeur d'eau " L'huile essentielle de lavande fine ou de lavandin est obtenue à partir des sommités fleuries des épis par entraînement à la vapeur d'eau, dans des distilleries localisées principalement dans le sud de la France. Le texte suivant propose un protocole à l'échelle du laboratoire: a- Réaliser un montage d'hydrodistillation. b- Introduire dans le ballon 10 grammes de fleurs de lavande, 100 millilitres d'eau et quelques grains de pierre ponce. c.- Chauffer et maintenir l'ébullition pendant 30 minutes: on recueille ainsi 50 millilitres de distillat dont 1 millilitre d'essence. d- Ajouter au distillat 3 grammes de chlorure de sodium; agiter puis transvaser dans une ampoule à décanter. e- Éliminer la phase aqueuse et recueillir l'huile essentielle. f- Ajouter quelques cristaux de sulfate de sodium anhydre; agiter et filtrer: on obtient un liquide limpide, légèrement jaunâtre, de densité 0,9 . Pour simplifier on supposera que l'huile essentielle ne comporte qu'un seul constituant noté A. 1) Tracer l'allure du diagramme binaire isobare liquide -vapeur H2O/A en précisant dans chaque domaine le nombre et la nature des phases en présence. 2) Schématiser par des flèches - sur le diagramme précédent - l'évolution du mélange dans le ballon au cours du chauffage (étape c du protocole). 3) Indiquer la composition du distillat recueilli. 4) Comment appelle-t-on ce système? 5) La quantité d'eau présente dans le milieu réactionnel a-t-elle une importance? Justifier. 6) Faire un schéma du montage d'hydrodistillation en précisant le nom des différents éléments. 7) Quel est le rôle de la pierre ponce? 8) Pourquoi ajoute-t-on du chlorure de sodium au distillat? 9) Quel est le rôle du sulfate de sodium anhydre ? Lorsque l'hydrodistillation donne un produit inutilisable comme c'est le cas pour les fleurs de jasmin, on est amené a envisager une autre technique...
4 B Extraction directe par un solvant organique volatil On réalise l'extraction de ces fleurs par des solvants hydrocarbonés comme 1' hexane; la fraction obtenue (après avoir évaporé le solvant ) est appelée essence concrète. Les plantes étant des constituants fortement aqueux, on va considérer pour simplifier que le constituant A (représentant toujours l'ensemble de l'huile essentielle - cf. paragraphe A) est dissous dans deux solvants non miscibles: l'eau (notée E) et le solvant organique (noté S). 10) Donner l'expression du potentiel chimique de A dans chacune des phases en fonction de son activité dans la phase considérée; on négligera l'influence de la pression sur le potentiel chimique. L'activité de A dans l'eau sera notée (A)E et dans le solvant organique (A)S . 11) Montrer qu'à l'équilibre les activités de A dans les deux phases sont reliées par la relation: A
S A E =k (T)où k(T) est une grandeur qui ne dépend que de la température T et que l'on explicitera. 12) facultatif: Comment appelle-t-on k(T) ? Ce type d'extraction amène la présence de nombreux corps gras dans les essences concrètes; elles sont donc ensuite purifiées par dissolution sélective dans l'alcool: on obtient ainsi les essences absolues. Diagramme binaire Eau - (NH4)2 SO4 On donne les informations suivantes concernant le diagramme binaire Eau - (NH4)2 SO4 : Température en °C 0 -5,45 -11 -18 -19 % massique de (NH4)2 SO4 en Phase liquide 0 16,7 28,6 37,5 38,4 Nature de la phase solide H2O H2O + (NH4)2 SO4 Température en °C 0 20 30 40 50 60 70 80 90 % massique de (NH4)2 SO4 en Phase liquide 41,4 43 43,8 44,8 45,8 46,8 48,8 48,8 49,8 Nature de la phase solide (NH4)2 SO4 1) Tracez le diagramme binaire liquide solide du mélange H2O - (NH4)2SO4, Pour optimiser le schéma, vous pouvez effectuer une " coupure » de l'axe des abscisses aux alentours de 70%. Compte tenue des données, on admettra un tracé partiel de ce diagramme. 2) Indexez les différents domaines. 3) Le diagramme possède un point singulier : Nommez-le et indiquez ses coordonnées. 4) Combien y a -t-il de phases présentes en ce point ? 5) Que se passe t-il si on élève la température d'un solide ayant cette composition ? A 10°C, on dispose de 150g de mélange de composition 18% en (NH4)2 SO4, 6) Quel solide pur peut-on récupérer en refroidissant ce mélange ? 7) Tracez la courbe de refroidissement entre 10°C et -25°C 8) Quelle masse maximale de solide pur peut-on séparer ?
5 Diagramme binaire liquide, solide plomb étain On fournit le diagramme binaire liquide, solide plomb étain. 1 ) Qualifiez ce type de diagramme. 2) La pression a t-elle une influence sur l'allure d'un tel diagramme? 3) Sur la feuille annexe 1 que vous joindrez a votre copie, indiquez le nom des phases des différents domaines. 4) Indiquez les courbes de solidus et liquidus S) Tracez en utilisant la partie droite de l'annexe 1, la courbe de refroidissement obtenue pour l'étain pur le mélange à30% d'étain le mélange eutectique 6) Rappeler la signification étymologique du mot eutectique 7) Commentez ces courbes en indiquant la variance et la nature des phases au cours du refroidissement. On refroidit 750g d'un alliage Plomb - Étain à 30% jusqu'à la température de 220°C. 8) Quelle est la nature (composition) des phases en présence et leurs masses? 0
50100
150
200
250
300
350
0102030405060708090100
T en °C
% massique Sn6 Étude de l'équilibre liquide liquide: phénol - eau. L'allure de la courbe de démixtion isobare du mélange eau - phénol est donnée. On porte l'eau pure à la température TM = 50 °C. On ajoute, à température constante et pression constante, des quantités croissantes de phénol. 1. Que se passe-t-il au point A ? Calculer la valeur de la variance du système correspondant et l'interpréter. 2. Décrire le système représenté par le point M. Exprimer le rapport des quantités de matières n1 et n2 dans chacune des phases en fonction des fractions molaires en phénol xa, xb et xM Une démonstration est exigée. 3. Comment varie la composition du système lorsque l'on passe du point A au point B en ajoutant du phénol à la solution ? 4. On porte l'eau à 70 °C et on effectue la même opération que précédemment. Que se passe-t-il ?
7 Diagramme binaire simplifié Fer- Carbone Les deux variétés allotropiques du fer qui existent sous la pression atmosphérique sont: - pour t < 912 °C, le fer !
(Fe ! ) - pour 912 °C < t < 1538 °C, le fer ! (Fe ! ). Le fer ! cristallise dans un système cubique centré (CC) tandis que le fer !cristallise dans un système cubique à faces centrées (CFC). L'acier est un alliage de fer et de carbone renfermant au maximum 2,1 % de ce dernier élément. Il peut contenir de petites quantités d'autres éléments incorporés, volontairement ou non, au cours de son élaboration. La possibilité d 'attribuer aux aciers une gamme étendue de propriétés grâce à des traitements thermiques, thermomécaniques et mécaniques est à l 'origine du très large éventail d 'utilisations de ce matériau. Le diagramme binaire simplifié Fer - Carbone s'applique à des alliages binaires à faible teneur en carbone. 1) Faire un schéma simplifié du diagramme binaire Fer Carbone et y repérer les "domaines" du fer !
et du fer !. 2) Donner la nature des espèces présentes dans les domaines ABC, ACE1F, FGH, E1FG, CDE1 et HGDI. 3) Comment appelle-t-on les points El et E2 ? Écrire les équations des équilibres existant en El et E2. 4) Un alliage fer carbone liquide contenant 0,6 % de carbone en masse est refroidi jusqu'à 500°C.
8 Ferrite: solution solide de carbone dans le fer !
. Austénite . solution solide de carbone dans le fer !. Perlite: mélange de composition, correspondant au point El. 4.1) Tracer la courbe de refroidissement !
(°C) en fonction du temps en indiquant les espèces en équilibre. 4.2) Lequel des schémas présentés ci-dessus représente la microstructure de cet alliage aux températures suivantes: 1450°C, 1400°C, 730°C et 500°C ? 5) On considère maintenant un acier de composition eutectoïde (!
= 727°C). Quelles sont les phases en présence et leurs proportions à la température de 500°C ? 6) Quelles sont les températures de début et de fin de solidification de cet acier ? 7) Lequel des schémas (proposés ci-dessus) représente la microstructure de cet acier à 1420°C ?
quotesdbs_dbs29.pdfusesText_35[PDF] Mélanges binaires solide-liquide I) Cas de la miscibilité totale ? l 'état
[PDF] TD d 'exercices statistiques et pourcentages - Math93
[PDF] Exemple pour comprendre ce qu 'est un diagramme circulaire
[PDF] chapitres v-vi : diagrammes d 'equilibre (td) - mms2-ensmp
[PDF] Analyse et conception d 'un logiciel de gestion commercial
[PDF] Vers une Solution Intégrée de Gestion de la Scolarité des
[PDF] Conception et développement d un site web de e-commerce pour le
[PDF] COPAG --Taroudant - FST Fes
[PDF] Module Production de produits laitiers
[PDF] Comment se fabriquent les pâtes alimentaires - Animation du CFSI
[PDF] Gestion de projet - diagramme de Gantt - AUNEGE
[PDF] Le diagramme de Gantt
[PDF] 52 représentation de nyquist - Hepia
[PDF] STABILITE : CRITERE DE NYQUIST TDGEII 1 - IUT de Tarbes
