 PREPARATION DUNE LAME HISTOLOGIQUE
PREPARATION DUNE LAME HISTOLOGIQUE
Service d'Histologie & Embryologie. 1ère année de médecine. Année universitaire : 2019/2020. 6 la confection des coupes histologiques comporte alors 3 étapes :.
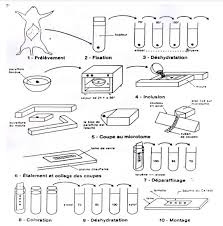 Université Frères Mentouri Constantine 1 1ère année LMD / TC / SNV
Université Frères Mentouri Constantine 1 1ère année LMD / TC / SNV
Pour l'étude histologique classique la préparation des coupes fines se fait en plusieurs étapes : TD N°2 : Techniques de préparation des coupes histologiques ...
 Aperçu des principales colorations histologiques et intérêt pour le
Aperçu des principales colorations histologiques et intérêt pour le
→ Les colorations réalisées sur lames accentuent les contrastes pour pouvoir reconnaître différents éléments du tissu. Page 5. LES ETAPES DE LA COLORATION. -
 Les techniques de préparation des coupes pour les microscopies
Les techniques de préparation des coupes pour les microscopies
Le plus souvent le matériel histologique (= cellules contenues dans un tissu) est fixé
 Protocole de détermination des structures histologiques dovaires et
Protocole de détermination des structures histologiques dovaires et
4 juil. 2019 Protocole de détermination des structures histologiques d'ovaires de la plie ... Préparation des lames histologiques ...
 Protocole n°82 Coloration de May–Grünwald Giemsa pour coupes
Protocole n°82 Coloration de May–Grünwald Giemsa pour coupes
25 mai 2016 pour coupes histologiques. Principe : La coloration selon Pappenheim fait agir successivement deux colorants neutres : le May-Grünwald et le ...
 Fiche 1 : Les méthodes dobservation
Fiche 1 : Les méthodes dobservation
Ces deux contraintes identifiées la préparation des coupes histologiques se fait en plusieurs étapes avant l'observation au microscope optique. 1/ La
 LIMAGERIE POST MORTEM TRIDIMENSIONNELLE CEREBRALE
LIMAGERIE POST MORTEM TRIDIMENSIONNELLE CEREBRALE
17 nov. 2008 Sur les coupes avec une coloration spéciale marquant les ... le protocole du chapitre 3 dans lequel elle remplace la coupe histologique marquée.
 Contribution a letude dagents pathogenes de lhuitre creuse
Contribution a letude dagents pathogenes de lhuitre creuse
7 mars 2018 Coloration Hémalun/Eosine. Grossissement X. 800. 1. Fig. n° 2 : Lésions histologiques observées sur coupes de branchies d' ...
 FICHE TECHNIQUE TP HISTOLOGIE - PREPARATION DUNE
FICHE TECHNIQUE TP HISTOLOGIE - PREPARATION DUNE
prélevée est rigide en présence de paraffine solide dans l'espace intracellulaire de chaque cellule composant le tissu. OU. 7. Confection des coupes
 TP 7 Histologie Les techniques de MO et de ME sont utilisées en
TP 7 Histologie Les techniques de MO et de ME sont utilisées en
diverses (préparation des échantillons) que l'on applique au matériel. L'inclusion a pour but de permettre la réalisation de coupes fines et régulières.
 MODULE 1 – Introduction Comment préparer un prélèvement de
MODULE 1 – Introduction Comment préparer un prélèvement de
comment les tissus biologiques sont traités pour préparer les lames histologiques qui seront observées sous le microscope. Nous voici dans le laboratoire de
 Aperçu des principales colorations histologiques et intérêt pour le
Aperçu des principales colorations histologiques et intérêt pour le
L'inclusion a pour but la réalisation de coupes histologiques. Le milieu d'inclusion le plus utilisé est la paraffine. Comme la paraffine est hydrophobe le.
 Université Frères Mentouri Constantine 1 1ère année LMD / TC / SNV
Université Frères Mentouri Constantine 1 1ère année LMD / TC / SNV
1- Préparation des coupes pour observation au microscope optique. Pour l'étude histologique classique la préparation des coupes fines se fait en plusieurs
 Préparation des tissus : information générale
Préparation des tissus : information générale
1- Préparation et mise en cassette des prélèvements a. Le tissu est acheminé au laboratoire dans un fixateur standard (Formaline. 10% tamponnée). b. La coupe
 Protocole n°82 Coloration de May–Grünwald Giemsa pour coupes
Protocole n°82 Coloration de May–Grünwald Giemsa pour coupes
25 mai 2016 Protocole n°82. Coloration de May–Grünwald Giemsa pour coupes histologiques. Principe : La coloration selon Pappenheim fait agir ...
 HISTOLOGIE
HISTOLOGIE
Figure 1.2 Préparation des coupes histologiques en paraffine. 2.1.4 Coloration. L'observation des coupes directement après leur confection
 Guide sur lassurance qualité en anatomopathologie - Phases pré
Guide sur lassurance qualité en anatomopathologie - Phases pré
lames) que l'analyse et les composantes post-analytiques en histologie (entreposage du au laboratoire de pathologie où une préparation particulière ...
 Réalisation dune coupe de racines et schéma dhistologie végétale
Réalisation dune coupe de racines et schéma dhistologie végétale
préparations histologiques de racines jeunes. ? Réalisation d'une coupe de racines coloration au carmin-vert d'iode : protocole. • Réaliser des coupes
 Chapitre II : Méthodes d’étude de la cellule TD N°2
Chapitre II : Méthodes d’étude de la cellule TD N°2
1- Préparation des coupes pour observation au microscope optique Pour l’étude histologique classique la préparation des coupes fines se fait en plusieurs étapes : a) Prélèvement Le prélèvement effectué sur un organe doit se faire aussi délicatement que possible afin de ne pas meurtrir les tissus
 Les colorations histologiques - Université Paris-Saclay
Les colorations histologiques - Université Paris-Saclay
Les coupes du bloc de paraffine sont réalisées avec un microtome permettant d’obtenir des sections (coupes histologiques) de 3 à 5 microns d’épaisseur Les coupes sont recueillies sur des lames de verre et mises à sécher (sur la nuit à 40-45°C ou 1H max 60°C) - La plupart des tissus sont transparents
 FICHE TECHNIQUE TP HISTOLOGIE PREPARATION D’UNE LAME
FICHE TECHNIQUE TP HISTOLOGIE PREPARATION D’UNE LAME
la confection des coupes histologiques comporte alors 3 étapes : - L’étalement : de segments de ruban de paraffine sur une lame de verre contenant un liquide d’étalement tel que l’eau albumineuse - Le collage: les lames de verre sont placées sur une plaque chauffante réglée à une température de 40°C pendant 15 min
Comment faire une coupe histologique ?
La préparation d’une coupe histologique consiste à réaliser des sections, c’est-à-dire des tranches très fines de tissus destinés à être observés par transparence au microscope. Les coupes à congélation présentent certains avantages que la technique en paraffine n’offre pas : la congélation permet une conservation optimale de l’ADN et de l’ARN.
Comment faire des coupes fines dans un tissu biologique ?
Le but est d’éliminer l’eau des tissus et de la remplacer par un milieu qui se solidifie pour permettre la réalisation de coupes fines (4 à 5µm). Pour cela, le tissu biologique doit être inclus dans une matrice dure (paraffine). Les principales étapes de ce processus sont la déshydratation, la clarification et l’imprégnation. Déshydratation
Quelle est la différence entre les colorations spéciales et les histochimiques?
Les colorations spéciales sont réalisées pour préciser des structures ou substances suspectées par le pathologiste lors de son analyse initiale sur les coupes de technique standard. Les techniques histochimiques sont basées sur des réactions biochimiques qui permettent de mettre en évidence
Comment faire des coupes de tissu?
Les coupes sont recueillies sur des lames de verre et mises à sécher (sur la nuit à 40-45°C ou 1H max 60°C). - La plupart des tissus sont transparents ?Les colorationsréalisées sur lames, accentuent les contrastes pour pouvoir reconnaîtredifférents éléments du tissu. LES ETAPES DE LA COLORATION -Déparaffinage (toluène / xylène - éthanol)
BTSA 1 M55
Ph.A biotechnologies.education page 1
TP 7 Histologie
Les techniques de MO et de ME sont utilisées en routine pour visualiser les structures. Avec les conseils de Madame Julien. Anatomopathologie . 26000 ValencePour rendre visible ce que l'on veut observer, il est nécessaire de mettre en oeuvre des techniques
diverses (préparation des échantillons) que l'on applique au matériel. Pour l'observation en MO
ou en ME, les coupes examinées sont le fruit de procédures techniques qui requièrent plusieurs
étapes successives : fixation, inclusion, coupe, coloration, montage. I Pour la MO : fixation au formol, inclusion en paraffine, colorations standard (hématoxyline-éosine ou HES ou trichrome) La fixation a pour but la conservation des structures et le durcissement des pièces. Elle doit se faire immédiatement après le prélèvement, par immersion du matériel dans un grand volume de liquide fixateur. Les liquides fixateurs les plus utilisés sont le formol ou le liquide de Bouin (mélange de formol et d'acide picrique). La durée de la fixation varie selon le volume des prélèvements (de quelques heures pour un petit fragment biopsique à plusieurs semaines pour un cerveau humain entier). L'inclusion a pour but de permettre la réalisation de coupes fines et régulières. Le milieu d'inclusion le plus utilisé est la paraffine. Comme la paraffine est hydrophobe, le prélèvement doit d'abord subir une déshydratation (par immersion dans des bains d'alcool de degré croissant puis dans des bains de toluène) avant d'être coulé dans un moule contenant de la paraffine fondue par chauffage et devenue liquide, qui infiltre alors toute la pièce. Après refroidissement, on se trouve en présence d'un bloc de paraffine, dur, à l'intérieur duquel la pièce prélevée est incluse. Dans certains cas, on utilise d'autres milieux d'inclusion (celloïdine, résines plastiques, etc.). Les coupes du bloc de paraffine sont faites avec un microtome permettant de réaliser des tranches de section (coupes) de 2 à 5 µm d'épaisseur. Les coupes sont recueillies sur des lames de verre.BTSA 1 M55
Ph.A biotechnologies.education page 2
Les colorations réalisées sur lames, accentuent les contrastes pour mieux reconnaître les différents éléments de la préparation. Comme les colorants sont en solution aqueuse, lescoupes doivent d'abord subir une réhydratation. Celle-ci est effectuée après déparaffinage
des coupes (par la chaleur et des bains de toluène) en immergeant les lames dans desbains d'alcool de degré décroissant puis dans l'eau distillée. Les colorations les plus
fréquemment utilisées associent deux ou trois colorants différents : l'Hématoxyline-
Eosine (H.E.) associe l'hématéine qui colore les noyaux en violet et l'éosine les
cytoplasmes en rose ; les colorations trichromiques usuelles sont l'Hématéine-Eosine-Safran (H.E.S.) par ajout de safran colorant en jaune les fibres de collagène, et le
trichrome de Masson qui associe un colorant nucléaire (hématoxyline), un colorant cytoplasmique et un colorant bleu ou vert colorant les fibres de collagène. De nombreuses colorations spéciales (dites signalétiques) permettent de visualiser différentes structures ou composants des tissus (par exemple, les fibres de réticuline par des colorations argentiques ou les fibres élastiques par l'orcéine). Le montage. Après avoir subi une déshydratation (par bains d'alcool de degré croissant puis bains de toluène), les coupes colorées sont montées entre lame et lamelle avec unerésine synthétique dont l'indice de réfraction est voisin de celui du verre. On dispose alors
d'une " préparation microscopique » (simplement appelée " lame » dans le langage courant) prête à être observée au MO. Remarque :Pour la ME : fixation à la glutaraldéhyde, post- fixation à l'acide osmique, inclusion en épon, contraste par l'acétate d'uranyle et le citrate de plomb La technique dite " standard » de ME est analogue dans ses principes à celle de MO, mais les modalités précises diffèrent. La fixation se fait habituellement dans de la glutaraldéhyde tamponnée et est suivie d'une post-fixation à l'acide osmique. L'inclusion se fait dans une résine synthétique type Epon ou Araldite, après que les fragments ont été déshydratés dans les alcools et dans l'oxyde de propylène. Les coupes ultrafines des blocs sont réalisées grâce à un ultramicrotome qui permet d'obtenir des coupes ultrafines d'environ 80 nm d'épaisseur. Les coupes sont recueillies sur des grilles de cuivre. Avec le même ultramicrotome, on peut faire des coupes semi- fines, observables en MO et permettant de guider le choix des zones à étudier en ME. Le contraste des coupes s'effectue habituellement avec de l'acétate d'uranyle (contrastant les nucléoprotéines : noyau, nucléole, ribosomes) et des sels de plomb comme le citrate de plomb (contrastant les membranes).BTSA 1 M55
Ph.A biotechnologies.education page 3
II Technique de préparation des échantillons1 Fixation
Mettre la pièce anatomique dans un bain de formol à 10% entre 24h et 48h. (il est préférable de la
laisser 48h).Il faut veiller à préparer un bain qui représente 10 fois la masse de la pièce à fixer.
Remarque : Formol à 10% en sachant que les solutions du commerce sont à 30%Prélever un à étudier. Le positionner
2 Préparation avant inclusion : La déshydratation
sachant que la paraffine est très hydrophobe.Alcool 70° 85° 90° 100°
Temps 10 min 30 min 45 min 1h30
Ensuite mettre dans 3 bains successifs de safsolvent de concentration identique pour laver safsolvent 15 min 30 min 45 minMettre dans de la paraffine liquide pour laver les excès de solvant. Pour cela on utilise une étuve
entre 56°C et 60 °C pour garder la paraffine liquide.Paraffine liquide 1h 1h 1h
Le dernier bain peut durer 1 nuit ffectuer, le lendemain, la coupe avec les étudiants3 Inclusion/ enrobage
Dans un moule métallique ou jeta à 56°C.
Mettre au fond quelques gouttes de paraffine liquide (Les pinces doivent être chaude pour faciliter cette opération.. Utiliser le bec bunsen).Mettre
Rajouter de la paraffine liquide
La cassette, puis de nouveau de la paraffine liquide (bain glacé) pour faciliter le démoulage.BTSA 1 M55
Ph.A biotechnologies.education page 4
4 Coupe histologique
le microtome o reculer le porte objet au maximum o placer le bloc dans le porte objet sans le fixer o placer le rasoir face gravée vers l'extérieur : e fixer (face à couper dans un plan vertical, parallèle au fil du rasoir, les deux arêtes du bloc les plus longues horizontalement o dégrossir à la main o régler l'épaisseur des coupes (5 microns) o mettre le cliquet o couperDIFFICULTES
o Les coupes ne se font pas vérifier le cliquet, l'inclinaison du rasoir, la fixation du porte objet o coupes striées essuyer le rasoir ou le déplacer o coupes irrégulières vérifier la fixation du rasoir et du porte-objet La cire doit être assez froide, pour obtenir un ruban. =>Mettre le bloc de paraffine au congélateur si besoin ou utiliser une bombe cryolab qui refroidit la surface de la cire.BTSA 1 M55
Ph.A biotechnologies.education page 5
5 Fixation de la coupe sur la lame
Sur une plaque chauffante maintenant une température de 50 °C.On place une lame sur laquelle on dépose une solution eau distillée albuminé à 1% en veillant à
faire un bien glisser sur la lame. stick on On dépose alors la coupe histologique sur la lame.On égoutte la lame , en renversan.
On place la lame droite pour bien faire sécher. Par exemple sur un sopalin. Puis on place la lame dans une étuve à 56°C pendant 1 h.Cela perm
coupe sur la lame. - une épaisseur constante. - pas de pli, pas de bulle - pas de détérioration de la coupe - pour que laBTSA 1 M55
Ph.A biotechnologies.education page 6
6 Déparaffinage
Puis il est né en veillant à ne pas enlever la coupe de la lame) Par passage de la lame dans 2 bains de toluène. (en veillant à la propreté du dernier bain) safsolvent 2 min 2 minAlcool 100° 80° 50°
Temps 2 min 2 min 2 min
On place la lame dans un bain du robinet pendant quelques secondes. On place la lame dans un bain e pendant quelques secondes7 Coloration à HE
Bain à 5 min
Rinçage eau du robinet 3 min
Rinçage eau distillée passage
Bain à r le cytoplasme en rose 3 minutes
Rinçage eau distillée passage
1 min 1 minLaisser tremper la lame dans le ---------
plusieurs semaines dans le toluène.BTSA 1 M55
Ph.A biotechnologies.education page 7
8 Montage
On place une goutte de safemont
soigneusement avec une pince.Critères de réussite .
Pas de pli sur la lame.
Pas de bulle au montage.
Bon contraste au niveau des noyaux.
Coupe complète de la pièce de l.
Epaisseur régulière dans la coupe
quotesdbs_dbs44.pdfusesText_44[PDF] fixation au formol
[PDF] inclusion en paraffine définition
[PDF] technique de préparation des coupes histologiques
[PDF] coupe paraffine
[PDF] coupe au microtome
[PDF] huile de paraffine
[PDF] argumenter un texte seconde
[PDF] graphique proportionnel
[PDF] coefficient de proportionnalité
[PDF] exemple de situation de proportionnalité
[PDF] exemple de proportionnalité dans la vie courante
[PDF] exemple de non proportionnalité
[PDF] réponse négative candidature spontanée
[PDF] navigateur portugais du xv siecle 3 lettres
