 Étude dune réaction : titrage des ions fer II par les ions permanganate
Étude dune réaction : titrage des ions fer II par les ions permanganate
Étude d'une réaction : titrage des ions fer II par les ions permanganate. I – Généralités sur les titrages. 1) Objectif d'un titrage. Il permet à l
 LES RÉACTIONS DOXYDORÉDUCTION DANS LES TITRAGES
LES RÉACTIONS DOXYDORÉDUCTION DANS LES TITRAGES
Le réactif titré est l'ion fer (II) et le réactif titrant est l'ion permanganate. 13. L'équation de la réaction support de ce titrage est : MnO4. —(aq) + 8H+
 Titrage des ions fer II
Titrage des ions fer II
Il a fallu verser un volume VBéq de la solution de permanganate de potassium de concentration cB pour atteindre l'équivalence. Quelle est la relation entre cA
 Détermination dune quantité de matière Fiche
Détermination dune quantité de matière Fiche
On ajoute progressivement une solution d'ions permanganate (solution titrante) à une solution d'ions fer (II) (solution titrée) en milieu acide. Le volume
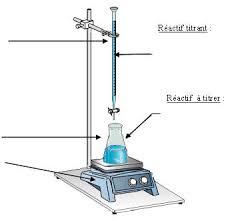 TP- Dosage des ions Fer II dans un produit anti- mousse
TP- Dosage des ions Fer II dans un produit anti- mousse
Alors que l'on ajoute de la solution aqueuse de permanganate de potassium de couleur violette dans le tube la le mélange reste incolore. Q2-2 : Une réaction
 Dosage du fer ferreux La manganimétrie est une technique
Dosage du fer ferreux La manganimétrie est une technique
Dosage du fer (II) en solution aqueuse. On utilisera Ecrire l'équation chimique de la réaction entre les ions Fe (II) et les ions permanganate en milieu.
 TP N° 03 : DOSAGE DES IONS FER (II) PAR COLORIMETRIE
TP N° 03 : DOSAGE DES IONS FER (II) PAR COLORIMETRIE
Mettre en marche l'agitation (pas trop forte !). • On effectue un premier titrage rapide verser mL par mL la solution de permanganate de potassium. • Arrêter
 TP- Dosage des ions Fer (II) dans un produit anti-mousse
TP- Dosage des ions Fer (II) dans un produit anti-mousse
ions fer (II) Fe2+ et les ions permanganate. MnO4. -. Cette réaction servira ensuite de réaction support au dosage. Expérience n°1 : - Dans un tube à essais ...
 Dosage potentiométrique
Dosage potentiométrique
DOC3 : Courbe théorique du dosage des ions permanganate par les ions fer II. Etudions l'exemple du dosage des ions fer Fe2+ par les ions permanganate MnO4. -.
 Untitled
Untitled
5.2: dosage du Fe(II) par le permanganate. 1. 1. 1. Page 3. RIENCES. 5 fer(II) sont en partie oxydés par les ions nitrates. 4) Pourquoi le permanganate dans ...
 Étude dune réaction : titrage des ions fer II par les ions permanganate
Étude dune réaction : titrage des ions fer II par les ions permanganate
Étude d'une réaction : titrage des ions fer II par les ions permanganate. I – Généralités sur les titrages. 1) Objectif d'un titrage.
 TP 13 DOSAGE des IONS FER (II) contenus dans le SEL de MOHR
TP 13 DOSAGE des IONS FER (II) contenus dans le SEL de MOHR
une solution aqueuse de concentration connue en ion fer (II) dosage des ions. 2+. (aq). Fe de S1 par une solution acidifiée de permanganate de potassium.
 Compte rendu du TP de chimie n°9 Les dosages rédox
Compte rendu du TP de chimie n°9 Les dosages rédox
II) Dosages des ions Fe2+ réagir avec un oxydant tel l'ion permanganate MnO4 ... d'hydroxyde de fer (II) en présence d'ions fer (II) Fe2+. (aq) selon.
 LES RÉACTIONS DOXYDORÉDUCTION DANS LES TITRAGES
LES RÉACTIONS DOXYDORÉDUCTION DANS LES TITRAGES
Partie A : L'ion permanganate un bon oxydant. L'ion permanganate est un bon tion d'oxydoréduction entre le fer et le dioxygène dissout dans l'eau.
 Titrage des ions fer II
Titrage des ions fer II
Il a fallu verser un volume VBéq de la solution de permanganate de potassium de concentration cB pour atteindre l'équivalence. Quelle est la relation entre cA
 TP- Dosage des ions Fer (II) dans un produit anti-mousse
TP- Dosage des ions Fer (II) dans un produit anti-mousse
Cette partie permet d'étudier la réaction entre les ions fer (II) Fe2+ et les ions permanganate. MnO4. -. Cette réaction servira ensuite de réaction support
 TP- Dosage des ions Fer II dans un produit anti- mousse
TP- Dosage des ions Fer II dans un produit anti- mousse
Q2-2 : Une réaction chimique a-t-elle eu lieu ? Si oui quel réactif pouvez-vous déjà identifier ? L'expérience 2 prouve que les ions permanganate
 TP14 – Titrages avec suivi potentiométrique
TP14 – Titrages avec suivi potentiométrique
Titrage par précipitation des ions chlorure par les ions argent(I) : Titrage redox des ions fer(II) par les ions permanganate :.
 Loxalate de fer (II)
Loxalate de fer (II)
I. Dosage des ions fer (II) et des ions oxalate dans le complexe Fe2+ seuls à l'aide d'une solution de permanganate de potassium et de poudre de zinc.
 Ex 3 Constante déquilibre On considère la réaction entre les ions
Ex 3 Constante déquilibre On considère la réaction entre les ions
On considère la réaction entre les ions permanganate et les ions fer II. Données : potentiels standards à 298 K. ? couple MnO?. 4(aq)/Mn2+ : E0.

TP C5 1Spé
systèmeTitrage des ions fer II
Un jardinier amateur remarque une carence en fer sur certains de ces végétaux. Il retrouve au fond de
son placard un vieux produit antichlorose et encore utiliser. Pour cela il décide antichlorose.Document 2 : produit antichlorose
antichlorose Truffaut® on peut lire : Cet engrais concentré soluble contribue à corriger les carences des plantes, notamment les chloroses ferriques.Il contient 3,3% en masse de fer
Pulvérisation sur les feuilles arrosage du solDocument 1 : La chlorose des plantes
La chlorose des végétaux est une décoloration plus ou moins prononcée des feuilles, due à un manque de chlorophylle qui permet la photosynthèse et qui donne aux feuilles leur couleur verte. Le manque de chlorophylle peut provenir d'une insuffisance en magnésium,en fer, en azote, en manganèse ou en zinc, autant d'éléments chimiques indispensables à la
synthèse de la chlorophylle.La décoloration, dans le cas de la carence en fer, va du vert pâle au blanc-jaunâtre, en fonction de la
Document 3 : Pourcentage en masse
la masse de la substance considérée pour 100 g de solution.Document 4 : Titrage
Titrer une solution, c'est déterminer la concentration (en masse ou en quantité) d'une
espèce chimique A qu'elle contient. Pour cela, on utilise une réaction chimique entre l'espèce A (solution titrée) et une autre espèce chimique B (solution titrante). aA +bB cC + d DPour pouvoir effectuer un titrage :
- il faut que la réaction entre A et B soit la seule réaction qui ait lieu, - il faut que cette réaction soit rapide, - il faut que cette réaction soit totale. Lorsque l'espèce A aura totalement réagi avec l'espèce B versée, on dira qu'on a atteint l'équivalence. Cela signifie que l'on aura versé une quantité de matière nB respectant exactement les ométriques données par l'équation de la réaction entre A et B. ABnn abI. Étude préliminaire :
(qui contient des ions fer II : Fe2+) par une solution de permanganate de potassium (K+ + MnO4-). La transformation chimique se fera en milieu acide. Prélever dans un bécher environ 20 mL de la solution à titrer (solution A = solution Prélever dans un autre bécher environ 30 mL de la solution B (solution de permanganate de potassium). Prélever dans un petit bécher, un peu d'acide sulfurique. Prendre trois tubes à essais numérotés , et . caractérisation). Tube à essais Tube à essais Tube à essaisSolution A 2 cm3 2 cm3 2 cm3
Acide sulfurique quelques gouttes Solution B goutte à goutte 1,5 cm3 2,5 cm3Observations
Ion oxydé / Ion réduit
Données: Couples Ox / Réd
MnO4 (aq) / Mn2+ (aq) MnO4 (aq) coloration violette / Mn2+(aq) incoloreMnO4 (aq) / MnO2 (s) MnO2 solide brun
Fe3+ (aq) / Fe2+ (aq)
Sans attendre, nettoyer les 3 tubes à essais et réaliser le titrage. Q1. En utilisant vos observations effectuées avec les tubes 1 et 2: - écrire la demi-équation de l'oxydation en jeu dans la réaction utilisée. - écrire la demi-équation de réduction en jeu dans la réaction utilisée. Q2. En déduire l'équation chimique de la réaction de titrage.Q3. À l'équivalence, quelle relation existe-t-il entre la quantité de matière d'ions permanganate versée et
la quantité de matière d'ions fer (II) initialement présente dans le bécher.Q4. La concentration en ions fer (II) est notée cA , le volume de solution titrée est noté VA.
Il a fallu verser un volume VBéq de la solution de permanganate de potassium de concentration cB pour
atteindre l'équivalence. Quelle est la relation entre cA ,VA , cB et VBéq pour ce titrage? Justifier.II. Titrage :
Effectuer le titrage et revenir aux questions Q1- Q4On donne cB = 1,0×10-2 mol.L-1
Q5. Noter la valeur du volume équivalent et calculer la concentration enQ6. Le produit antichlorose est-il utilisable ?
Document 5 :
On rince la burette avec quelques mL de
solution de permanganate de potassium (utiliser un entonnoir propre). On remplit la burette jusqu'à la graduation zéro. S'assurer qu'il n'y a pas de bulles d'air dans la burette. À l'aide d'une pipette jaugée, on préleve10,0 mL de la solution et les verser dans un erlenmeyer.
À l'aide d'une éprouvette graduée, on ajoute 5 mL d'acide sulfuriqueOn met en marche l'agitation (après avoir
ajouté le turbulent).On effectue un premier titrage rapide, en
versant mL par mL la solution de permanganate de potassium. On effectue ensuite un deuxième titrage plus précis. solution contenant l'espèce B à la concentration cB connueVA (mL) de
solution contenant l'espèce A à la concentration cA inconnue _ C l p A r _ G aquotesdbs_dbs29.pdfusesText_35[PDF] Bac S Nouvelle Calédonie Novembre 2016 http://labolyceeorg
[PDF] Triglycéride, cholestérol total, HDLC et LDLC - Laboratoire Eylau
[PDF] DOSAGE DE LA VITAMINE C PAR LE DCPIP
[PDF] DOSAGE DE LA VITAMINE C CONTENUE DANS UN JUS DE FRUIT
[PDF] Dose létale doliprane
[PDF] Pourquoi il nous faut notre dose quotidienne de vitamine C ?
[PDF] Page 1 ANNEXE M2a Opérations de mutation sur poste profilé (PPr
[PDF] Dossier administratif
[PDF] Bonjour, Ce dossier de ACRC est mis ? libre disposition - My BTS
[PDF] MINISTERE DES FINANCES CONSEIL NATIONAL DE LA - cn-cncc
[PDF] Arts appliques
[PDF] dossier de terminale de bac pro - Lyon
[PDF] Demande d 'indemnité de chômage - Espace-Emploi
[PDF] AE L1 duplicata de dossier d 'inscription - La préfecture de Police
