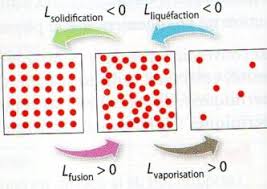
Masse et volume lors dun changement détat
Masse et volume lors dun changement détat
Lorsque l'on refroidit un corps pur on lui retire de l'énergie. La température diminue jusqu'à un palier : c'est la solidification
 Chapitre 7-Changement d état des corps purs. Cas particulier de l
Chapitre 7-Changement d état des corps purs. Cas particulier de l
fusion solidification sublimation condensation. Page 2. 2 paramètres influencent l'état du corps pur : la température T et la pression p. On analysera donc un
 CHAPITRE 1 LES CORPS PURS
CHAPITRE 1 LES CORPS PURS
À pression constante le changement d'état d'un corps pour s'effectue toujours à température constante. Ainsi sous la pression atmosphérique
 Thermodynamique - Changement détat du corps pur
Thermodynamique - Changement détat du corps pur
La réunion courbe d'ébullition et courbe de rosée s'appelle courbe de saturation. 1.4.3 Théor`eme des moments. `A une température donnée et une pression donnée
 FICHE METHODE 3 méthodes pour identifier un corps pur
FICHE METHODE 3 méthodes pour identifier un corps pur
Les changements d'état d'un corps pur s'effectuent à des températures constantes qui le caractérisent. Exemple: Fusion. T=.0. °C. Glaçon. Vaporisation.
 5e – 11 – Changements détats – Support élève
5e – 11 – Changements détats – Support élève
On fait effectuer aux élèves des expériences de solidification puis de fusion de l'eau pure. Page 3. Température (°C). Temps (min). Palier à 100 °
 Chapitre 12 :Changement détat du corps pur
Chapitre 12 :Changement détat du corps pur
: pression maximale d'une phase vapeur et minimale d'une phase liquide à la température T. Page 5. Chapitre 12 : Changement d'état du corps pur. Thermodynamique.
 Physique Chimie 2de Bac Pro
Physique Chimie 2de Bac Pro
Un corps pur change d'état physique à température constante. Cette température a la même valeur pour les changements réciproques. Exemple. La température de
 Objectifs
Objectifs
– Etat solide : état compact et ordonné. • Changement d'état : À pression constante le changement d'état d'un corps pur s'effectue toujours à température
 Masse et volume lors dun changement détat
Masse et volume lors dun changement détat
La température diminue jusqu'à un palier : c'est la solidification puis elle diminue à nouveau. Lorsqu'on chauffe un corps pur
 Thermodynamique - Changement détat du corps pur
Thermodynamique - Changement détat du corps pur
La réunion courbe d'ébullition et courbe de rosée s'appelle courbe de saturation. 1.4.3 Théor`eme des moments. `A une température donnée et une pression donnée
 Chapitre 12 :Changement détat du corps pur
Chapitre 12 :Changement détat du corps pur
: pression maximale d'une phase vapeur et minimale d'une phase liquide à la température T. Page 5. Chapitre 12 : Changement d'état du corps pur. Thermodynamique.
 Physique Chimie 2de Bac Pro
Physique Chimie 2de Bac Pro
Un changement d'état s'effectue à température constante pour un corps pur. Activité expérimentale 1 : Le changement d'état une transformation physique p.
 Chapitre 7-Changement d état des corps purs. Cas particulier de l
Chapitre 7-Changement d état des corps purs. Cas particulier de l
fusion solidification sublimation condensation. Page 2. 2 paramètres influencent l'état du corps pur : la température T et la pression p. On analysera donc un
 1 Les corps purs
1 Les corps purs
Changements d'état. Un corps pur peut se trouver sous trois états : solide liquide ou gazeux. Cela dépend de sa température et de sa pression.
 Changements détat du corps pur
Changements détat du corps pur
À une température et une pression données un corps pur existe généralement sous une seule phase physique. Sur un diagramme en coordonnées (T
 ATS Chapitre 5 : Changements détat du corps pur
ATS Chapitre 5 : Changements détat du corps pur
Par exemple si l'on étudie la vaporisation à la température T d'un corps pur
 Bilan les changements détats I / Leau se transforme: Etat SOLIDE
Bilan les changements détats I / Leau se transforme: Etat SOLIDE
Lorsqu'on chauffe (refroidit) un corps pur on lui apporte (retire) de Tous les corps purs ont des températures de changement d'état déterminées.
 Chapitre 13- Cohésion des solides
Chapitre 13- Cohésion des solides
Changements d'état : Activité 1 p 188 : Corps purs et mélanges. 1. a. Tracer la courbe donnant l'évolution de la température de l'eau distillée en fonction
 [PDF] Chapitre 12 :Changement détat du corps pur - Melusine
[PDF] Chapitre 12 :Changement détat du corps pur - Melusine
Chapitre 12 : Changement d'état du corps pur Thermodynamique Page 5 sur 9 B) Pression de vapeur saturante pour l'eau Température d'ébullition Téb du
 [PDF] MPSI - Thermodynamique - Changement détat du corps pur - Unisciel
[PDF] MPSI - Thermodynamique - Changement détat du corps pur - Unisciel
Nous nous intéressons dans ce chapitre aux propriétés thermo d'un corps pur sous deux phases On parle indifféremment de transition de phase ou de changement d'
 [PDF] Chapitre 7-Changement d état des corps purs Cas particulier de l
[PDF] Chapitre 7-Changement d état des corps purs Cas particulier de l
Lorsqu'un corps pur évolue d'un état d'équilibre à un autre on assiste dans certaines conditions à une modification importante et soudaine de ces
 [PDF] Chapitre 29 : Changements détat du corps pur
[PDF] Chapitre 29 : Changements détat du corps pur
CHAPITRE 29 Changements d'état du corps pur Qu'observe-t-on ? L'évolution de la température au cours du temps est donnée ci-contre Qu'en déduit-on ?
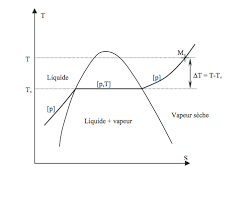
 [PDF] ATS Chapitre 5 : Changements détat du corps pur - TSI Ljfhtml
[PDF] ATS Chapitre 5 : Changements détat du corps pur - TSI Ljfhtml
Si pour cette même température T : • P < PSat(T) le point M est en-dessous de la courbe et la vapeur est dite sèche (tout le corps pur à l'état gaz) • P =
 [PDF] Changement détat dun corps pur - LJM BEZIERS - STI
[PDF] Changement détat dun corps pur - LJM BEZIERS - STI
Il suffit pour cela de placer le corps pur dans une enceinte thermostatée `a la température T puis de le comprimer de mani`ere quasi sta- tique 1 4 2 Courbe
 [PDF] Changements détat du corps pur
[PDF] Changements détat du corps pur
Dans la plupart des composés à la température de changement d'état le solide est plus dense que le liquide soit Vm liq > Vm sol La pente de la courbe de
 [PDF] Th3 - Changement de phase dun corps pur I Quelques définitions
[PDF] Th3 - Changement de phase dun corps pur I Quelques définitions
La pression d'équilibre dépend de la température On relève deux points particuliers : – T point triple : point où coexistent les trois phases Pour un corps
 [PDF] Cours Page 1 Tous les corps purs changent détat à températ
[PDF] Cours Page 1 Tous les corps purs changent détat à températ
Cette température permet d'identifier le corps pur La température de fusion tF et de solidification tS de l'eau pure sont : tF = tS = 0°C
 [PDF] Thermodynamique Le corps pur sous plusieurs phases
[PDF] Thermodynamique Le corps pur sous plusieurs phases
Lorsqu'un corps passe de la phase x à la phase y à température T = T0 et pression P = P0 constante sa variation d'entropie massique vaut : ?s12 = ?12(T0) T0
Quelle est la température de changement d'état d'un corps pur ?
À pression donnée, les changements d'état des corps purs se font à des températures fixes. À pression normale : La solidification et la fusion de l'eau pure ont lieu à 0 °C. La vaporisation et la liquéfaction de l'eau pure ont lieu à 100 °C.Comment à lieu le changement d'état pour un corps pur ?
Les changements d'états des corps purs (solidification, fusion, ébullition) se font à température constante. Cette température est une caractéristique propre à chaque corps pur. Deux corps purs différents ont des températures de fusion, de solidification et d'ébullition différentes.Comment mesurer une température de changement d'état ?
On place un tube à essais, contenant de l'eau distillée, dans un mélange réfrigérant. On observe le contenu du tube, et on relève la température toutes les minutes. Observations : L'eau commence à se solidifier à 0°C et la température reste constante pendant toute la durée du changement d'état.- Plus la température d'un corps est élevée, plus les particules qui le composent sont agitées : on parle d'agitation thermique. À pression constante, au fur et à mesure que la température augmente, les changements d'état se font donc dans le sens d'une augmentation du désordre des particules.
0 20 40 60 80 100
Température (
°C)
Date (min)
1S Chapitre 11: Effets thermiques et changement d'étatCompétences:
Pratiquer une démarche expérimentale pour mesurer unH pQHUJLH GH ŃOMQJHPHQP G·pPMP 73 ŃMORULPpPULH
interpréter à l'échelle microscopique les aspects énergétiques d'une variation de température de changement
d'état.I. Les transferts thermiques :
1. Agitation thermique et transfert thermique :
A l'Ġtat solide, les molĠcules ou ions ne sont pas rigoureusement immobiles : ils subissent une agitation
augmente, plus la température est élevée.Lorsque deux corps à des températures différentes sont mis en contact, un transfert thermique s'effectue
du corps le plus chaud au corps le plus froid. Ce transfert cesse lorsque les deux corps sont à la même
température.2. Changements d'Ġtat :
Activité 1 p 188 : Corps purs et mélanges
1.a. Tracer la courbe donnant l'Ġǀolution de la tempĠrature de l'eau distillĠe en fonction du temps.
b. A quelle température apparaît le premier cristal de solide ? A quelle température disparaît la goutte
de liquide ? Premier cristal de solide : 0 °C, dernière goutte de liquide : 0 °C c. Compléter la phrase suivante : 2.a. Observe-t-on un palier de température lors de la formation du solide pour le mélange {eau + sel} ?
Non b. A quelle température apparaissent les premiers cristaux de solides ? à - 7,5 °CTransfert thermique
Corps " chaud » Corps " froid»Liquéfaction Solidification
Sublimation
Gaz Solid
eLiquid
eCondensation
Vaporisation Fusion
c. Expliquer pourquoi le salage des routes en hiver peut empêcher la formation de verglas. Le mélange
formation de verglas sur la route.d. Quelle différence fondamentale existe-t-il, en ce qui concerne la température, entre le changement
d'Ġtat d'un corps pur et celui d'un mĠlange ? Le changement d'Ġtat d'un corps pur se fait ă
3. a. Le liquide inconnu est-il un corps pur ou un mélange ? Justifier. Le liquide inconnu est un corps pur
puisque la courbe représentant la température en fonction du temps présente un palier. b. - 98 °C. l'eau.Ceci est vrai pour les corps purs et pour les mélanges, mais seuls les mélanges peuvent avoir
simultanément une diminution de tempĠrature et un changement d'Ġtat. Pour les corps purs, les
changements d'Ġtat se font ă tempĠrature constante.3. TempĠrature et Ġnergie de changement d'Ġtat ͗
TP Il y a conservation de l'énergie: la somme des énergies reçues et cédées est nulle. a) Capacité thermique d'un corps :Définition : L'énergie thermique mise en jeu lors d'une variation ȴT de la température d'une masse m d'un
corps se calcule par :Q = ±m.c.ȴT avec
Q transfert thermique ou énergie échangée en J m masse du corps en kg c capacité thermique du corps en J.kg-1.°C-1Remarque : Si le corps reçoit l'énergie Q > 0 et si le corps cède l'énergie au milieu extérieur Q < 0.
b) Energie massique de changement d'état :Définition : L'énergie de changement d'état Q d'un corps à une pression donnée est le transfert thermique
(l'énergie échangée) nécessaire au changement d'état d'une masse m de ce corps :Q = ±m.L avec
Q transfert thermique ou énergie échangée en J m masse de ce corps en kg L énergie massique de changement d'état en J.kg-1 III. Interprétation microscopique du phénomène. Lorsqu'un corps fond c'est que l'agitation est telle que l'intensité desinteractions électromagnétiques (appelées interactions de Van der Vaals) diminue fortement et n'assure
plus la cohésion du solide : les molécules restent en contact mais deviennent mobiles et le corps devient
liquide en contact mais deviennent mobiles et le corps devient liquide.Lors de la vaporisation, les interactions disparaissent et les molécules deviennent indépendantes les unes
des autres, elles sont animées d'une grande vitesse et occupent tout le volume dont elle disposent.
ex 10 et 21 p 195-197quotesdbs_dbs20.pdfusesText_26[PDF] les changements d'état de l'eau cycle 3
[PDF] changement d'état de l'eau 6eme
[PDF] les changements détat de leau ce2
[PDF] les changements d'état de l'eau cm1
[PDF] les changements d'état de l'eau cp
[PDF] exercices corrigés changement détat dun corps pur
[PDF] changement d'état physique définition
[PDF] controle physique chimie 5eme les etats de leau
[PDF] le cycle de l'eau 5ème évaluation
[PDF] les changements d'état de l'eau ce1
[PDF] changement détat de leau 5ème exercices
[PDF] les états de l'eau 5ème
[PDF] les changements d'état physique 5ème
[PDF] changement d'état physique exercice