 Masse et volume lors dun changement détat
Masse et volume lors dun changement détat
Lorsque l'on refroidit un corps pur on lui retire de l'énergie. La température diminue jusqu'à un palier : c'est la solidification
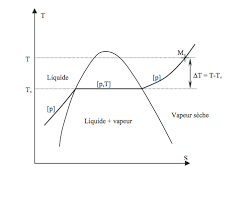 Chapitre 7-Changement d état des corps purs. Cas particulier de l
Chapitre 7-Changement d état des corps purs. Cas particulier de l
fusion solidification sublimation condensation. Page 2. 2 paramètres influencent l'état du corps pur : la température T et la pression p. On analysera donc un
 CHAPITRE 1 LES CORPS PURS
CHAPITRE 1 LES CORPS PURS
À pression constante le changement d'état d'un corps pour s'effectue toujours à température constante. Ainsi sous la pression atmosphérique
 Thermodynamique - Changement détat du corps pur
Thermodynamique - Changement détat du corps pur
La réunion courbe d'ébullition et courbe de rosée s'appelle courbe de saturation. 1.4.3 Théor`eme des moments. `A une température donnée et une pression donnée
 FICHE METHODE 3 méthodes pour identifier un corps pur
FICHE METHODE 3 méthodes pour identifier un corps pur
Les changements d'état d'un corps pur s'effectuent à des températures constantes qui le caractérisent. Exemple: Fusion. T=.0. °C. Glaçon. Vaporisation.
 5e – 11 – Changements détats – Support élève
5e – 11 – Changements détats – Support élève
On fait effectuer aux élèves des expériences de solidification puis de fusion de l'eau pure. Page 3. Température (°C). Temps (min). Palier à 100 °
 Chapitre 12 :Changement détat du corps pur
Chapitre 12 :Changement détat du corps pur
: pression maximale d'une phase vapeur et minimale d'une phase liquide à la température T. Page 5. Chapitre 12 : Changement d'état du corps pur. Thermodynamique.
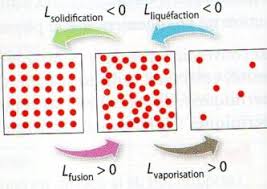 Chapitre 13- Cohésion des solides
Chapitre 13- Cohésion des solides
Ce transfert cesse lorsque les deux corps sont à la même température. 2. Changements d'état : Activité 1 p 188 : Corps purs et mélanges. 1.
 Physique Chimie 2de Bac Pro
Physique Chimie 2de Bac Pro
Un corps pur change d'état physique à température constante. Cette température a la même valeur pour les changements réciproques. Exemple. La température de
 Objectifs
Objectifs
– Etat solide : état compact et ordonné. • Changement d'état : À pression constante le changement d'état d'un corps pur s'effectue toujours à température
 Masse et volume lors dun changement détat
Masse et volume lors dun changement détat
La température diminue jusqu'à un palier : c'est la solidification puis elle diminue à nouveau. Lorsqu'on chauffe un corps pur
 Thermodynamique - Changement détat du corps pur
Thermodynamique - Changement détat du corps pur
La réunion courbe d'ébullition et courbe de rosée s'appelle courbe de saturation. 1.4.3 Théor`eme des moments. `A une température donnée et une pression donnée
 Chapitre 12 :Changement détat du corps pur
Chapitre 12 :Changement détat du corps pur
: pression maximale d'une phase vapeur et minimale d'une phase liquide à la température T. Page 5. Chapitre 12 : Changement d'état du corps pur. Thermodynamique.
 Physique Chimie 2de Bac Pro
Physique Chimie 2de Bac Pro
Un changement d'état s'effectue à température constante pour un corps pur. Activité expérimentale 1 : Le changement d'état une transformation physique p.
 Chapitre 7-Changement d état des corps purs. Cas particulier de l
Chapitre 7-Changement d état des corps purs. Cas particulier de l
fusion solidification sublimation condensation. Page 2. 2 paramètres influencent l'état du corps pur : la température T et la pression p. On analysera donc un
 1 Les corps purs
1 Les corps purs
Changements d'état. Un corps pur peut se trouver sous trois états : solide liquide ou gazeux. Cela dépend de sa température et de sa pression.
 Changements détat du corps pur
Changements détat du corps pur
À une température et une pression données un corps pur existe généralement sous une seule phase physique. Sur un diagramme en coordonnées (T
 ATS Chapitre 5 : Changements détat du corps pur
ATS Chapitre 5 : Changements détat du corps pur
Par exemple si l'on étudie la vaporisation à la température T d'un corps pur
 Bilan les changements détats I / Leau se transforme: Etat SOLIDE
Bilan les changements détats I / Leau se transforme: Etat SOLIDE
Lorsqu'on chauffe (refroidit) un corps pur on lui apporte (retire) de Tous les corps purs ont des températures de changement d'état déterminées.
 Chapitre 13- Cohésion des solides
Chapitre 13- Cohésion des solides
Changements d'état : Activité 1 p 188 : Corps purs et mélanges. 1. a. Tracer la courbe donnant l'évolution de la température de l'eau distillée en fonction
 [PDF] Chapitre 12 :Changement détat du corps pur - Melusine
[PDF] Chapitre 12 :Changement détat du corps pur - Melusine
Chapitre 12 : Changement d'état du corps pur Thermodynamique Page 5 sur 9 B) Pression de vapeur saturante pour l'eau Température d'ébullition Téb du
 [PDF] MPSI - Thermodynamique - Changement détat du corps pur - Unisciel
[PDF] MPSI - Thermodynamique - Changement détat du corps pur - Unisciel
Nous nous intéressons dans ce chapitre aux propriétés thermo d'un corps pur sous deux phases On parle indifféremment de transition de phase ou de changement d'
 [PDF] Chapitre 7-Changement d état des corps purs Cas particulier de l
[PDF] Chapitre 7-Changement d état des corps purs Cas particulier de l
Lorsqu'un corps pur évolue d'un état d'équilibre à un autre on assiste dans certaines conditions à une modification importante et soudaine de ces
 [PDF] Chapitre 29 : Changements détat du corps pur
[PDF] Chapitre 29 : Changements détat du corps pur
CHAPITRE 29 Changements d'état du corps pur Qu'observe-t-on ? L'évolution de la température au cours du temps est donnée ci-contre Qu'en déduit-on ?
 [PDF] ATS Chapitre 5 : Changements détat du corps pur - TSI Ljfhtml
[PDF] ATS Chapitre 5 : Changements détat du corps pur - TSI Ljfhtml
Si pour cette même température T : • P < PSat(T) le point M est en-dessous de la courbe et la vapeur est dite sèche (tout le corps pur à l'état gaz) • P =
 [PDF] Changement détat dun corps pur - LJM BEZIERS - STI
[PDF] Changement détat dun corps pur - LJM BEZIERS - STI
Il suffit pour cela de placer le corps pur dans une enceinte thermostatée `a la température T puis de le comprimer de mani`ere quasi sta- tique 1 4 2 Courbe
 [PDF] Changements détat du corps pur
[PDF] Changements détat du corps pur
Dans la plupart des composés à la température de changement d'état le solide est plus dense que le liquide soit Vm liq > Vm sol La pente de la courbe de
 [PDF] Th3 - Changement de phase dun corps pur I Quelques définitions
[PDF] Th3 - Changement de phase dun corps pur I Quelques définitions
La pression d'équilibre dépend de la température On relève deux points particuliers : – T point triple : point où coexistent les trois phases Pour un corps
 [PDF] Cours Page 1 Tous les corps purs changent détat à températ
[PDF] Cours Page 1 Tous les corps purs changent détat à températ
Cette température permet d'identifier le corps pur La température de fusion tF et de solidification tS de l'eau pure sont : tF = tS = 0°C
 [PDF] Thermodynamique Le corps pur sous plusieurs phases
[PDF] Thermodynamique Le corps pur sous plusieurs phases
Lorsqu'un corps passe de la phase x à la phase y à température T = T0 et pression P = P0 constante sa variation d'entropie massique vaut : ?s12 = ?12(T0) T0
Quelle est la température de changement d'état d'un corps pur ?
À pression donnée, les changements d'état des corps purs se font à des températures fixes. À pression normale : La solidification et la fusion de l'eau pure ont lieu à 0 °C. La vaporisation et la liquéfaction de l'eau pure ont lieu à 100 °C.Comment à lieu le changement d'état pour un corps pur ?
Les changements d'états des corps purs (solidification, fusion, ébullition) se font à température constante. Cette température est une caractéristique propre à chaque corps pur. Deux corps purs différents ont des températures de fusion, de solidification et d'ébullition différentes.Comment mesurer une température de changement d'état ?
On place un tube à essais, contenant de l'eau distillée, dans un mélange réfrigérant. On observe le contenu du tube, et on relève la température toutes les minutes. Observations : L'eau commence à se solidifier à 0°C et la température reste constante pendant toute la durée du changement d'état.- Plus la température d'un corps est élevée, plus les particules qui le composent sont agitées : on parle d'agitation thermique. À pression constante, au fur et à mesure que la température augmente, les changements d'état se font donc dans le sens d'une augmentation du désordre des particules.
MPSI - Thermodynamique - Changement d"´etat du corps purpage 1/5Changement d"´etat du corps purTable des mati`eres1´Equilibre d"un corps pur sous deux phases 11.1 D´efinitions . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 11.2 Variance . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 11.3 Diagramme (p,T) . . . . . . . . . . . . . . . . . . . . . . . . . . . . 21.4 Diagramme (p,V) pour l"´equilibre liquide-gaz . . . . . . .. . . . . 2
1.4.1 Isothermes d"Andrews . . . . . . . . . . . . . . . . . . . . . 2
1.4.2 Courbe de saturation . . . . . . . . . . . . . . . . . . . . . . 3
1.4.3 Th´eor`eme des moments . . . . . . . . . . . . . . . . . . . . 3
2 Fonctions d"´etat du corps pur sous deux phases 4
2.1 Expressions g´en´erales . . . . . . . . . . . . . . . . . . . . . . . . . .4
2.2 Enthalpie et entropie de transition de phase . . . . . . . . . .. . . 4
2.3 Calcul des variations des fonctions d"´etat d"un m´elange diphas´e
liquide-gaz . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 4 1´Equilibre d"un corps pur sous deux phases
1.1 D´efinitions
Un corps pur peut exister sous trois phases diff´erentes : solide, liquide ou vapeur. Lorsqu"elles existent, ces phases se distinguent par des masses volumiques diff´erentes et des indices lumineux diff´erents; elles sontdonc s´epar´ees sous l"effet de la pesanteur et le dioptre entre les deux phases est visible. Nous nous int´eressons dans ce chapitre aux propri´et´es thermo d"un corps pur sous deux phases. On parle indiff´eremment detransition de phaseou dechangement d"´etatpour l"´evolution conduisant tout ou partie d"un syst`eme `a ´evoluer d"une phase `a une autre :LIQUIDE
GAZSOLIDE
fusion solidification liquéfaction vaporisation sublimation condensation Un syst`eme comportant une seule phase estmonophas´e. Un syst`eme comportant deux phases estdiphas´e.1.2 Variance
Rappelons que l"´etat d"´equilibre d"un corps pur est d´etermin´e par le triplet (p, V,T) ou encore un point dans l"espace; l"ensemble des ´etats d"´equilibre forme alors une surface. Tp V liquide fluide gazl+g s+g solide s+l Damien DECOUT - Derni`ere modification : mars 2007MPSI - Thermodynamique - Changement d"´etat du corps purpage 2/5Un corps pur sous une phase est un syst`emedivariant: deux param`etres
intensifs, par exempleTetp, suffisent pour caract´eriser l"´etat d"´equilibre d"un syst`eme monophas´e puisque le troisi`eme est donn´e par l"´equation d"´etatV=f(T,p).
On constate exp´erimentalement que pour un corps pur sous deux phases en ´equilibre thermo,petTsont li´ees par une relation caract´eristique du corps purp= Π(T); le syst`eme est doncmonovariant. Pour une temp´erature donn´ee T,p= Π(T) est fix´ee etV=f(T,p) est fix´e. Le volumeVest le volume total et il est n´ecessaire d"introduire en plus un param`etre d´ecrivant la r´epartition de la mati`ere entreles deux phases (1) et (2) qui coexistent; on utilise souvent le titre massique : x 1=m1 met x2=m2 m= 1-x11.3 Diagramme (p,T)
Attention, sur le diagramme seules les projections des points de la surface correspondent `a un ´etat d"´equilibre; il pourrait donc y avoir des couples (p, T) qui ne corespondent `a rien; remarque aussi valable pour lediagramme deClapeyron.
solide liquide gaz TTCp 0 Les 3 courbes issues du mˆeme point T correspondent `a l"´equilibre monovariant du corps pur diphas´e et traduisent la relationp= Π(T). Elles s´eparent des domaines correspondant `a l"´equilibre divariant du corps pur monophas´e. Aupoint tripleT, les 3 phases coexistent pour un triplet (p,V,T) qui d´epend du corps consid´er´e; la variance est donc nulle au point triple. La courbe d"´equilibre liquide-vapeur se termine aupoint critiqueC. Pour une compression isothermeT < TCet r´eversible (petTsont d´efinies entre l"´etat initial et l"´etat final et on peut repr´esenter les couples qui forment une droite sur le diagramme), lorsque l"on traverse la courbe, les deux phases coexistent et on observe une transition liquide-vapeur. Pour une compression isothermeT > TCet r´eversible, `a aucun moment on peut voir les deux phases coexister, aucune transition de phase apparente. TT IF IF Cp 0 Id pour une compression isobarep > pCr´eversible.Insistons encore :
Pour un nombre de moles ou une masse donn´ee, un point situ´e dans un domaine monophas´e d´ecrit un unique ´etat du corps pur caract´eris´e par (p,V,T); en effet, l"´equation d"´etat du corps pur dans la phase consid´er´ee donne le volumeV connaissant la pressionpet la temp´eratureT.En revanche, un point situ´e surp= Π(T) d´ecrit en g´en´eral une infinit´e d"´etats
du corps pur. Ces ´etats ont en communpetTmais diff`erent parVqui prend des valeurs diff´erentes suivant la r´epartition du corps pur entre les 2 phases. Damien DECOUT - Derni`ere modification : mars 2007MPSI - Thermodynamique - Changement d"´etat du corps purpage 3/51.4 Diagramme (p,V) pour l"´equilibre liquide-gazappel´e aussidiagramme de Clapeyron.
1.4.1 Isothermes d"Andrews
L"intersection de la surface et d"un planT=ctedonne dans le diagramme de Clapeyron une courbe appel´eeisotherme d"Andrews. On peut repr´esenter plusieurs isothermes sur le mˆeme diagramme. p V l+g s+gs+lsolidefluide liquide T>>Tc T>Tc T=TcTt T Ces courbes correspondent `a des d´etentes isotherme (T=cte) r´eversible (puisque passant par des ´etats d"´equilibres du corps pur). 1.4.2 Courbe de saturation
Le syst`eme est monophas´e : liquide pur; la pression diminue, au point L apparaˆıt la premi`ere bulle. L"ensemble des points L pour les diff´erentes isothermes s"appellecourbe d"ebullition. De L `a G, la pression est constante, le syst`eme est monovariant et diphas´e : m´elange liquide-vapeur aussi appel´evapeur saturante; Π(T) est alors appel´e pression de vapeur saturante. Au point G, disparaˆıt la derni`ere goutte de liquide (ou apparaˆıt la premi`ere goutte de liquide pour l"´evolution inverse). L"ensemble des points G s"appellecourbe de ros´ee. La r´eunion courbe d"´ebullition et courbe de ros´ee s"appellecourbe de saturation. 1.4.3 Th´eor`eme des moments
A une temp´erature donn´ee et une pression donn´ee, les diff´erents ´etats d"´equilibre
M du corps pur diphas´e sont situ´es sur le segment LG. p L M G V 0 Au point L,V=VLet le syst`eme est enti`erement sous forme liquide nous pouvons donc exprimer le volume massique de la phase liquide sachantque toute la masse mest liquide : v l=VL m de mˆeme v g=VGm Au point M
V=mlvl+mgvg=ml
mVL+mg mVG=xlVL+xgVG V=xlVL+ (1-xl)VG?xl=VG-V
VG-VL V= (1-xg)VL+xgVG?xg=V-VLVG-VL
Damien DECOUT - Derni`ere modification : mars 2007 MPSI - Thermodynamique - Changement d"´etat du corps purpage 4/5Pour un point M appartenant `a la zone de changement d"´etat liquide-gaz, les
fractions massiques de liquidexlet de gazxgs"obtiennent graphiquement `a partir des points L et G qui limitent le palier de changement d"´etat par x l=MG LGet xg=LM
LG 2 Fonctions d"´etat du corps pur sous deux phases
2.1 Expressions g´en´erales
Les deux phases d"un corps pur diphas´e peuvent ˆetre consid´er´ees comme deux sous-syst`emes disjoints;U,HetS´etant des grandeurs extensives : U=x1U1+x2U2
H=x1H1+x2H2
S=x1S1+x2S2
2.2 Enthalpie et entropie de transition de phase
Pour une transition de phase 1→2, on appelleenthalpie de transition de phaseh1→2(T) `a la temp´eratureT, la diff´erence des enthalpies du corps pur dans la phase 2 et dans la phase 1 `a la mˆeme temp´eratureTet `a la pression d"´equilibre des deux phasesp= Π(T) : H1→2(T) =H2(T)-H1(T)
Les enthalpies de fusion, de vaporisation et de sublimationsont positives, n´egatives pour les transitions inverses.Interpr´etation : l"enthalpie de transition de phase 1→2 est ´egale au transfert
thermiqueQn´ecessaire pour faire passer r´eversiblement le corps purde la phase 1 `a la phase 2 en maintenantTetp= Π(T) constantes.
En effet l"´evolution ´etant r´eversible
dU=δW+δQ=-pdV+δQ et isobare ΔH=Q
En appliquant maintenant le deuxi`eme principe, l"´evolution ´etant r´eversible dS=δQ T et isotherme ΔS=QT
Finalement, l"entropie de transition de phase
S1→2(T) =S2(T)-S1(T) =H1→2(T)
T 2.3 Calcul des variations des fonctions d"´etat d"un m´elange di-
phas´e liquide-gaz On utilise couramment des tables thermo pour acc´eder aux fonctions d"´etat du m´elange liquide-gaz d"un corps pur. Dans certains cas, on ne dispose pas de tables compl`etes donnantHL,SL, H GetSGen fonction de la temp´erature mais seulement de tables donnant la pression de vapeur saturante Π(T) et l"enthalpie de vaporisationHL→Gen fonction de la temp´erature. Dans ce cas, on utilise le fait que les variations des fonctions d"´etat entre deux ´etats I et F donn´es ne d´ependent pas du chemin suivi entre I et F. On peut donc choisir un chemin qui permet de calculer les variations: i) l"enthalpie de vaporisation permet d"acc´eder aux variations deHetS en fonction dexg`a temp´erature fix´ee : H=xgHG+ (1-xg)HL=HL+xg(HG-HL) =HL+xgHL→G
Damien DECOUT - Derni`ere modification : mars 2007 MPSI - Thermodynamique - Changement d"´etat du corps purpage 5/5 dH=HL→Gdxg de mˆeme dS=SL→Gdxg=HL→G Tdxg ii) pour acc´eder aux variations deHetSen fonction de la temp´erature on choi- sit en g´en´eral un chemin situ´e sur la courbe d"´ebullition (syst`eme enti`erement liquide); des tables fournissent la capacit´e thermique C souvent suppos´ee ind´e- pendante de la temp´erature et on fait l"approximation du fluide incompressible de volume n´egligeable : dHL?CdT et dSL?CdT T Damien DECOUT - Derni`ere modification : mars 2007quotesdbs_dbs15.pdfusesText_21
T Ces courbes correspondent `a des d´etentes isotherme (T=cte) r´eversible (puisque passant par des ´etats d"´equilibres du corps pur). 1.4.2 Courbe de saturation
Le syst`eme est monophas´e : liquide pur; la pression diminue, au point L apparaˆıt la premi`ere bulle. L"ensemble des points L pour les diff´erentes isothermes s"appellecourbe d"ebullition. De L `a G, la pression est constante, le syst`eme est monovariant et diphas´e : m´elange liquide-vapeur aussi appel´evapeur saturante; Π(T) est alors appel´e pression de vapeur saturante. Au point G, disparaˆıt la derni`ere goutte de liquide (ou apparaˆıt la premi`ere goutte de liquide pour l"´evolution inverse). L"ensemble des points G s"appellecourbe de ros´ee. La r´eunion courbe d"´ebullition et courbe de ros´ee s"appellecourbe de saturation. 1.4.3 Th´eor`eme des moments
A une temp´erature donn´ee et une pression donn´ee, les diff´erents ´etats d"´equilibre
M du corps pur diphas´e sont situ´es sur le segment LG. p L M G V 0 Au point L,V=VLet le syst`eme est enti`erement sous forme liquide nous pouvons donc exprimer le volume massique de la phase liquide sachantque toute la masse mest liquide : v l=VL m de mˆeme v g=VGm Au point M
V=mlvl+mgvg=ml
mVL+mg mVG=xlVL+xgVG V=xlVL+ (1-xl)VG?xl=VG-V
VG-VL V= (1-xg)VL+xgVG?xg=V-VLVG-VL
Damien DECOUT - Derni`ere modification : mars 2007 MPSI - Thermodynamique - Changement d"´etat du corps purpage 4/5Pour un point M appartenant `a la zone de changement d"´etat liquide-gaz, les
fractions massiques de liquidexlet de gazxgs"obtiennent graphiquement `a partir des points L et G qui limitent le palier de changement d"´etat par x l=MG LGet xg=LM
LG 2 Fonctions d"´etat du corps pur sous deux phases
2.1 Expressions g´en´erales
Les deux phases d"un corps pur diphas´e peuvent ˆetre consid´er´ees comme deux sous-syst`emes disjoints;U,HetS´etant des grandeurs extensives : U=x1U1+x2U2
H=x1H1+x2H2
S=x1S1+x2S2
2.2 Enthalpie et entropie de transition de phase
Pour une transition de phase 1→2, on appelleenthalpie de transition de phaseh1→2(T) `a la temp´eratureT, la diff´erence des enthalpies du corps pur dans la phase 2 et dans la phase 1 `a la mˆeme temp´eratureTet `a la pression d"´equilibre des deux phasesp= Π(T) : H1→2(T) =H2(T)-H1(T)
Les enthalpies de fusion, de vaporisation et de sublimationsont positives, n´egatives pour les transitions inverses.Interpr´etation : l"enthalpie de transition de phase 1→2 est ´egale au transfert
thermiqueQn´ecessaire pour faire passer r´eversiblement le corps purde la phase 1 `a la phase 2 en maintenantTetp= Π(T) constantes.
En effet l"´evolution ´etant r´eversible
dU=δW+δQ=-pdV+δQ et isobare ΔH=Q
En appliquant maintenant le deuxi`eme principe, l"´evolution ´etant r´eversible dS=δQ T et isotherme ΔS=QT
Finalement, l"entropie de transition de phase
S1→2(T) =S2(T)-S1(T) =H1→2(T)
T 2.3 Calcul des variations des fonctions d"´etat d"un m´elange di-
phas´e liquide-gaz On utilise couramment des tables thermo pour acc´eder aux fonctions d"´etat du m´elange liquide-gaz d"un corps pur. Dans certains cas, on ne dispose pas de tables compl`etes donnantHL,SL, H GetSGen fonction de la temp´erature mais seulement de tables donnant la pression de vapeur saturante Π(T) et l"enthalpie de vaporisationHL→Gen fonction de la temp´erature. Dans ce cas, on utilise le fait que les variations des fonctions d"´etat entre deux ´etats I et F donn´es ne d´ependent pas du chemin suivi entre I et F. On peut donc choisir un chemin qui permet de calculer les variations: i) l"enthalpie de vaporisation permet d"acc´eder aux variations deHetS en fonction dexg`a temp´erature fix´ee : H=xgHG+ (1-xg)HL=HL+xg(HG-HL) =HL+xgHL→G
Damien DECOUT - Derni`ere modification : mars 2007 MPSI - Thermodynamique - Changement d"´etat du corps purpage 5/5 dH=HL→Gdxg de mˆeme dS=SL→Gdxg=HL→G Tdxg ii) pour acc´eder aux variations deHetSen fonction de la temp´erature on choi- sit en g´en´eral un chemin situ´e sur la courbe d"´ebullition (syst`eme enti`erement liquide); des tables fournissent la capacit´e thermique C souvent suppos´ee ind´e- pendante de la temp´erature et on fait l"approximation du fluide incompressible de volume n´egligeable : dHL?CdT et dSL?CdT T Damien DECOUT - Derni`ere modification : mars 2007quotesdbs_dbs15.pdfusesText_21
1.4.2 Courbe de saturation
Le syst`eme est monophas´e : liquide pur; la pression diminue, au point L apparaˆıt la premi`ere bulle. L"ensemble des points L pour les diff´erentes isothermes s"appellecourbe d"ebullition. De L `a G, la pression est constante, le syst`eme est monovariant et diphas´e : m´elange liquide-vapeur aussi appel´evapeur saturante; Π(T) est alors appel´e pression de vapeur saturante. Au point G, disparaˆıt la derni`ere goutte de liquide (ou apparaˆıt la premi`ere goutte de liquide pour l"´evolution inverse). L"ensemble des points G s"appellecourbe de ros´ee. La r´eunion courbe d"´ebullition et courbe de ros´ee s"appellecourbe de saturation.1.4.3 Th´eor`eme des moments
A une temp´erature donn´ee et une pression donn´ee, les diff´erents ´etats d"´equilibre
M du corps pur diphas´e sont situ´es sur le segment LG. p L M G V 0 Au point L,V=VLet le syst`eme est enti`erement sous forme liquide nous pouvons donc exprimer le volume massique de la phase liquide sachantque toute la masse mest liquide : v l=VL m de mˆeme v g=VGmAu point M
V=mlvl+mgvg=ml
mVL+mg mVG=xlVL+xgVGV=xlVL+ (1-xl)VG?xl=VG-V
VG-VLV= (1-xg)VL+xgVG?xg=V-VLVG-VL
Damien DECOUT - Derni`ere modification : mars 2007MPSI - Thermodynamique - Changement d"´etat du corps purpage 4/5Pour un point M appartenant `a la zone de changement d"´etat liquide-gaz, les
fractions massiques de liquidexlet de gazxgs"obtiennent graphiquement `a partir des points L et G qui limitent le palier de changement d"´etat par x l=MGLGet xg=LM
LG2 Fonctions d"´etat du corps pur sous deux phases
2.1 Expressions g´en´erales
Les deux phases d"un corps pur diphas´e peuvent ˆetre consid´er´ees comme deux sous-syst`emes disjoints;U,HetS´etant des grandeurs extensives :U=x1U1+x2U2
H=x1H1+x2H2
S=x1S1+x2S2
2.2 Enthalpie et entropie de transition de phase
Pour une transition de phase 1→2, on appelleenthalpie de transition de phaseh1→2(T) `a la temp´eratureT, la diff´erence des enthalpies du corps pur dans la phase 2 et dans la phase 1 `a la mˆeme temp´eratureTet `a la pression d"´equilibre des deux phasesp= Π(T) :H1→2(T) =H2(T)-H1(T)
Les enthalpies de fusion, de vaporisation et de sublimationsont positives,n´egatives pour les transitions inverses.Interpr´etation : l"enthalpie de transition de phase 1→2 est ´egale au transfert
thermiqueQn´ecessaire pour faire passer r´eversiblement le corps purde la phase1 `a la phase 2 en maintenantTetp= Π(T) constantes.
En effet l"´evolution ´etant r´eversible
dU=δW+δQ=-pdV+δQ et isobareΔH=Q
En appliquant maintenant le deuxi`eme principe, l"´evolution ´etant r´eversible dS=δQ T et isothermeΔS=QT
Finalement, l"entropie de transition de phase
S1→2(T) =S2(T)-S1(T) =H1→2(T)
T2.3 Calcul des variations des fonctions d"´etat d"un m´elange di-
phas´e liquide-gaz On utilise couramment des tables thermo pour acc´eder aux fonctions d"´etat du m´elange liquide-gaz d"un corps pur. Dans certains cas, on ne dispose pas de tables compl`etes donnantHL,SL, H GetSGen fonction de la temp´erature mais seulement de tables donnant la pression de vapeur saturante Π(T) et l"enthalpie de vaporisationHL→Gen fonction de la temp´erature. Dans ce cas, on utilise le fait que les variations des fonctions d"´etat entre deux ´etats I et F donn´es ne d´ependent pas du chemin suivi entre I et F. On peut donc choisir un chemin qui permet de calculer les variations: i) l"enthalpie de vaporisation permet d"acc´eder aux variations deHetS en fonction dexg`a temp´erature fix´ee :H=xgHG+ (1-xg)HL=HL+xg(HG-HL) =HL+xgHL→G
Damien DECOUT - Derni`ere modification : mars 2007 MPSI - Thermodynamique - Changement d"´etat du corps purpage 5/5 dH=HL→Gdxg de mˆeme dS=SL→Gdxg=HL→G Tdxg ii) pour acc´eder aux variations deHetSen fonction de la temp´erature on choi- sit en g´en´eral un chemin situ´e sur la courbe d"´ebullition (syst`eme enti`erement liquide); des tables fournissent la capacit´e thermique C souvent suppos´ee ind´e- pendante de la temp´erature et on fait l"approximation du fluide incompressible de volume n´egligeable : dHL?CdT et dSL?CdT T Damien DECOUT - Derni`ere modification : mars 2007quotesdbs_dbs15.pdfusesText_21[PDF] les changements d'état de l'eau cycle 3
[PDF] changement d'état de l'eau 6eme
[PDF] les changements détat de leau ce2
[PDF] les changements d'état de l'eau cm1
[PDF] les changements d'état de l'eau cp
[PDF] exercices corrigés changement détat dun corps pur
[PDF] changement d'état physique définition
[PDF] controle physique chimie 5eme les etats de leau
[PDF] le cycle de l'eau 5ème évaluation
[PDF] les changements d'état de l'eau ce1
[PDF] changement détat de leau 5ème exercices
[PDF] les états de l'eau 5ème
[PDF] les changements d'état physique 5ème
[PDF] changement d'état physique exercice
