 Activité. Comprendre la masse volumique. - Physique et Chimie
Activité. Comprendre la masse volumique. - Physique et Chimie
masse volumique est une grandeur physique qui caractérise la masse d'un matériau par page 3/4. Explication de la méthode "mesure du volume d'un solide par ...
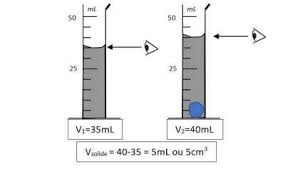 Organisation et transformation de la matière Activité 1 : La bague en
Organisation et transformation de la matière Activité 1 : La bague en
Chap 1 : La masse volumique 4ème. Connaissances et compétences du programme 3) . 4) Réalise ton expérience et écris tes résultats en détaillant ton calcul ...
 A quoi peut servir la masse volumique ?
A quoi peut servir la masse volumique ?
Activité 3 : Classe de seconde ou AP seconde. A partir de données. (volume masse
 Fascicule SCIENCES PHYSIQUES
Fascicule SCIENCES PHYSIQUES
3 masse volumique cuivre : 8
 Guide de lenseignant sciences physiques 4e et 3e
Guide de lenseignant sciences physiques 4e et 3e
3) MassE VoluMiQuE d'unE substancE. 1° Masse volumique d'un liquide. A l'aide d'une éprouvette graduée et de la balance mesurer la masse de: 25
 Conséquences du réchauffement climatique
Conséquences du réchauffement climatique
22 nov. 2019 Niveau 4ème : Introduction de la notion d'évolution de la masse volumique en fonction de la température. Les prérequis sont : • Etats physiques ...
 Cours de physique chimie 4eme college pdf
Cours de physique chimie 4eme college pdf
Séquence complète pour la 4ème en Physique-chimie sur : La tension Thème 3 : L Séquence complète en 4ème en Physique-chimie : La masse volumique MODULE 1 ...
 Chapitre 1 La quantité de matière la concentration molaire et le
Chapitre 1 La quantité de matière la concentration molaire et le
Déterminer la masse molaire moléculaire de l'aspirine. 2. Chapitre 1. Page 3. Données : masses molaires atomiques : M(
 PHYSIQUE-CHIMIE- TECHNOLOGIE
PHYSIQUE-CHIMIE- TECHNOLOGIE
Activité N°3 mol-1. Volume d'alcool pur par litre de vin sachant que la masse volumique de l'alcool à 20°C est.
 Chimie Générale (Chimie 1)
Chimie Générale (Chimie 1)
23 déc. 2020 La masse molaire (M) est la masse d'une mole d'atomes. L'unité de masse atomique est le. 1/12 de la masse d'un atome de carbone 12. 1 ...
 Physique Chimie
Physique Chimie
8 fév. 2017 2 Quel est le solvant ? 3 Calculer la masse d'eau sucrée obtenue. 4 Quelle masse de sucre faudrait-il dissoudre dans 250 g d'ea.
 Chapitre 1 La quantité de matière la concentration molaire et le
Chapitre 1 La quantité de matière la concentration molaire et le
Déterminer la masse molaire moléculaire de l'aspirine. 2. Chapitre 1. Page 3. Données : masses molaires atomiques : M(
 CHAPITRE 5 : LA MASSE VOLUMIQUE
CHAPITRE 5 : LA MASSE VOLUMIQUE
16 août 2021 masse volumique du fer est supérieure à celle du plastique. 3. ... Aulnay-Sous-Bois – Quatrième – Physique-chimie – M. Sivasuthasarma.
 correction exercices Précis de Physique-Chimie chapitre1 à 4
correction exercices Précis de Physique-Chimie chapitre1 à 4
Eléments de correction des exercices du chapitre 3 : la réaction chimique . Masse molaire : formule littérale. Résultat.
 Cours de Chimie Structure de la matière
Cours de Chimie Structure de la matière
Cours de Chimie Le quatrième et le cinquième chapitre représentent la structure ... La masse molaire atomique: est la masse d'une mole d'atomes.
 PHYSIQUE-CHIMIE- TECHNOLOGIE
PHYSIQUE-CHIMIE- TECHNOLOGIE
d'activités. SA.1 CHAMPS DE FORCES ET INTERACTIONS. 1. Cinématique. 2. Champ électrostatique. 3. Champ magnétique. 4. 4h x 4. Octobre. SA.2. CHIMIE DES
 Guide de lenseignant sciences physiques 4e et 3e
Guide de lenseignant sciences physiques 4e et 3e
tâche et qu'il le prépareà bien conduire les activités d'enseignement/apprentissage dans sa classe. les auteurs 3) MassE VoluMiQuE d'unE substancE.
 COURS DE CHIMIE GENERALE Semestre 1 SVI
COURS DE CHIMIE GENERALE Semestre 1 SVI
Les isotopes. 3. Mole et masse molaire. 4. L'unité de masse atomique u.m.a.. CHAPITRE II: MODELES CLASSIQUES DE L'ATOME. I.
 Comment identifier une substance ?
Comment identifier une substance ?
S3-3 MATIÈRE p. 3. CARACTÉRISATION DES SUBSTANCES. FICHE DE. TRAVAIL. ACTIVITÉ 1. EXERCICES. Identifier une substance par sa masse volumique.
 Les grandeurs physiques et leurs unités. (à connaître par cœur) Il ne
Les grandeurs physiques et leurs unités. (à connaître par cœur) Il ne
Poids de l'objet sur Terre (symbole : P) Unités couramment utilisées en chimie : cm3 et ml. La masse volumique d'un liquide ou d'un solide ou.
 Activité Comprendre la masse volumique - ac-lyonfr
Activité Comprendre la masse volumique - ac-lyonfr
? = m+V ? = m×V ? = V ? = m V 2 5) Les unités de la masse volumique : Si la masse est en kg et le volume en m3 alors la masse volumique est en Si la masse est en g et le volume en cm3 (ou mL) donc la masse volumique est en 3ème partie – Entraine–toi avec des liquides différents !
 4ème-PE-Chapitre 3 : La masse volumique - Elearningphysiquechimiefr
4ème-PE-Chapitre 3 : La masse volumique - Elearningphysiquechimiefr
La masse volumique d'une substance correspond au rapport de sa masse (m) par son volume (V) Elle se note ? (rau) et peut être calculée en utilisant la relation suivante : ? = Avec m en kilogramme ( kg ) en mètre-cube ( m3) ? en kilogramme par mètre-cube ( kg/m3) Ou avec m en gramme ( g )
Chapitre 1
La quantité de matière, la concentration
molaire et le volume molaireAu cours du XX
e siècle, les scientifiques amenés très souvent à travailler avec des nombres d"atomes ou de molécules extrêmement grands, veulent simplifier leurs calculs et inventent par commodité une nouvelle unité : la mole. En 1971, la mole devient l"unité officielle de la quantité de matière ! Pour faciliter le " comptage » de la matière, on part du principe qu"une mole d"atomes correspond à un nombre, une constante égale à 6,02.1023 atomes !L"année dernière, vous vous êtes " amusés » à calculer la quantité de matière
d"une espèce chimique à partir de son nombre d"entités... Comment ça non ? Mais si, rafraîchissement de mémoire : La quantité de matière se note n, N représente le nombre d"entités présentes dans l"échantillon :Avec NA
, la célèbre constante de M. Avogadro qui s"exprime en mol -1 Cette année, on va aller encore plus loin en ajoutant des formules ! Je vais vous apprendre à calculer la quantité de matière d"une espèce chimique à partir de sa masse puis de sa masse volumique et enfin de son volume molaire ! Dans un deuxième temps, on abordera la notion ultra essentielle concernant la concentration molaire d"une espèce chimique. A cette occasion, je vous donnerai 2 protocoles de TP illustrant la dissolution et la dilution. ATTENTION : il faudra les connaître par cur, c"est-à-dire, savoir les schématiser parfaitement et connaître le nom de la verrerie utilisée... Pas d"inquiétude, je vous ai facilité comme d"habitude, votre vie de jeune étudiant chimiste en vous préparant une série de méthodes claires, précises et très efficaces ! Assez parlé, on se met au boulot ! Commençons par quelques rappels de 2de METHODE 1 : Définir la mole : unité de la quantité de matièrePrincipe
La quantité de matière d'un solide, liquide ou gaz se note " n ». C'est une grandeur physique (car mesurable) qui s'exprime en mole de symbole " mol ». n = ANN molSans unité mol
-19782340-031821_001_
456.indd 19782340-031821_001_456.indd 128/06/2019 14:5528/06/2019 14:55
La définition ultra-classique et rigoureuse donnée dans tous les manuels scolaires de la mole est la suivante : " une mole contient autant d'entités chimiques qu'il y a d'atomes dans 12,0 g d'atomes de carbone 12 ». Ainsi, une mole contient 6,02.10 23entités chimiques identiques... Le seul problème, c'est qu'en général vous ne comprenez rien au sens de cette phrase... C'est embêtant ! Comme je l'ai dit en intro, la mole est l'unité de la quantité de matière présente dans un solide, un liquide ou un gaz. On l'a inventé pour deux raisons majeures : la première, c'est qu'elle permet de dénombrer la matière et la deuxième raison est qu'elle permet de simplifier les calculs... Eh oui, quand vous comptez par exemple le nombre d'atomes présents dans une barre de fer, il y en a des milliards de milliards de milliards... Ça fait beaucoup de 0 dans les calculs ! Le chimiste " s'amusera » à compter non pas le nombre d'atomes mais le nombre de moles d'atomes présentes dans ce morceau de fer ! (Ils sont rusés ces chimistes...) Pour vous éclaircir les idées, une mole, c'est un peu comme un grand sac dans lequel vous pourriez y mettre 6,02.10 23
objets identiques. Ainsi, une mole d'atomes correspond à un sac contenant 6,02.10 23
atomes, de même, une mole d'ions correspond à 6,02.10 23
ions... Capito ? Va bene ! METHODE 2 : Savoir calculer la masse molaire moléculaire
Principe
La masse molaire atomique d'un élément chimique est la masse d'une mole d'atomes de cet élément chimique. L'unité est le gramme par mole, notée g.mol -1 Par exemple, la masse molaire atomique de l'oxygène est M(O)= 16,0 g.mol -1 La masse molaire moléculaire est égale à la somme des masses molaires atomiques des éléments chimiques constituant la molécule. L'unité est toujours le gramme par mole, notée g.mol -1Ainsi, la masse molaire de la molécule d'eau H
2O est :
M(H2O) = 2 x M(H) + M(O) = 2 x 1,00 + 16,0 = 18,0 g.mol
-1Exemple 1 : Quelle migraine ! Pas vous... moi !
Un élève, suite à une longue journée de travail intensif, manifeste un début de migraine. Afin de soigner ce mal de tête, il prend un cachet d"aspirine de formule brute C9H8O3. Déterminer la masse molaire moléculaire de l"aspirine.2 Chapitre 1
9782340-031821_001_456.indd 29782340-031821_001_456.indd 228/06/2019 14:5528/06/2019 14:55
Données : masses molaires atomiques : M(H) = 1,00 g.mol -1 ; M(O) = 16,0 g.mol -1M(C) = 12,0 g.mol
-1Correction
M(C9H8O3) = 9 x M(C) + 8 x M(H) + 3 x M(O) = 9 x 12,0 + 8 x 1,00 + 3 x 16,0M(C9H8O3) = 164 g.mol
-1 Exemple 2 : Des masses molaires en pagaille ! Ça sent le sud...Compléter le tableau ci-dessous :
Nom de l'espèce
chimiqueFormule brute de l'espèce chimiqueMasse molaire moléculaireParacétamolC8H9O2N
Acide ascorbique
(vitamine C) C 6H8O6SaccharoseC12H22O11
ÉosineC20H6O5Br4Na2
PénicillamineC5H11O2NS
IbuprofèneC13H18O2
Données : masses molaires atomiques : M(H) = 1,0 g.mol -1 ; M(O) = 16,0 g.mol -1M(C) = 12,0 g.mol
-1 ; M(N) = 14,0 g.mol -1 ; M(S) = 32,1 g.mol -1M(Br) = 79,9 g.mol
-1 ; M(Na) = 23,0 g.mol -1Correction
Nom de l'espèce
chimiqueFormule brute de l'espèce chimiqueMasse molaire moléculaireParacétamolC
8H9O2N 151g.mol
-1Acide ascorbique
(vitamine C) C6H8O6 176 g.mol
-1SaccharoseC
12H22O11 342 g.mol
-1ÉosineC
20H6O5Br4Na2 691,6 g.mol
-1PénicillamineC
5H11O2NS 149,1 g.mol
-1IbuprofèneC
13H18O2 206 g.mol
-1 La quantité de matière, la concentration molaire et le volume molaire 39782340-031821_001_456.indd 39782340-031821_001_456.indd 328/06/2019 14:5528/06/2019 14:55
METHODE 3 : Savoir calculer la quantité de matière à partir de la masse d"un solidePrincipe
M représente la masse molaire de l'échantillon, m représente la masse de l'échantillon et n représente la quantité de matière de l'échantillon :Attention aux unités !
Par expérience, vous avez toujours du mal à retenir cette formule ! Petit moyen mnémotechnique pour y arriver... Evidemment rien de scientifique là-dedans, mais c'est très efficace pour ne pas se planter ! Je me lance : " Le M (majuscule) est grand et solide. Il sera donc capable de porter sur ses épaules le m " minuscule » frêle et léger ! » On fait ce qu'on peut !Exemple 1 : Préparer un pain maison
Une recette fournie avec une machine à pain indique qu'il faut mélanger un volume de 315 mL d"eau avec 500 g de farine, de glucose, une pincée de sel et un sachet de levure boulangère.1) Calculer la masse molaire du glucose de formule brute C6H12O6.
2) Déterminer la quantité de matière introduite en glucose dans la recette.
Données : masses molaires atomiques : M(H) = 1,00 g.mol -1 ; M(O) = 16,0 g.mol -1M(C)= 12,0 g.mol
-1Correction
1) M(C6H12O6) = 6 x M(C) + 12 x M(H) + 6 x M(O)
M(C6H12O6) = 6 x 12,0 + 12 x 1,00 + 6 x 16,0
M(C6H12O6) = 180 g.mol
-12) n(C6H12O6) =
612 6612 6
m(C H O )
M(C H O )
280180
donc n(C6H12O6) = 1,56 mol. n = Mm mol g g.mol -1
4 Chapitre 1
9782340-031821_001_456.indd 49782340-031821_001_456.indd 428/06/2019 14:5528/06/2019 14:55
Exemple 2 : Un médicament anti-vertige
Un médicament qui lutte contre les vertiges contient 5,0 mg d'acétyl-leucine de formule brute C8H15O3N. L"acétyl-leucine constitue le principe actif de ce médicament.1) Calculer la masse molaire de l"acétyl-leucine.
2) Déterminer la quantité de matière en acétyl-leucine contenue dans ce
médicament. Données : masses molaires atomiques : M(H) = 1,00 g.mol -1 ; M(O) = 16,0 g.mol -1M(C)= 12,0 g.mol
-1 ; M (N) = 14,0 g.mol -1Correction
1) M(C8H15O3N) = 8 x M(C) + 15 x M(H) + 3 x M(O) + M(N)
M(C8H15O3N) = 8 x 12,0 + 15 x 1,00 + 3 x 16,0 + 14,0M(C8H15O3N) = 173 g.mol
-12) m(C8H15O3N) = 5,0 mg = 5,0.10
-3 g n(C8H15O3N) = 815 3815 3
m(C H O N)
M(C H O N) =
35,0.10
173donc n(C8H15O3N) = 2,89.10 -5 mol. METHODE 4 : Savoir calculer la quantité de matière à partir de la masse volumique
Principe
Il est possible de calculer la quantité de matière à l'aide de la masse volumique :ǒVnM
Attention aux unités
n en mol, ǒ (masse volumique) en g.mL -1 , V (volume) en mL et M en g.mol -11,0 cm
3 = 1,0 mL et 1,0 g.cm -3 = 1,0 g.mL -1 Evidemment, cette formule se " redémontre » ! n = m/Mȡ = m/V donc m = ȡ×V
On réinjecte ensuite l'expression de " m » dans la première formule : n =ȡ×V/M...
La quantité de matière, la concentration molaire et le volume molaire 59782340-031821_001_456.indd 59782340-031821_001_456.indd 528/06/2019 14:5528/06/2019 14:55
Exemple : Etude d'une réaction entre le sodium et l'éthanol On fait réagir 460 mg de sodium de formule Na avec un volume V = 100 mL d"éthanol de formule C2H6O. Déterminer les quantités de matière introduite en sodium et en éthanol.Données : M(H) = 1,00 g.mol
-1 ; M(C) = 12,0 g.mol -1 ; M(O) = 16,0 g.mol -1M(Na) = 23,0 g.mol
-1 Masse volumique de l"éthanol : ȡéthanol = 0,79 g.cm -3Correction
Détermination de la quantité de matière en sodium : 3 m 460.10nM 23,0 n = 2,00.10 -2 mol Détermination de la masse molaire de l"éthanol : M(C2H6O) = 2 x 12,0 + 6 x 1,00 + 16,0 = 46,0 g.mol -1 Détermination de la quantité en éthanol :ǒV0,79100nM46,0
n = 1,71 mol. METHODE 5 : Savoir calculer la quantité de matière à partir du volume molairePrincipe
Le volume molaire, noté V
m, correspond au volume occupé par une mole de gaz. Il s'exprime L/mol. Il est indépendant de la nature du gaz, il ne dépend que de la température et de la pression. Très important : à température et pression fixées, tous les gaz possèdent le même volume molaire.Par exemple :
à T = 0°C et P = 1,013 × 10
5Pa : Vm = 22,4 L/mol
à T = 20°C et P = 1,013 × 10
5Pa : Vm = 24,0 L/mol
La quantité de matière n peut se calculer à l'aide de la relation suivante : m VnVAttention aux unités
n en mol, V (volume) en L et Vm (volume molaire) en L/mol6 Chapitre 1
9782340-031821_001_456.indd 69782340-031821_001_456.indd 628/06/2019 14:5528/06/2019 14:55
Exemple : Le gazole
Un constituant du gazole est le cétane de formule brute C16H34. Données : M(C) = 12,0 g/mol , M(H) = 1,00 g/molVolume molaire : Vm = 24,0 L/mol
a) Calculer la masse molaire du cétane b) Calculer la quantité de matière contenue dans une masse m = 1,00 kg de cétane. c) Calculer le volume que représente cette masse de cétane.Correction
a) M(C16H34) = 16 x 12,0 + 34 x 1,00 = 226 g/mol b) 3 m 1,00.10nM 226 donc n = 4,42 mol c) m VnV donc V = n x Vm = 4,42 x 24,0 = 106,2 L 1,1.10 2 L METHODE 6 : Comprendre la notion de concentration molairePrincipe
La concentration molaire d'une espèce chimique en solution est la quantité de matière de soluté présente par litre de solution. La concentration molaire d'une espèce chimique A se note CA ou [A], elle s'exprime en mol.L
-1 C espèce = solution n(espèce) VAttention aux unités
C espèce en mol.L -1 , n(espèce) en mol, Vsolution en L. La concentration massique et la concentration molaire sont liées par : C m = C x MAttention aux unités
C m en g.L -1 , C en mol.L -1 et M en g.mol -1 La quantité de matière, la concentration molaire et le volume molaire 79782340-031821_001_456.indd 79782340-031821_001_456.indd 728/06/2019 14:5528/06/2019 14:55
Rappel de 2
de La concentration massique d'une espèce chimique en solution est la masse de soluté présente par litre de solution. La concentration massique se note C m, elle s'exprime en g.L -1 C m = solution m(espèce) VAttention aux unités
C m en g.L -1 , m(espèce) en g, Vsolution en L. Comme d'habitude, je vous fais l'affront de vous le répéter : vous apprenez par coeur la relation mathématique et vous n'oubliez pas ces chères UNITES !!! Voici quelques exemples pour faire travailler vos neurones... (Uniquement parce que vous êtes mon élève préféré bien sûr !)Exemple 1 : Un café sucré
Afin de sucrer un café contenu dans une tasse de 50,0 mL, on introduit un sucre de masse m = 3,0 g. Le sucre est constitué majoritairement de saccharose de formule brute C12H22O11. a) Calculer la masse molaire du saccharose. b) Calculer la quantité de matière introduite dans le café en saccharose. c) Calculer la concentration molaire en saccharose dans la tasse de café. Donnée : masses molaires atomiques : M(C) = 12,0 g.mol -1 , M(H) = 1,00 g.mol -1M(O) = 16,0 g.mol
-1Correction
a) M(C12H22O11) = 12 x M(C) + 22 x M(H) + 11 x M(O) M(C12H22O11) = 12 x 12,0 + 22 x 1,00 + 11x 16,0 donc M(C12H22O11) = 342 g.mol -1 b) n(C12H22O11) =12 22 11
12 22 11
m(C H O )3,0M(C H O ) 342
donc n(C12H22O11) = 8,8.10 -3 mol. c) Csaccharose =12 22 11
tasse n(C H O ) V or Vtasse = 50,0 mL = 5,00.10 -2 LCsaccharose =
3 28,8.10
5,0.10
donc Csaccharose = 1,8.10 -1 mol.L -1Exemple 2 : Un sirop de menthe
Un sirop de menthe contient le colorant alimentaire bleu de patenté (E 131) et le colorant alimentaire jaune de tartrazine (E 102) lui conférant cette couleur8 Chapitre 1
9782340-031821_001_456.indd 89782340-031821_001_456.indd 828/06/2019 14:5528/06/2019 14:55
quotesdbs_dbs43.pdfusesText_43[PDF] activité 38 page 13 2nde Mathématiques
[PDF] Activité 3éme , La vaccination SVT 3ème SVT
[PDF] activite 5eme ecrire des expressions numeriques 5ème Mathématiques
[PDF] ACTIVITE : le développement du foetus dans le ventre maternel 4ème SVT
[PDF] Activité : Les composés aromatiques 2nde Physique
[PDF] Activité : Les mesures d'hygiène 3ème SVT
[PDF] Activité : Puissance Maximale Terminale Mathématiques
[PDF] Activité : Quel est lordre de grandeur de la dimension dun atome Physique-Chimie 3ème Physique
[PDF] Activité :Apport sanguin aux organes pendant leffort 2nde SVT
[PDF] Activité à faire en SVT sur les planètes 2nde SVT
[PDF] activite a proposer dans une creche PDF Cours,Exercices ,Examens
[PDF] activité addition nombres relatifs PDF Cours,Exercices ,Examens
[PDF] activite ado PDF Cours,Exercices ,Examens
[PDF] activité alimentation garderie PDF Cours,Exercices ,Examens
