 TP Chimie n° 3
TP Chimie n° 3
TP Chimie n° 3. Dosage acido-basique en présence d'indicateurs colorés. (Dosage de l'acide acétique contenu dans le vinaigre). 1 Introduction. Le vinaigre de
 TRAVAUX PRATIQUES DE CHIMIE I
TRAVAUX PRATIQUES DE CHIMIE I
préparée par un dosage acido-basique. I. Objectifs ………………………………………………………………………………….. 15. II. Introduction ...…………………………………………………………………………….15. III. Principe du ...
 1 TP Nº2 (Semestre 1) : Dosage dune base forte (NaOH) par un
1 TP Nº2 (Semestre 1) : Dosage dune base forte (NaOH) par un
Le but de ce TP est de vérifier la concentration molaire (inconnue) d'une solution d'hydroxyde de sodium NaOH préparée par dosage acido-basique. 4. Mode
 1 TP Nº2 (Semestre 1) : Dosage dune base forte (NaOH) par un
1 TP Nº2 (Semestre 1) : Dosage dune base forte (NaOH) par un
Le but de ce TP est de vérifier la concentration molaire (inconnue) d'une solution d'hydroxyde de sodium NaOH préparée par dosage acido-basique. 4. Mode
 TP 3 Méthode de neutralisation (dosage acido-basique) Dosage de
TP 3 Méthode de neutralisation (dosage acido-basique) Dosage de
TP 3 Méthode de neutralisation (dosage acido-basique). Dosage de deux produits domestiques « le déboucheur et le vinaigre ». Introduction. Les acides et les
 TP N°01 Le port de la blouse en coton blanche et assez longue est
TP N°01 Le port de la blouse en coton blanche et assez longue est
TP de Chimie 1. 11. TP N°03. Dosage Acido-basique. I. Introduction : ➢ Une des premières définitions d'un acide et d'une base a été proposée en 1887 par
 TP : Dosage acidobasique par pHmétrie
TP : Dosage acidobasique par pHmétrie
9 févr. 2018 TP : Dosage acidobasique par pHmétrie ... solution acide dans le bécher lors d'un dosage acido-basique et la solution basique dans la burette.
 TRAVAUX PRATIQUES DE CHIMIE DES SOLUTIONS
TRAVAUX PRATIQUES DE CHIMIE DES SOLUTIONS
TP N°3 : DOSAGE DES POLYACIDES A 25°C la neutralité acido-basique correspond à. pH=7
 Travaux Pratiques de Chimie 1 1 ère Année Licence (LMD) tronc
Travaux Pratiques de Chimie 1 1 ère Année Licence (LMD) tronc
TP N°03 : Titrage acido-basique. I. Introduction……………………………………………………………………………..20. II. Objectifs…………………………………………………………………..………….…..20. III. Généralités ...
 Dosage dune solution aqueuse de peroxyde dhydrogène par
Dosage dune solution aqueuse de peroxyde dhydrogène par
TP dosage manganimetrie.DOC. Page 1 sur 4. Dosage d'une solution aqueuse de Introduction : Un antiseptique : l'eau oxygénée. Le peroxyde d'hydrogène de ...
 TP Chimie n° 3
TP Chimie n° 3
Dosage acido-basique en présence d'indicateurs colorés. (Dosage de l'acide acétique contenu dans le vinaigre). 1 Introduction. Le vinaigre de vin est un produit
 TRAVAUX PRATIQUES DE CHIMIE I
TRAVAUX PRATIQUES DE CHIMIE I
II. Introduction. Le dosage acidobasique est utilisé afin de déterminer la concentration inconnue d'une solution composée d'un acide ou d'une base
 TP CHIMIE-1 & TP CHIMIE-2
TP CHIMIE-1 & TP CHIMIE-2
I-Quelques recommandations en guise d'introduction . TP II : Le dosage acido-basique (cas d'un acide fort par une base forte) ....... 14.
 1 TP Nº2 (Semestre 1) : Dosage dune base forte (NaOH) par un
1 TP Nº2 (Semestre 1) : Dosage dune base forte (NaOH) par un
TP Nº2 (Semestre 1) : Dosage d'une base forte (NaOH) par un acide fort (HCl). 1. Introduction : Les réactions acido-basiques résultent du transfert d'un
 Travaux Pratiques de Chimie Générale (Génie Industriel)
Travaux Pratiques de Chimie Générale (Génie Industriel)
TP (03) : Dosage acido-basique…………………………………………………………… TP (04) : Titrage TP. ? Introduction à la démarche expérimentale : vous concevrez vous-mêmes vos.
 Polycopie-TP-Chimie-1.pdf
Polycopie-TP-Chimie-1.pdf
DOSAGE ACIDO-BASIQUE. TPN°2. UHBChlef - S1 Licence LMD -ST- Polycopie TP Chimie 1 - Dr. Malika OUAGUED. Page 16. TP I – Dosage d'un acide fort par une base
 pH?7
pH?7
TP 3 Méthode de neutralisation (dosage acido-basique). Dosage de deux produits domestiques « le déboucheur et le vinaigre ». Introduction.
 Titrages acido-basiques
Titrages acido-basiques
Dosages acido-basiques conductimétriques. Spectrophotométrie (sera vu en TP). Dosage par ... dosage (-> introduction en faible quantité: une ou deux.
 TP de Chimie 2014-2015 Classe de Terminale S2
TP de Chimie 2014-2015 Classe de Terminale S2
7 nov. 2014 introduction : doser ou faire un dosage c'est déterminer la quantité de matière ... TP Chimie n°10 : titrage acido-basique de l'ammoniaque.
 TP : Dosage acidobasique par pHmétrie
TP : Dosage acidobasique par pHmétrie
TP : Dosage acidobasique par pHmétrie solution acide dans le bécher lors d'un dosage acido-basique et la solution basique dans la burette. De.
Université de Batna -2-
Faculté des Sciences de la Nature et de la Vie
Département du Socle Commun (SC. SNV)
1ère année biologie
Année Universitaire 2021/2022
TP Nº2 (Semestre 1) : Dosage d'une base forte (NaOH) par un acide fort (HCl)1. Introduction :
Les réactions acido-basiques résultent du transfert d'un proton H+ d'une espèce (acide) à une
autre (base). L'espèce donneur de proton se transforme alors dans sa base conjuguée, ce qui implique l'existence de couples acide-base (Acide/Base).Le dosage acido-basique est utilisé afin de déterminer la concentration inconnue d'une
solution composée d'un acide ou d'une base, ou d'un mélange. Si la solution de titre inconnu est un acide, on verse une base de façon à neutraliser l'acide. Un acide : Est une espèce chimique capable de libérer un ion ou un proton H+ ce qui résume l'équation suivante : AH A- + H+ Une base : Est une espèce chimique capable de fixer un ion ou un proton H+ ce qui résume l'équation suivante : B+H+ BH+ Le dosage acide-base est une réaction appelée réaction de neutralisation donnée par : acide + base → sel + H2OA l'équivalence, le nombre de moles H
3O+ apportées par l'acide doit être égal au nombre de
moles OH - apportées par la base. Cela entraine : 2Dosage d'une base forte par un acide fort
Na : La normalité de l'acide , Va : Le volume de l'acide Nb : La normalité de la base , Vb : Le volume de la base2. Objectifs :
Pratiquer une démarche expérimentale pour déterminer la concentration d'une espèce chimique lors d'un titrage colorimétrique (changement de couleur pour visualiser l'équivalence). Etablir l'équation de la réaction support de titrage à partir d'un protocole expérimental.3. Le but de TP :
Le but de ce TP est de vérifier la concentration molaire (inconnue) d'une solution d'hydroxyde de sodium NaOH préparée par dosage acido-basique.4. Mode opératoire :
Introduire dans un erlenmeyer 10 ml de NaOH prélevée à l'aide d'une pipette propre. Ajouter 2 à 3 gouttes d'indicateur coloré. Rincer la burette graduée avec la solution d'acide chlorhydrique HCl, puis la remplir. Procéder au dosage de la solution jusqu'au virage de l'indicateur coloré. Noter le volume d'HCl versé. On fera deux essais dans les mêmes conditions. 3Dosage d'une base forte par un acide fort
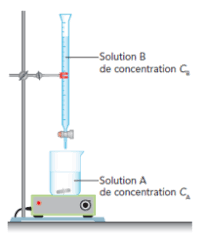
4. Montage de dosage :
5. Travail à faire :
5. 1- Faire un schéma annoté du dosage acide-base.
5. 2- Ecrire la réaction chimique du dosage acido-basique (KOH par HCl).
5. 3- Sachant que la solution KOH de concentration C
b=0.1 mol/l, et de Vb=10ml. CalculerNa et Ca de HCl.
5. 4- Calculer le PH de ce dosage.
L'équipe de Chimie
quotesdbs_dbs3.pdfusesText_6[PDF] invalidité catégorie 2 declaration de ressources
[PDF] inventaire d'intérêts professionnels de rothwell-miller
[PDF] inventaire des interets professionnels gratuit
[PDF] inventaire physique des stocks pdf
[PDF] inventer une histoire ? partir d'images maternelle
[PDF] invention époque contemporaine
[PDF] invention moyen age
[PDF] inverse log
[PDF] investir 2269
[PDF] investir 2275
[PDF] investir n°2278
[PDF] investir n°2279
[PDF] invitation benoit lavoie 2016
[PDF] invitation cote du sud 2017
