 TS 1 CONTRÔLE DE SCIENCES PHYSIQUES 03/11/05 I/ Étude
TS 1 CONTRÔLE DE SCIENCES PHYSIQUES 03/11/05 I/ Étude
3 ??? 2005 de l'eau oxygénée par les ions iodure en présence d'acide sulfurique. Cette ... L'équation de la réaction qui modélise la transformation ...
 Exercice : décomposition de leau oxygénée Exercice
Exercice : décomposition de leau oxygénée Exercice
L'eau oxygénée est une solution aqueuse de peroxyde d'hydrogène H2O2 qui 2-2) Écrire l'équation de la réaction de H2O2 et de l'ion permanganate MnO4.
 CORRECTION TS 2 : Test Chimie 1 Date : Sujet A ETUDE
CORRECTION TS 2 : Test Chimie 1 Date : Sujet A ETUDE
L'équation de la réaction qui modélise la transformation d'oxydoréduction sulfurique en excès 15
 Exercice 1 (7 points) Cinétique de la décomposition de leau
Exercice 1 (7 points) Cinétique de la décomposition de leau
9 ??? 2017 oxygénée se décompose lentement selon l'équation-bilan suivante : 2H2O2(aq). 2H2O(l) + O2(g). Cette réaction de décomposition peut ...
 Préparation dune solution de peroxyde dhydrogène (H2O2 ou eau
Préparation dune solution de peroxyde dhydrogène (H2O2 ou eau
Solution de peroxyde d'hydrogène selon l'équation bilan de décomposition. 1°) Équation chimique de la réaction : 2 H2O2 (?) ?. 2O(?) + O2 (g).
 Physique-chimie MODÉLISER LÉVOLUTION TEMPORELLE DUN
Physique-chimie MODÉLISER LÉVOLUTION TEMPORELLE DUN
2. À l'échelle microscopique comment modélise-t-on une transformation chimique au niveau des entités chimiques mises en jeu ? Comment explique
 Espèces chimiques molécules et atomes
Espèces chimiques molécules et atomes
La formule H2O2 (eau oxygénée) représente une molécule (avec ses L'équation de la réaction chimique qui modélise la combustion d'un hydrocarbure.
 SVT-SPC-ACT 2-RESSOURCES protocole oxydation du glucose
SVT-SPC-ACT 2-RESSOURCES protocole oxydation du glucose
frotter les yeux et se rincer à l'eau ; ne pas toucher la laine de verre si qui a été formé. ... Une équation chimique symbolise cette réaction :.
 www.devoirat.net - 2011
www.devoirat.net - 2011
oxygénée par les ions iodure en présence d'acide sulfurique transformation considérée comme totale. L'équation de la réaction qui modélise la
 Exercice n°1 : 155 pts « Eau oxygénée » est le nom commun du
Exercice n°1 : 155 pts « Eau oxygénée » est le nom commun du
ne garder que celle qui modélise la transformation chimique étudiée : 2/ A partir de cette équation et des informations données construisez le tableau
 [PDF] Exercice : décomposition de leau oxygénée - Physique chimie facile
[PDF] Exercice : décomposition de leau oxygénée - Physique chimie facile
1- L'eau oxygénée est instable et se décompose lentement suivant la réaction : 2 H2O2(aq) O2(g) + 2 H2O(l) Une solution d'eau oxygénée à n volumes peut
 [PDF] Leau oxygénée - LUTES
[PDF] Leau oxygénée - LUTES
2) L'eau oxygénée se décompose spontanément selon la réaction: H2O2liq = H2Oliq + 1/2 O2g Calculez l'enthalpie standard de décomposition de H2O2liq
 [PDF] Exercice 1 (7 points) Cinétique de la décomposition de leau oxygénée
[PDF] Exercice 1 (7 points) Cinétique de la décomposition de leau oxygénée
9 mar 2017 · oxygénée se décompose lentement selon l'équation-bilan suivante : 2H2O2(aq) 2H2O(l) + O2(g) Cette réaction de décomposition peut
 [XLS] Cinétique de la décomposition de leau oxygénée
[XLS] Cinétique de la décomposition de leau oxygénée
Donner l'équation chimique de la réaction de dosage Etablir l'expression littérale donnant la concentration C de H2O2 en fonction du volume E de la prise d'
 [PDF] Exercice n°1 : 155 pts « Eau oxygénée
[PDF] Exercice n°1 : 155 pts « Eau oxygénée
Eau oxygénée » est le nom commun du peroxyde d'hydrogène de formule chimique H2O2 ne garder que celle qui modélise la transformation chimique étudiée :
 [PDF] L Feriana
[PDF] L Feriana
Exercice 1 : On se propose d'étudier la cinétique de la transformation lente de décomposition de l'eau oxygénée par les ions iodure en présence d'acide
 [PDF] Première Question: Décomposition dune eau oxygénée (7 points)
[PDF] Première Question: Décomposition dune eau oxygénée (7 points)
On se propose d'étudier la cinétique de la réaction de décomposition du peroxyde d'hydrogène réalisée en présence de l'ion fer (II) L'équation-bilan de
 [PDF] Cinétique de la réaction des ions iodure avec leau oxygénée Lion
[PDF] Cinétique de la réaction des ions iodure avec leau oxygénée Lion
Écrire l'équation de la réaction d'oxydoréduction entre les ions iodure et l'eau oxygénée en milieu acide 2I-(aq) = I2 (aq) + 2e- H2O2 (aq) + 2H+ (
 [PDF] Test Chimie 1 Date : Sujet A ETUDE CINETIQUE D UNE REACTION
[PDF] Test Chimie 1 Date : Sujet A ETUDE CINETIQUE D UNE REACTION
oxygénée en présence d'acide sulfurique transformation considérée comme totale L'équation de la réaction qui modélise la transformation d'oxydoréduction
 [PDF] 2 n 10 n
[PDF] 2 n 10 n
de l'eau oxygénée par les ions iodure en présence d'acide sulfurique transformation considérée comme totale L'équation de la réaction qui modélise la
Quelle est la réaction de décomposition de l'eau oxygénée ?
2) L'eau oxygénée se décompose spontanément selon la réaction: H2O2,liq = H2Oliq + 1/2 O2,g Calculez l'enthalpie standard de décomposition de H2O2,liq connaissant les enthalpies standard de formation de H2O2,liq (?fH°( H2O2,liq) = - 188 kJ.Quel est la gaz libéré par la dismutation de l'eau oxygénée ?
L'eau oxygénée se décompose sur elle-même, donnant du dioxygène et de l'eau selon la réaction : 2 H2O2 ? O2 + 2 H2O.Quelle est la quantité de matière de O2 libéré par la décomposition d'un litre d'eau oxygénée ?
Sachant que deux moles de peroxyde d'hydrogène libèrent une mole de dioxygène, quelle quantité de dioxygène nO2 exprimée en moles peut libérer un litre de cette eau oxygénée ? 0,89 mol de peroxyde d'hydrogène, présent dans ce litre libère : 0,5*0,89 = 0,445 mol ~0,45 mol de dioxygène.- L'équation de la décomposition de l'eau est : H2O ? 2 H2 + O2.
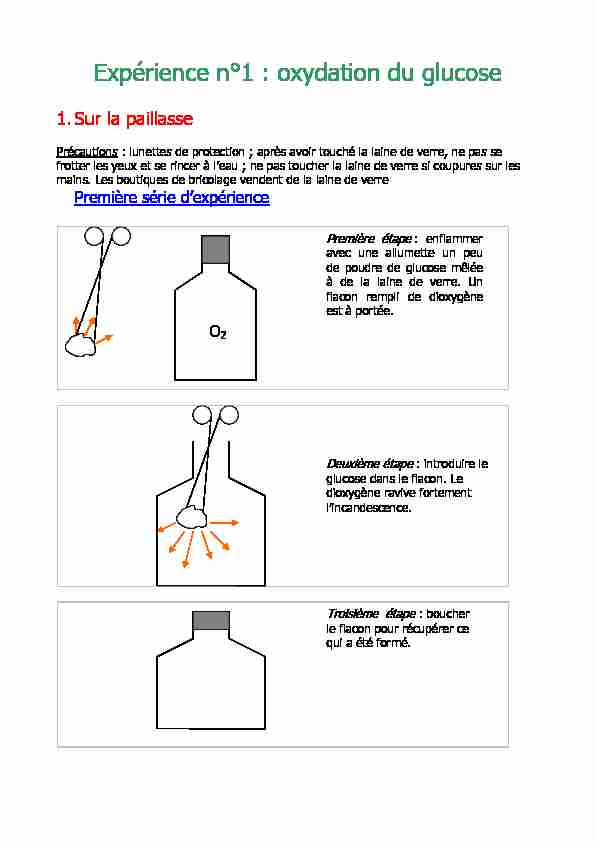
Expérience n°1 : oxydation du glucose
1. Sur la paillasse
Précautions
: lunettes de protection ; après avoir touché la laine de verre, ne pas se frotter les yeux et se rincer à l"eau ; ne pas toucher la laine de verre si coupures sur les mains. Les boutiques de bricolage vendent de la laine de verrePremière série d"expérience
Troisième étape : boucher
le flacon pour récupérer ce qui a été formé.Deuxième étape : introduire le
glucose dans le flacon. Le dioxygène ravive fortement l"incandescence.Première étape : enflammer
avec une allumette un peu de poudre de glucose mêléeà de la laine de verre. Un
flacon rempli de dioxygène est à portée. O2Seconde série d"expériences
La coloration bleue traduit la présence d"eau ; la vapeur d"eau formée se condense sur la paroi glacée du flacon. Introduire le glucose enflammé dans le flacon. Certains cristaux bleuissent légèrement.Expérience délicate, le
bleuissement étant légerPremière étape : enflammer
avec une allumette un peu de poudre de glucose mêléeà de la laine de verre. Un
flacon rempli de dioxygène est à portée. L"intérieur du flacon est tapissé de sulfate de cuivre anhydre donc blanc. Le flacon est conservé dans la glace. O2Quatrième étape
: un test verser de l"eau de chaux dans le flacon ; agiter.L"eau de chaux se trouble :
ce test traduit la présence de dioxyde de carbone dans le flacon eau de chaux2. Réfléchir
Au départ : glucose et dioxygène en présence constituent les réactifs.À l"issue de l"expérience
: de l"eau et du dioxyde de carbone ont été formés (et caractérisés par des tests). Ce sont les produits. Le processus complexe par lequel les réactifs se transforment en produits est une transformation chimique : transformation pendant laquelle une poudre blanche brûle dans le dioxygène pour donner un gaz et de l"eauLe chimiste retient de cette transformation une
réaction chimique en nommant les réactifs et les produits : le glucose C6H12O6 réagit avec le dioxygène O2 pour former du dioxyde de carbone CO2 et de l"eau H2O.
Une équation chimique symbolise cette réaction :C6H12O6 + 6 O2 = 6 CO2 + 6 H2O
Une molécule de glucose C6H12O6 réagit avec six molécules de dioxygène O2 pour former du six molécules de dioxyde de carbone CO2 et six molécules H2O.
Cette équation traduit un bilan et ne décrit pas la manière dont la transformation est réalisée. Un peu d"arithmétique pour ajuster les nombres stoechiométriques :C6H12O6 + O2 = CO2 + H2O
C6H12O6 + O2 = 6 CO2 + H2O [conservation du nombre d"atomes de carbone] C6H12O6 + O2 = 6 CO2 + 6 H2O [conservation du nombre d"atomes d"hydrogène]C6H12O6 + a O2 = 6 CO2 + 6 H2O
6 2a 6 x 2 6 [conservation du nombre d"atomes d"oxygène]
6 + 2a = 12 + 6 d"où a = 6
C6H12O6 + 6 O2 = 6 CO2 + 6 H2O
En règle générale :
? affecter le nombre 1 à l"espèce dont la formule est la plus compliquée. ? terminer par les atomes qui se trouvent dans plus de deux espèces.Remarque à l"usage du professeur : on peut s"interroger sur le mécanisme de la réaction ; on observe
qu"une petite partie du glucose fond, noircit et s"enflamme ensuite : le glucose subit une pyrolyse puis le
carbone s"enflamme.quotesdbs_dbs30.pdfusesText_36[PDF] concentration eau oxygénée 10 volumes
[PDF] eau oxygénée permanganate de potassium
[PDF] modélisation de la transformation chimique
[PDF] exercice de chimie des solutions
[PDF] chimie analytique 2eme annee pharmacie
[PDF] cours chimie analytique pdf
[PDF] exercices de chimie analytique livre gratuit
[PDF] exercice chimie analytique pharmacie
[PDF] cours chimie analytique 2eme année pharmacie pdf
[PDF] chimie analytique cours pdf
[PDF] atomistique et liaison chimique exercices corrigés pdf
[PDF] alcool chimie
[PDF] alcool secondaire
[PDF] alcool chimie nomenclature
