 Dosage par étalonnage
Dosage par étalonnage
spectrophotométrie ; loi de. Beer-Lambert ; Kohlrausch par analogie ... Les corrigés sont rédigés par les professeurs de l'association Labolycée.
 Chapitre 3 Conductimétrie
Chapitre 3 Conductimétrie
Loi de Kohlrausch. Pour une température donnée la conductivité d'une solution est la somme des contributions apportées par les ions présents :.
 Rentrée PCSI - Chimie
Rentrée PCSI - Chimie
https://labolycee.org/thema-transformation-en-chimie-organique Préambule : Les lois de Kohlrausch et de Beer Lambert doivent être connues et maitrisées.
 CHIMIE PHYSIQUE
CHIMIE PHYSIQUE
Écrire la loi de Kohlrausch appliquée à l'acide chlorhydrique (H3O+ (aq) Cl? (aq)) de concentration c en quantité de matière de soluté apporté.
 Exercice III : Contrôles de la qualité dun lait (5 points)
Exercice III : Contrôles de la qualité dun lait (5 points)
spectrophotométrie ; loi de. Beer-Lambert ; Kohlrausch par analogie ... Les corrigés sont rédigés par les professeurs de l'association Labolycée.
 Séquence III-1 :Comment obtenir la quantité matière dune espèce
Séquence III-1 :Comment obtenir la quantité matière dune espèce
http://labolycee.org. Recueil labolycée voir le site pour le lien Avec la loi de Kohlrausch
 Séquence III-2 : Comment obtenir la quantité matière dune espèce
Séquence III-2 : Comment obtenir la quantité matière dune espèce
Exploiter la loi de Kohlrausch afin d'expliquer l'évolution de la conductivité lors d'un titrage conductimétrique http://labolycee.org.
 Kohlrausch Labolycée
Kohlrausch Labolycée
Formule topologique dilution titrage conductimétrique loi de Kohlrausch acide-base cinétique oxydo-réduction vitesse volumique facteurs cinétiques
 Titrage conductimétrique - Labolycée
Titrage conductimétrique - Labolycée
Télécharger ce fichier pdf qui contient à la fois les extraits de sujets et les corrigés Titrage avec suivi conductimétrique Loi de Kohlrausch
 [PDF] Dosage par étalonnage - 4 Extraits de sujets corrigés du bac S
[PDF] Dosage par étalonnage - 4 Extraits de sujets corrigés du bac S
Dosages par étalonnage : - spectrophotométrie ; loi de Beer-Lambert ; - conductimétrie ; explication qualitative de la loi de Kohlrausch par analogie avec
 Cinétique Labolycée
Cinétique Labolycée
Formule topologique dilution titrage conductimétrique loi de Kohlrausch acide-base cinétique oxydo-réduction vitesse volumique facteurs cinétiques
 Chimie et piscine - Labolycée
Chimie et piscine - Labolycée
Dosage par titrage direct : Conductimétrie ; explication qualitative de la loi de Kohlrausch Interpréter qualitativement un changement de pente dans un
 Acide-Base Labolycée
Acide-Base Labolycée
Télécharger ce fichier pdf qui contient à la fois les extraits de sujets et les titrage conductimétrique loi de Kohlrausch acide-base cinétique
 Beer-Lambert - Labolycée
Beer-Lambert - Labolycée
4 extraits de sujets corrigés de bac sur le dosage par étalonnage spectrophométrique (loi de Beer-Lambert) Télécharger ce fichier pdf qui contient à la
 [PDF] Les parties en rouge ne sont pas au programme des écrits
[PDF] Les parties en rouge ne sont pas au programme des écrits
Exploiter la loi de Beer-Lambert la loi de Kohlrausch ou l'équation d'état du gaz parfait pour déterminer une concentration ou une quantité de matière
 Labolycée - Exercices corrigés de bac physique chimie
Labolycée - Exercices corrigés de bac physique chimie
Formule topologique dilution titrage conductimétrique loi de Kohlrausch acide-base cinétique oxydo-réduction vitesse volumique facteurs cinétiques
 Tale Spécialité Physique Chimie - Labolycée
Tale Spécialité Physique Chimie - Labolycée
Télécharger ce fichier pdf il contient à la fois les extraits de sujets et les titrage conductimétrique loi de Kohlrausch acide-base cinétique
Comment appliquer la loi de Kohlrausch ?
On applique la loi de Kohlrausch ? = k × C, afin de calculer k pour la solution S' : S·m2·mol–1. On peut maintenant calculer la concentration en quantité de matière de la solution S : ? = k × C soit mol·m–3.Quand utiliser la loi de Kohlrausch ?
Le dosage par conductimétrie, basé sur la loi de Kohlrausch, est adapté dans le cas où l'esp? dosée est un électrolyte (voir connaissances de base) qui se dissocie en ions dans l'eau. La conductivité d'une solution dépend de la concentration, de la nature des ions et de la température.- Lors d'un titrage par conductimétrie, on suit l'évolution de la conductance de la solution A en fonction du volume VB de solution B versé. À l'équivalence, la conductivité est minimale : on trouve alors le volume VB(éq) correspondant. La relation à l'équivalence donne ensuite la concentration CA de l'esp? chimique A.
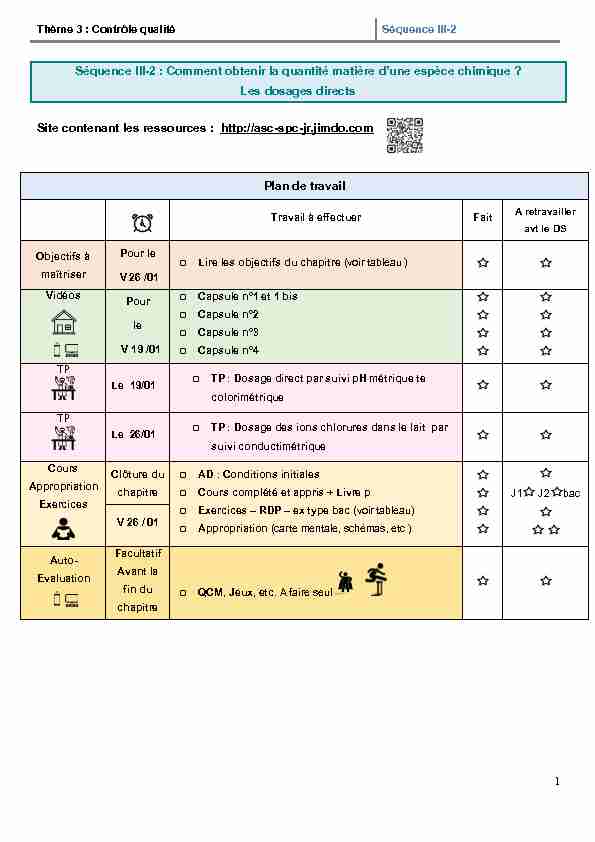 1 Thème 3 : Contrôle qualitéSéquence III-2 Séquence III-2 : Comment obtenir la quantité matière d'une espèce chimique ?
1 Thème 3 : Contrôle qualitéSéquence III-2 Séquence III-2 : Comment obtenir la quantité matière d'une espèce chimique ? Les dosages directs
Site contenant les ressources : http://asc-spc-jr.jimdo.comPlan de travail
Travail à effectuer Fait
A retravailler
avt le DSObjectifs à
maîtriserPour le
V 26 /01
Lire les objectifs du chapitre (voir tableau )
Vidéos
Pour leV 19 /01
Capsule n°1 et 1 bis
Capsule n°2
Capsule n°3
Capsule n°4
TPLe 19/01
TP : Dosage direct par suivi pH métrique te
colorimétrique TPLe 26/01
TP : Dosage des ions chlorures dans le lait par
suivi conductimétrique CoursAppropriation
Exercices
Clôture du
chapitreAD : Conditions initiales
Cours complété et appris + Livre p
Exercices - RDP - ex type bac (voir tableau)
Appropriation (carte mentale, schémas, etc )
J1 J2bac
V 26 / 01
Auto-Evaluation
Facultatif
Avant la
fin du chapitreQCM, Jeux, etc. A faire seul
Cours p 474- 475
OBJECTIFS A MAITRISER A LA FIN DU CHAPITRE
Objectifs utiles à l'écrit et en expérimental Légender un montage de titrage pH-métrique ou conductimétrique Ecrire l'équation de réaction support du titragerappeler les critères nécessaires d'une réaction support du titrage : la réaction doit être unique, rapide et totale
Exploiter une courbe de titrage pour déterminer le volume équivalent (titrage pH- métrique : méthode des
tangentes, méthode de la courbe dérivée ; titrage conductimétrique : changement de pente ; titrage
colorimétrique : changement de couleur)Exploiter la loi de Kohlrausch afin d'expliquer l'évolution de la conductivité lors d'un titrage conductimétrique
Choisir un indicateur coloré adapté à un titrage colorimétriqueDéfinir l'équivalence d'un titrage
Repérer l'équivalence d'un titrage pH-métrique, conductimétrique ou colorimétrique Calculer la concentration d'une solution inconnue à partir de la mesure du volume équivalentManipuler
Établir l'équation de la réaction support de titrage à partir d'un protocole expérimental.
Pratiquer une démarche expérimentale pour déterminer la concentration d'une espèce chimique par
titrage par le suivi d'une grandeur physique et par la visualisation d'un changement de couleur, dans
le domaine de la santé, de l'environnement ou du contrôle de la qualité. Interpréter qualitativement un changement de pente dans un titrage conductimétrique.Exercices du livre p 477
Les corrigés
Pour commencer
12 14Pour s'entraîner
17 21 23 24 16 19 21
Exercices en +
Fiche d'exercices
En route vers le bac
http://labolycee.org Dosage par titrage direct : 10 extraits de sujets corrigésExtrait 1: Antilles 2013 ex 2
Extrait 2: Polynésie 2013 ex1
Thème 3 : Les contrôles qualités Séquence III-2 : Titrages directes 1 COIN méthodeDifférentes Courbes pour détermination Veq.
Déterminer une C à partir d'une courbe
Pente courbe conductimétrie
Séquence III-2 : Comment obtenir la quantité matière d'une espèce chimique ?Les dosages directs
1. Qu'est-ce qu'un dosage par titrage direct ?
1.1- Réaction de dosage
Le dosage par titrage (ou plus simplement un titrage) est une technique de dosage mettant en jeu une réaction chimique appelée réaction support du dosageIl faut qu'elle soit :
- Univoque : il faut que les deux réactifs, titré et titrant, réagissent selon une seule et unique réaction.
- Totale : Un des deux réactifs mis en présence doit disparaître complètement - Rapide.Un titrage nécessite donc :
- une solution à titrer qui contient le réactif titré dont on veut déterminer la concentration ;
- une solution titrante qui contient le réactif titrant dont on connaît la concentration.1.2- L'équivalence d'un titrage.
Lors d'un dosage par titrage on cherche à déterminer l'équivalence, c'est-à-dire la valeur du volume de
solution titrante versée nécessaire pour que l'espèce à titrer soit entièrement consommée.
L'équivalence notée E ou équ. est atteinte lorsque les deux réactifs ont été introduits dans les
proportions stoechiométriques (ou quand il y a un changement de réactif limitant.)Soit le réactif A titré par le réactif B ó Soit A le réactif initialement présent dans le bécher , et B le réactif
ajouté à la burette graduée. a A +b B àc C+ d D A l'équivalence (seulement), la relation entre les quantités de réactifs est alors :1.3- Exemple :
On dose un volume V
Fe = 20,0 mL d'une solution contenant des ions ferreux Fe 2+ par une solution titrante de permanganate de potassium (K+ + MnO 4- ) de concentration C MnO4- = 0,050 mol.L -1 . Sachant qu'à l'équivalence le volume de permanganate de potassium versé est V MnO4- = 15,7 mL. On donne les couples oxydant / réducteur suivants : MnO 4 / Mn 2+ et Fe 3+ / Fe 2+Ecrire l'équation de dosage :
A partir de la réaction de dosage , établir la relation entre les quantité de matière d'ions permanganate et
d'ions ferreux. Avant l'équivalence A l'équivalence Après l'équivalenceLe réactif titrant est le réactif
limitant avant l'équivalence (à chaque fois que l'on en verse, il disparaît car réagit avec le titré). les réactifs sont intégralement consommés. les réactifs sont introduits en proportions stoechiométriques le réactif titrant est introduit en excès (il n'y a plus de réactif titré donc plus de réaction). Thème 3 : Les contrôles qualités Séquence III-2 : Titrages directes 3 Déterminer à partir de cette relation la concentration en Ion ferreux .1.4- Montage d'un dosage
2. Comment repérer l'équivalence d'un titrage ?
2.1- Cas d'un titrage par suivi conductimétrique
TP : Détermination de la teneur en ions chlorure d'un lait.On peut effectuer un titrage conductimétrique(à l'aide d'un conductimètre) lorsque la réaction de
support du titrage fait intervenir des ions .On va tracer la courbe la courbe σ = f (V).
On détermine l'équivalence du dosage en recherchant le point d'intersection des deux droites qui
modélisent l'allure de la courbe obtenue. Le volume à l'équivalence correspond à l'abscisse de ce
point.2.2- Cas d'un titrage par pH-métrie
On peut effectuer un titrage pH-métrique (à l'aide d'un pH-mètre) lorsque la réaction de support du
titrage est une réaction acido-basique (si l'on cherche à doser un acide ou une base)On va tracer la courbe la courbe pH = f (V).
Thème 3 : Les contrôles qualités Séquence III-2 : Titrages directes 5On détermine l'équivalence du dosage en recherchant le point d'inflexion par deux méthodes :
Méthode des tangentes Méthode de la dérivée Tracer deux tangentes à la courbe, parallèles, de part et d'autre du saut de pH. A l'aide d'un logiciel de traitement de données, tracer la dérivée du pH en fonction du volume versé dpH/dV = f (V).Tracer une droite (Δ).perpendiculaire aux deux
droites, et on trace sa médiatrice ( qui sera // aux deux tangentes) Le point d'intersection entre la parallèle et la courbe pH = f(V 1 ) est le point d'équivalence, le volume est l'abscisse.La dérivée présente alors un extremum.
Le volume à l'équivalence correspond à
l'abscisse de l' extremum de la courbe dpH/dV = f(V)2.3- Cas d'un titrage par suivi colorimétrique
Lors d'un dosage colorimétrique, un changement de teinte du milieu réactionnel indique l'instant de
l'équivalence du dosage. Il faut déterminer le volume de solution versé à la goutte près.
Soit, une espèce colorée apparaît ou disparaît du milieu réactionnel.Soit , il faut ajouter une espèce appelée indicateur coloré pour repérer l'équivalence par un changement
de couleur.Pour qu'un indicateur coloré acido-basique permette de repérer l'équivalence d'un titrage, il faut
que sa zone de virage contienne le pH à l'équivalence. Chaque dosage nécessite le choix d'un
indicateur coloré adapté.Exemple : On dose une solution aqueuse d'acide éthanoïque CH3COOH avec une solution titrante de
soude (Na + HO ). On place 10,0 mL d'acide éthanoïque dans un erlenmeyer . Thème 3 : Les contrôles qualités Séquence III-2 : Titrages directes 7 - Ecrire l'équation de dosageCH3COOH / CH3COO- CH3COOH + HO- à CH3COO
+ H 2 O H 2 O/ HO - On a le choix entre deux indicateur coloré : le BBT ou l'hélianthine, lequel choisir ?Le pH à l'équivalence est de 7, on choisit donc le BBT, en effet sa zone de virage contient le point
d'équivalence E - Quelle est la couleur initiale de la solution dans l'erlenmeyer ?La solution étant constituée d'acide éthanoïque, son pH < 7, donc le BBT est sous forme acide. Donc la
solution est jaune.quotesdbs_dbs30.pdfusesText_36[PDF] aspirine ph8 gastro résistant
[PDF] pourquoi l'aspirine ph8 est gastro résistant
[PDF] où le principe actif est-il libéré
[PDF] masse molaire acide salicylique
[PDF] sous quelle forme trouve t on l aspirine dans l intestin
[PDF] tp de chimie minérale 2eme année sm
[PDF] tp de chimie 1er année st
[PDF] compte rendu de tp chimie preparation des solutions pdf
[PDF] telecharger livre chimie organique gratuit pdf
[PDF] paul arnaud chimie organique 18e edition
[PDF] paul arnaud chimie organique exercices résolus
[PDF] telecharger paul arnaud chimie organique pdf
[PDF] chimie générale exercices corrigés
[PDF] chimie minérale exercices corrigés s3
