 Fiche 4 : Les composés ioniques
Fiche 4 : Les composés ioniques
Exemple : Quel solide ionique pouvons-nous former avec l'ion chlorure Cl- et La dissolution d'un composé ionique nécessite un solvant polaire (eau ...
 Dissolution de composés ioniques ou moléculaires
Dissolution de composés ioniques ou moléculaires
La dissolution d'un solide ionique s'effectue en trois étapes : - La dissociation (destruction du cristal par les molécules d'eau (sous l'action des forces.
 Tableau de certains ions polyatomiques Formules Constantes et
Tableau de certains ions polyatomiques Formules Constantes et
Tableau de certains ions polyatomiques. Formules. Constantes et conversions. Solubilité des composés ioniques dans l'eau à 25 °C. Ions -.
 ACTIVITÉ 1 : Effet thermique de la dissolution de composes
ACTIVITÉ 1 : Effet thermique de la dissolution de composes
ACTIVITÉ 1 : Effet thermique de la dissolution de composes ioniques dans l'eau. 1. Présentation. Le « froid » peut être utile en secourisme particulièrement en
 SOLUTIONS AQUEUSES IONIQUES
SOLUTIONS AQUEUSES IONIQUES
Solution aqueuse. Une solution aqueuse est un mélangehomogène obtenu par la dissolution dans l'eau de composés ioniques. L'eau est le solvant et les composés
 Ch 10 - La dissolution
Ch 10 - La dissolution
On dissout n = 020 mol de saccharose C12H22O11 dans de l'eau distillée de manière à fortement les forces de Coulomb entre les ions : le composé ionique.
 La dissolution du composé solide FeCl3(s) dans leau donne
La dissolution du composé solide FeCl3(s) dans leau donne
Filtrer la solution obtenue sur papier filtre. Données : les ions nitrate NO3. -. (aq) et les ions fer III Fe3+. (aq)
 Fiche de synthèse n° 2.c Solvants et solutions
Fiche de synthèse n° 2.c Solvants et solutions
Les interactions qui s'établissent entre le soluté et l'eau sont de type interactions de van der Waals. 2.2. Dissolution d'un composé ionique.
 ( )3(s)
( )3(s)
Nommer les trois étapes de la dissolution d'un composé ionique dans l'eau Ecrire les équations de dissolution dans l'eau des espèces ioniques suivantes ...
 LA DISSOLUTION DUN SOLIDE IONIQUE DANS LEAU
LA DISSOLUTION DUN SOLIDE IONIQUE DANS LEAU
Un solvant apolaire est un solvant dont le moment dipolaire résultant est nul. Il peut donc s'agir d'une molécule ne comportant aucun groupement polaire
 [PDF] Fiche 4 : Les composés ioniques
[PDF] Fiche 4 : Les composés ioniques
La dissociation d'un composé ionique se décompose en 3 étapes étudions la dissociation du chlorure de sodium dans l'eau : • La dissociation
 [PDF] Dissolution de composés ioniques ou moléculaires
[PDF] Dissolution de composés ioniques ou moléculaires
La dissolution d'un solide ionique s'effectue en trois étapes : - La dissociation (destruction du cristal par les molécules d'eau (sous l'action des forces
 [PDF] 2) Formules des corps ioniques solides : 3)Les molécules polaires
[PDF] 2) Formules des corps ioniques solides : 3)Les molécules polaires
Nom du composé ionique Sa formule statistique Sa formule ionique Chlorure de sodium 2)Dissolution du chlorure de sodium dans l'eau : a) Expérience :
 [PDF] Les réactions en milieu aqueux - La chimie
[PDF] Les réactions en milieu aqueux - La chimie
les composés ioniques sont des électrolytes forts • un acide fort est aussi un électrolyte fort car il se dissocie complètement en solution aqueuse
 [PDF] 2nde-TPC9-ComposesIoniquespdf - Labo TP
[PDF] 2nde-TPC9-ComposesIoniquespdf - Labo TP
Dissolution de composés ioniques : Certains composés ioniques peuvent se dissoudre facilement dans l'eau ? Dans un navigateur internet ouvrir l'animation
 [PDF] Chapitre 1 : Leau et les solutions aqueuses
[PDF] Chapitre 1 : Leau et les solutions aqueuses
Le moment dipolaire d'une liaison O-H dans l'eau est égal à 151 D La molécule d'eau composé ionique capable de se dissoudre dans un litre de solution
 [PDF] Identifier les ions d - Meck-anique
[PDF] Identifier les ions d - Meck-anique
les ions dans une eau minérale-Déterminer la formule d'un composé ionique Introduction : Les eaux naturelles contiennent de nombreuses espèces ioniques
 [PDF] Modèle solides moléculaires et composés ioniques en solution
[PDF] Modèle solides moléculaires et composés ioniques en solution
On peut représenter un solide de la façon suivante Un solide ionique est constitué d'ions bien ordonnées au contact les uns des autres Lors de la dissolution
 [PDF] Tableau de certains ions polyatomiques Formules Constantes et
[PDF] Tableau de certains ions polyatomiques Formules Constantes et
Tableau de certains ions polyatomiques Formules Constantes et conversions Solubilité des composés ioniques dans l'eau à 25 °C Ions - 1 Ions - 2 Ions
 [PDF] LA DISSOLUTION DUN SOLIDE IONIQUE DANS LEAU - Free
[PDF] LA DISSOLUTION DUN SOLIDE IONIQUE DANS LEAU - Free
Un solvant apolaire est un solvant dont le moment dipolaire résultant est nul Il peut donc s'agir d'une molécule ne comportant aucun groupement polaire
Quels sont les composés ioniques ?
Les composés ioniques sont des solides constitués de plusieurs ions - anions et cations - reliés entre eux par des liaisons chimiques appelées « liaisons ioniques ». Ainsi le sel de cuisine - ou chlorure de sodium - est un composé ionique de formule NaCl.Comment un composé ionique se dissout dans l'eau ?
La dissolution d'un solide ionique s'effectue en trois étapes : - La dissociation (destruction du cristal par les molécules d'eau (sous l'action des forces électrostatiques). - l'hydratation des ions -la dispersion des ions: Les ions sont entourés d'un cortège de molécules de solvant qui les isole les uns des autres.Pourquoi les composés ioniques sont solubles dans l'eau ?
Solubilité des sels minéraux
La dissolution des composés ioniques ou polaires opère par association des molécules d'eau avec les cations via l'atome d'oxygène et avec les anions via l'atome d'hydrogène.- 1Un composé ionique est un solide qui est constitué d'un empilement régulier d'anions et de cations.2L'électroneutralité d'un composé ionique est assurée par l'égalité des charges positives et négatives qui la constituent.3Le nom d'un composé ionique commence par celui de l'anion et se termine par celui du cation.
1èreSTL ʹ PCM Fiche de synthèse - Séquence 2 : solvants et solutés
2.c. solvants et solutions
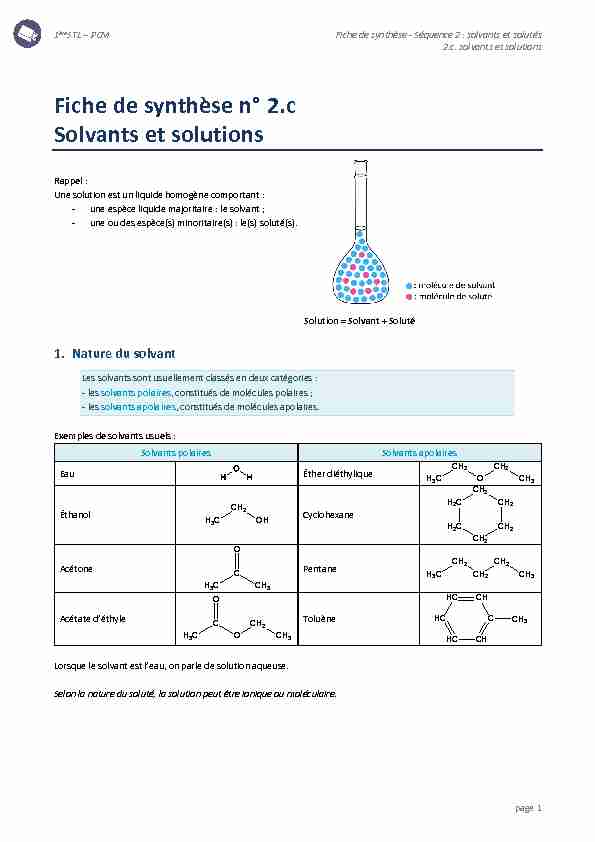
page 1Rappel :
Une solution est un liquide homogène comportant : - une espèce liquide majoritaire : le solvant ; - une ou des espèce(s) minoritaire(s) : le(s) soluté(s).Solution = Solvant + Soluté
1. Nature du solvant
Les solvants sont usuellement classés en deux catégories : - les solvants polaires, constitués de molécules polaires ; - les solvants apolaires, constitués de molécules apolaires.Exemples de solvants usuels :
Solvants polaires Solvants apolaires
Eau Éther diéthylique
Éthanol Cyclohexane
Acétone
Pentane
Toluène
Selon la nature du soluté, la solution peut être ionique ou moléculaire. H3C CH2 O CH2CH3H3C
CH2 OH H2C H2C CH2 CH2 CH2 CH2 H3C C CH3 O H3C CH2 CH2 CH2CH3H3C
C O CH2 CH3 OHC HC HCCH C CH CH31èreSTL ʹ PCM Fiche de synthèse - Séquence 2 : solvants et solutés
2.c. solvants et solutions
page 22. Dissolution
A(s), (l) ou (g) ՜ A(solvaté)
Remarque :
solution aqueuse.La dissolution se déroule en trois étapes :
- la dissociation, au cours de laquelle les forces intermoléculaires entre les molécules de soluté (molécules
du composé moléculaire A) sont rompues ;- la solvatation, au cours de laquelle de nouvelles interactions entre les molécules de soluté et celles du
solvant sont créées ; solvatent se dispersent dans le liquide. Illustration des étapes de dissociation et de solvatation pour un composé moléculaire : interactions de solvatation, de type interactions de van der Waals et liaisons hydrogène.Remarque :
apolaire est généralement soluble dans un solvant apolaire.Dissociation
Solvatation
CohĠsion assurĠe par des
forces intermolĠculairesRupture des forces
intermolĠculaires Nouvelles interactions1èreSTL ʹ PCM Fiche de synthèse - Séquence 2 : solvants et solutés
2.c. solvants et solutions
page 3(même si elles ne sont pas représentées ici). Les interactions de van der Waals existent toujours quelle que soit la nature
du soluté ou du solvant. Exemple 2 : Dissolution du diiode dans le cyclohexane Le diiode, composé apolaire, est soluble dans le cyclohexane :AxBy(s) ՜ x Ap+(aq) + y Bqʹ(aq)
trois étapes suivantes : la dissociation, la solvatation et la dispersion.Remarque :
Illustration des étapes de dissociation et de solvatation pour un composé ionique :NaCl(s) Na+(aq) + Clʹ(aq)
CaCl2(s) Ca2+(aq) + 2 Clʹ(aq)
DissociationSolvatation
1èreSTL ʹ PCM Fiche de synthèse - Séquence 2 : solvants et solutés
2.c. solvants et solutions
page 43. Bilan de matière
Le bilan de matière est le calcul qui permet de déterminer la quantité de matière de toutes les espèces
chimiques qui prennent part à la transformation.1 CaCl2(s) ՜ 1 Ca2+(aq) + 2 Clʹ(aq)
Clʹ sont libérés.
totalement dissous, il atteint une valeur limite appelée avancement maximal, notée xmax. dans une transformation chimique.Chaque ligne précise les quantités de matière de chacun des composés dans un état donné.
On distingue :
Équation chimique : 1 CaCl2(s) ՜ 1 Ca2+(aq) + 2 Clʹ(aq)quotesdbs_dbs30.pdfusesText_36[PDF] hydroxyde de plomb
[PDF] pb(oh)2
[PDF] exercice solubilité et précipitation
[PDF] chlorure de sodium 0 9 pour les yeux
[PDF] peut on mettre du chlorure de sodium dans les yeux
[PDF] nacl 0 9 laboratoires gilbert
[PDF] chlorure de sodium pour lavage des yeux
[PDF] nacl 0 9 gilbert
[PDF] chlorure de sodium 0
[PDF] 9% nez
[PDF] nacl 0 9 oreille
[PDF] nacl 0 9 non injectable
[PDF] chlorure de sodium gelule indication
[PDF] nacl sachet 1g
