 Chromatographie Ionique
Chromatographie Ionique
Le principe de la chromatographie ionique est basé sur les propriétés des résines Sur la résine échangeuse d'ions conditionnée sous forme d'une colonne.
 Chromatographie échangeuse dions
Chromatographie échangeuse dions
Dans l'échange d'anions la phase stationnaire est chargée positivement tandis que dans l'échange de cations
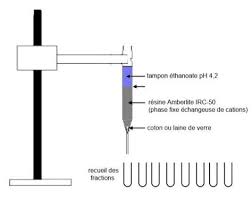 Chromatographie échangeuse dions principe
Chromatographie échangeuse dions principe
Chromatographie échangeuse d'ions principe. Chromatographe ionique de Metrohm. La chromatographie par échange d'ions (IC Ion-exchange Chromatography)
 Chromatographie sur Colonne
Chromatographie sur Colonne
Ion exchange chromatography. • L'echangeur d'ions contient des groupes chargés echangeuse d'ions exp:proteines. 1-choix de la résine : R+ ou R-. 2-choix du ...
 TECHNIQUES: Principes de la chromatographie
TECHNIQUES: Principes de la chromatographie
Chromatographie échangeuse d'ions. Chromatographie d'exclusion. Page 3. 3. 5. Chromatographies d'adsorption. Phase mobile. Nom. Gaz. Chromatographie en phase.
 Chromatographie échangeuse dions
Chromatographie échangeuse dions
Principe Ce procédé de séparation est basé sur des processus d'échange d'ions se produisant entre les analytes dans la phase mobile et la résine fixée sur la
 AT Chromatographies
AT Chromatographies
(Extrait du site : ac rouen Galilée chromatographie). DOCUMENT 2 : principe de la chromatographie d'échange d'ions et détail de la résine cationique. C'est
 SÉPARATION DES OSES
SÉPARATION DES OSES
- Pour la chromatographie. Utiliser la résine échangeuse d'anions forte Technicon du Type Chromobead S dont les grains ont une taille moyenne de 20 microns.
 The isotope separation by ion exchange chromatography
The isotope separation by ion exchange chromatography
chromatographie ionique ; sur le meme principe le CEA et la COGEMA ont developpe la separation du. Dans ce qui suit nous aliens decrire la demarche d'6tude
 Dosage des acides organiques et anions mineraux dans les vins
Dosage des acides organiques et anions mineraux dans les vins
Le développement de la chromatographie ionique haute performance dans les laboratoires a permis d'étudier le dosage par cette technique des acides.
 Chromatographie Ionique
Chromatographie Ionique
Le principe de la chromatographie ionique est basé sur les propriétés des résines échangeuses d'ions qui permettent une fixation sélective des anions ou des
 Chromatographie échangeuse dions
Chromatographie échangeuse dions
Chromatographie échangeuse d'ions. 1. Principe. Le critère de l'ionicité des molécules donne lieu aux techniques de chromatographie d'échange.
 Chapitre II : La chromatographie
Chapitre II : La chromatographie
La chromatographie échangeuse d'ion (Chromatographie Ionique). Principe : Les échangeurs d'ions sont des macromolécules insolubles portant des groupements
 2-Chromatographie.pdf
2-Chromatographie.pdf
compétitionner pour les sites de liaison de l'échangeur d'ions. - ces deux principes peuvent être utilisés pour purifier une protéine donnée parmi un.
 HbA1c :
HbA1c :
PRINCIPE DU DOSAGE / HISTORIQUE DES TECHNIQUES. Certaines techniques reposent sur la ( CHLP)électrophorèses
 TECHNIQUES: Principes de la chromatographie
TECHNIQUES: Principes de la chromatographie
Il est rare de pouvoir associer une méthode chromatographique à un seul phénomène. 4. Types de chromatographies. Chromatographie échangeuse d'ions.
 SÉPARATION DES OSES DES DI- ET TRIHOLOSIDES PAR
SÉPARATION DES OSES DES DI- ET TRIHOLOSIDES PAR
1 janv. 1974 PAR CHROMATOGRAPHIE D'ÉCHANGE D'IONS ... Principe. Les glucides sont séparés sur une colonne de résine échangeuse d'anions thermostatée à ...
 Diapositive 1
Diapositive 1
La chromatographie en phase liquide et supercritique: Généralités reposent les principes de séparation ... Trois types de résine échangeuse d'ions.
 Initiation à la chromatographie déchange dions appliquée à la
Initiation à la chromatographie déchange dions appliquée à la
Il s'agit de mettre au point une élution en gradient de force ionique et/ou une élution par paliers de forces ioniques croissantes permettant la sortie
 SEPARATIONS DES ACIDES AMINES
SEPARATIONS DES ACIDES AMINES
Chromatographie d'échange d'ions: La phase stationnaire est composée d'une résine qui peut être. - chargée positivement (échangeuse d'anions).
 [PDF] Chromatographie Ionique
[PDF] Chromatographie Ionique
Le principe de la chromatographie ionique est basé sur les propriétés des résines échangeuses d'ions qui permettent une fixation sélective des anions ou des
 [PDF] Chromatographie échangeuse dions - E-learning
[PDF] Chromatographie échangeuse dions - E-learning
Principe Le critère de l'ionicité des molécules donne lieu aux techniques de chromatographie d'échange d'ions la chromatographie d'échange d'ions sépare
 Chromatographie échange ions ????????????? ??????? ???????
Chromatographie échange ions ????????????? ??????? ???????
La chromatographie d'échange d'ions sépare les protéines en fonction de leur charge de surface nette grâce à des interactions électrostatiques qui se
 Chromatographie à échange dions - Wikipédia
Chromatographie à échange dions - Wikipédia
La chromatographie par échange d'ions sépare les molécules selon leurs groupes chargés respectifs Les ions de l'analyte subissent des interactions ioniques
 [PDF] es dions - Lavoisierfr
[PDF] es dions - Lavoisierfr
Cet ouvrage se veut avant tout un outil à l'attention des élèves de l'enseigne- ment supérieur souhaitant approfondir leurs connaissances de la chromatographie
 Chromatographie préparative échangeuse dions*
Chromatographie préparative échangeuse dions*
Rappels sur le principe (fiche à télécharger : les méthodes chromatographiques) Première partie - Séparation par chromatographie échangeuse d'ions
 [PDF] Initiation à la chromatographie déchange dions appliquée à la
[PDF] Initiation à la chromatographie déchange dions appliquée à la
Le document annexe “chromatographie d'échange d'ions et élution en gradient de force ionique” rappelle quelques points techniques fondamentaux 2 1 Matériel et
 [PDF] Chromatographie sur Colonne
[PDF] Chromatographie sur Colonne
Ion exchange chromatography • L'echangeur d'ions contient des groupes chargés • Si la nature de la resine est acide elle agira avec des proteins chargées
 [PDF] La chromatographie ionique - Horizon IRD
[PDF] La chromatographie ionique - Horizon IRD
En chromatographie ionique les vitesses de migration sont fonction principalement de la taille des ions et de leur charge· électrique et dépendent aussi
 [PDF] Chromatographie - L3 Chimie Dijon
[PDF] Chromatographie - L3 Chimie Dijon
La chromatographie par échange d'ions ou chromatographie ionique : la phase stationnaire est une résine échangeuse d'ions (polymère porteur de groupements
Quel est le principe de la chromatographie d'échange d'ions ?
Le principe de la chromatographie ionique est basé sur les propriétés des résines échangeuses d'ions qui permettent une fixation sélective des anions ou des cations présents dans une solution. Sur la résine échangeuse d'ions conditionnée sous forme d'une colonne chromatographie circule en permanence un éluant.Qu'est-ce que la chromatographie sur résine échangeuse d'ions ?
La chromatographie échangeuse d'anions est une forme de chromatographie d'échange d'ions (IEX), qui est utilisée pour séparer les molécules en fonction de leur charge de surface nette.Quelles sont les étapes à réaliser pour effectuer une chromatographie d'échange d'ions ?
Chromatographie d'échange ionique est un processus en deux étapes. Dans un premier temps, l'échantillon est chargé sur la colonne dans un tampon de charge. La liaison de l'échantillon chargée à la résine de colonne est basée sur des interactions ioniques de la résine pour attirer l'échantillon de charge opposée.- La chromatographie est une technique séparative analytique et/ou préparative. Elle consiste à faire migrer les constituants à séparer sur une phase stationnaire immobile, à l'aide d'une phase mobile, liquide ou gazeuse, de nature différente.
 Les AA constitutifs des protéines, sont libérés par hydrolyse. Un hydrolysat protéique, obtenu après ébullition dans lacide chlorhydrique (HCl) prolongé (6N) est un mélange dAA quil importe didentifier et de doser.
Les AA constitutifs des protéines, sont libérés par hydrolyse. Un hydrolysat protéique, obtenu après ébullition dans lacide chlorhydrique (HCl) prolongé (6N) est un mélange dAA quil importe didentifier et de doser. SEPARATIONS DES ACIDES AMINES
Les méthodes de séparations les plus utilisées sont:Méthodes électrophorétiques;
Méthodes chromatographiques
1 / chromatographies de partage;
L'électrophorèse est une technique biochimique de séparationfondée sur le fait que des molécules portant des charges électriques différentes migrentà des vitesses différentes lorsqu'elles sont placées dans un champ électrique.
l'électrophorèse est devenue une technique de routinedans les laboratoires où on l'utilise pour séparer notamment les protéines et les acides nucléiques.
L'électrophorèse des protéines peut être réalisée sur des supports variés, notamment sur gel de polyacrylamide ou sur geld'agarose 11
Deux facteurs vont influencer la migration des protéines: leur charge et leur taille.Plus la protéine est chargée plus sa migration sera importante. Au contraire plus la protéine sera grosse moins sa migration sera importante. Le sens de migration de la protéine va dépendre de son pI (point isoélectrique).En fonction du pH la protéine sera chargée positivement ou négativement, elle migrera donc vers lanode (chargée +) ou la cathode (chargée -). migration protéines chargées -migration protéines chargées +dépôtanode +cathode-Cuve pour électrophorèse clinique
Préparation du gel et dépôt des
échantillons
Les gels supportés prêts à l'emploi sont
constitués d'une mince couche d'agarose coulée sur un support plastique de 100 mm x 75 mm permettant leur manipulation aisée.Une fois le gel sorti de son emballage, la zone
de dépôt est essorée avec une bande de papier filtre pour faciliter la diffusion deséchantillons lors du dépôt.
Essorage de la zone de dépôt
La bande est ensuite retirée et jetée et
on dispose à la même place un masque de dépôt formé d'une bande de plastique comportant 10 fentes.Mise en place du masque de dépôt
Dépôt des échantillonsEssorage du liquide en excèsUnvolumede5µLdeséchantillonsà
analyserestdéposésurlesfenteset abandonnépendant5minutespourassurerLeliquidenonabsorbéparlegelest
ensuiteessoréavecuneautrebande depapierfiltreetlemasquede dépôtestjeté.Gel en place dans la cuve
Phase de migration
Le gel est alors mis en place dans la cuve et puis après fermeture du couvercle et mise en marche de lalimentation, la migration des protéines démarreLa tension appliquée au gel et le temps de
migration dépendent de la nature des échantillons à analyser.Ensemble du dispositif d'électrophorèse
Fixation et coloration
colorant. protéinesséparées.Décoloration du fond
Le gel est ensuite séché ce qui permet de
le conserver dans de bonnes conditions. lecture desfractions.Tracé densitométrique du
protéinogramme d'un sérum humain normalCHROMATOGRAPHIE SUR PAPIER.
CHROMATOGRAPHIE SUR COUCHE MINCE.
CHROMATOGRAPHIE EN PHASE GAZEUSE.
CHROMATOGRAPHIE SUR ECHANGEUR D'IONS.
La purification des protéines
La chromatographie est une technique de séparationqui utilise un support qui possède des propriétés physico-chimiquesparticulières. Ce support va retenir les protéines en fonction de critères variables. -en fonction de la charge des protéines. -en fonction de leur affinitépour des molécules (ligands). -en fonction de leur taille.Chromatographie sur colonne:réservoir
colonne phase stationnaireSolvant
(phase mobile) collecteur La phase stationnaire est composée dune résine qui peut être -chargée positivement (échangeuse danions) -chargée négativement (échangeuse de cations) -Les interactions molécules-colonne vont dépendre de la charge des molécules. Ces interactions pourront être modulées par le pH et la force ionique (concentration en sels) du milieu. CH2C OOCH2SO3-
C2H4N +C2H4 C2H4 H -étape 1:la colonne (chargée négativement) est équilibrée avec une solution faiblement concentrée en sels. Les cations de la solution (ici Na+) vont se fixer sur les charges négatives de la phase stationnaire. SO3- Na+Bille de résine
Exemple dune purification par échange de cations: séparation de 3 acides aminés Ser, Aspet Lys-étape 2: la solution contenant le mélange des molécules à séparer est déposée sur la
colonne. Ce sont les molécules présentes en plus grande concentration qui se fixent à la colonne. Ici, les groupement chargés positivement vont se fixer à la colonne à la place des ions Na+ Asp Lys Ser CH CH2 CH2 CH2 CH2 NH3+COO-NH3+
NH3+CHCOO-
CH2 COO-NH3+CHCOO-
CH2OH -étape 3: On élue (on rince) la colonne avec une solution de NaClun peu plus concentrée. Les ions Na+étant plus nombreux que précédemment ils vont entrer en compétition avec les acides aminés pour se fixer sur la colonne. Ils vont remplacer tout dabord les acides aminés les moins positifs.NH3+CHCOO-
CH2OHNH3+CHCOO-
CH2 COO- CH CH2 CH2 CH2 CH2 NH3+COO-NH3+
Asp Lys Ser -étape 4: On augmente la concentration en NaCl La concentration en Na+étant plus forte, seuls les acides aminés les plus chargés vont rester fixés à la colonne.NH3+CHCOO-
CH2OH CH CH2 CH2 CH2 CH2 NH3+COO-NH3+
Lys Ser -étape 5:On augmente encore la concentration en NaClde léluant. Les ions Na+sont en large excès, ils vont remplacer toutes les molécules qui étaient encore sur la colonne. CH CH2 CH2 CH2 CH2 NH3+COO-NH3+
Lys On a rincé la colonne avec un gradient de concentration en NaCl 12341-2: On dépose le mélange, les molécules les plus chargées se fixent tout de suite alors que
les moins chargées se fixent plus bas.3-4: On rince la colonne avec une solution de NaClde concentration croissante. On
décroche successivement les différentes molécules. pour décrocher les différents acides aminés.On aurait également pu
concentration en NaClconstante. En fonction de leur pKarespectifs les acides aminés auraient changé de charge et se seraient décrochés de la colonne. Le principe est strictement le même pour une protéine. On greffe sur la colonne une molécule qui interagit de1-2: Quand on met le mélange sur la colonne, seule la protéine qui peut interagir avec le ligand se fixe.
3-4: Pour décrocher la protéine de la colonne, on élue avec une solution contenant
le ligand. 213 4I) Définition
II) Importance biomédicale
III) Structure des peptides
La liaison peptidique
IV) Propriétés acidobasique des peptides
V) Etudes des séquences peptidiques
A) Clivage des ponts disulfures et séparations des chaînes peptidiques B) Détermination de la composition en AA dune chaîne polypeptidiqueC) Détermination de la séquence peptidique
a) Identification de lAA N terminal b) Identification de lAA C terminal c) Hydrolyse partielle des chaînes peptidiques VI) Etude de quelques peptides dintêretbiologiqueA) Les oligopeptides
B) Les polypeptides
formationd'unpeptide:DEFINITION
LIAISONPEPTIDIQUE
liaisonpeptidiqueHCl6N,120C,24h-72h.
H2N-CH-COOH + H2N-CH-COOH
-H2OCH3CH2
CHCH3CH3
H2N-CH-CO-HN-CH-COOH
CH3CH2
CHCH3CH3
Alanyl-Leucine.
La formule d'un peptide s'écrit, en commençant à partir de la gauche, par le résidu ayant son groupe aminé libre. Le dernier résidu à droite est donc celui dont le groupe carboxylique est libre. Si la liaison peptidique implique un COOH ou un NH2 situé dans une autreȕȖİ2) on parle de liaison peptidoïde.
peptides qui peuvent être administrés à des patients pour corriger leur déficit (insuline). Certains peptides agissent au niveau du système nerveux, comme neurotransmetteurs. Certains antibiotiques sont des peptides comme la valinomycineet la gramicidineA. nombreuses boissons.II) IMPORTANCE BIOMEDICALE
ausensdelasynthèsedesprotéines. Dans des études par des rayons X de peptides cristallisés, PAULING etCOREYont trouvé que:
La liaison du carbone carbonyle avec l'azote dans la liaison peptidique (1,32 Å ) est plus courte que la liaison simple C-N (1,49 Å ) mais plus longue qu'une liaison double C=N classique (1,27 Å ). La liaison peptidique peut , en fait sécrire de deux façons (formes mésomères) Les électrons du groupe carbonyle et le doublet électronique libre de l'azote sont très proches. La résonance de ces électrons donne au groupe peptidique des structures intermédiaires entre deux formes mésomères. III) PROPRIETES SPATIALES DE LA LIAISON PEPTIDIQUE deux formes de résonances : 70% sous forme simple et à 30% sous forme double. Ce caractère de double liaison entraîne une certaine rigidité et empêche la libre rotation. la configuration trans est la plus stable car minimisation de lencombrement stérique des résidus.quotesdbs_dbs30.pdfusesText_36[PDF] chromatographie de partage
[PDF] chromatographie sur colonne
[PDF] avantages inconvénients chromatographie ionique
[PDF] electrophorese
[PDF] chromatographie d'exclusion
[PDF] chromatographie d'exclusion stérique polymère
[PDF] chromatographie gel filtration
[PDF] chromatographie d'exclusion stérique exercice
[PDF] chromatographie dexclusion exercice corrigé
[PDF] volume hydrodynamique
[PDF] chromatographie par perméation de gel (gpc)
[PDF] exercice chromatographie corrigé pdf
[PDF] qcm sur la chromatographie
[PDF] qcm chromatographie chimie analytique
