 Exercices de nomenclature organique Corrigés
Exercices de nomenclature organique Corrigés
5 substituants : 4 méthyle et 1 éthyle. Page 4. OS Chimie. Corrigé des exercices. - 4 -.
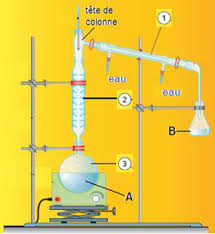 nomenclature : alcanes & alcool (5 pts) Exercice 5 : Distillation
nomenclature : alcanes & alcool (5 pts) Exercice 5 : Distillation
nomenclature : alcanes & alcool (5 pts). Partie 1 : alcanes. 1 ) Nommer les Exercice 5 : Distillation fractionnée d'un mélange d'alcanes (75 pts). On ...
 Licence 2 (Parcours Physique-Chimie) Année 2016-2017 TD2
Licence 2 (Parcours Physique-Chimie) Année 2016-2017 TD2
TD2 : Alcanes alcènes et alcynes. Exercice 1 : Donner un nom aux hydrocarbures Exercice 4 :Nommer selon la nomenclature IUPAC les hydrocarbures ci-dessous :.
 LES ALCANES
LES ALCANES
Nomenclature des alcanes. La nomenclature des composés chimiques obéit à des règles définies par l'Union Internationale de Chimie. Pure et Appliquée (U.IC
 2. La nomenclature des alcanes Exemple : On veut déterminer le
2. La nomenclature des alcanes Exemple : On veut déterminer le
La nomenclature des alcanes. Exemple : On veut déterminer le nom de cette Exercice 3 : Nommer les alcanes suivants et donner leurs formules brutes. 1.
 NOMENCLATURE EN CHIMIE ORGANIQUE 1. Hydrocarbures (HC
NOMENCLATURE EN CHIMIE ORGANIQUE 1. Hydrocarbures (HC
b) Trouver la structure d'une molécule connaissant le nom. 1. Hydrocarbures (HC) saturés acycliques : les alcanes. Les hydrocarbures saturés ne sont formés
 Devoirs : Les alcanes
Devoirs : Les alcanes
On recherchait les composés du gazole …. Exercice 1 : I can all ! / 12 pts. Nommer les alcanes suivants : 1
 Fiche exercices sciences physiques et chimiques Chapitre 3
Fiche exercices sciences physiques et chimiques Chapitre 3
Exercice 1 : Nomenclature des alcanes. Exercice 2 : Nomenclature des alcools. Mr Duthoit. Lycée M. Yourcenar – Beuvry. 2016-2017. Page 2. Thème Comprendre.
 SERIE 2 : LES ALCANES
SERIE 2 : LES ALCANES
Même question pour les alcanes de formule C5H10 et C8H18. EXERCICE 2 : NOMENCLATURE. Donner la formule semi-développée des composés suivants : a°) 3-éthyl
 Exercices résolus - de chimie organique - Les cours de Paul Arnaud
Exercices résolus - de chimie organique - Les cours de Paul Arnaud
Formule moléculaire de l'alcane à vingt-cinq atomes de carbone : C25H52. Il y a donc un atome d'hydrogène en trop par rapport au maximum autorisé. • C2H2Cl6.
 [PDF] Exercices sur les alcanes et les alcools Lycée Maurice Ravel
[PDF] Exercices sur les alcanes et les alcools Lycée Maurice Ravel
Exercices sur les alcanes et les alcools Exercice 3 : 4 Ecrire la formule brute du 2-methylpropane 5 Ecrire la formule semi-développée de cette molécule
 [PDF] nomenclature : alcanes & alcool (5 pts) Exercice 5
[PDF] nomenclature : alcanes & alcool (5 pts) Exercice 5
nomenclature : alcanes alcool (5 pts) Partie 1 : alcanes Exercice 5 : Distillation fractionnée d'un mélange d'alcanes (75 pts)
 [PDF] 2 La nomenclature des alcanes Exemple - Picassciences
[PDF] 2 La nomenclature des alcanes Exemple - Picassciences
La nomenclature des alcanes Exemple : alcanes linéaires Exercice 3 : Nommer les alcanes suivants et donner leurs formules brutes
 [PDF] Exercices de nomenclature organique Corrigés
[PDF] Exercices de nomenclature organique Corrigés
Corrigé des exercices - 1 - Exercices de nomenclature organique Corrigés 1 Dessinez la formule développée des molécules suivantes : a) (CH3)2CHCH2OH
 [PDF] chapitre 6 structure des entités organiques - EXERCICES
[PDF] chapitre 6 structure des entités organiques - EXERCICES
1 NOMENCLATURE GROUPES FONCTIONNELS Exercice Énoncé D'après Hatier 2019 Nommer les quatre alcanes suivants à partir de leurs formules semi-développées
 [PDF] chimie organique - Dunod
[PDF] chimie organique - Dunod
Nomenclature des alcanes 4 ? 1 4 Nomenclature des autres molécules quoi cet ouvrage propose un cours concis mais complet des exercices et des QCM
 [PDF] Devoirs : Les alcanes - Free
[PDF] Devoirs : Les alcanes - Free
Exercice 1 : I can all ! Ecrire la formule semi-développée des alcanes suivants : 5 Octane alcanes du tableau ci-dessous (justifier): Alcane
 [PDF] TD CH13 Les différentes familles de molécules organiques
[PDF] TD CH13 Les différentes familles de molécules organiques
Première S CH13 Nomenclature des molécules organiques page 201 9 Exercices chimie organique Feuille Première S Alcanes alcènes alcynes Exercice 1 Le
 [PDF] Exercice de révision sur la nomenclature des alcanes et des alcools
[PDF] Exercice de révision sur la nomenclature des alcanes et des alcools
2013\1s\exercices\revision_nomenclature_alcane_alcool docx Exercice de révision : nomenclature alcanes et alcools 1) Rappeler sur une fiche les règles de
 [PDF] correction exercices de revision : les alcanes - PC-STL
[PDF] correction exercices de revision : les alcanes - PC-STL
CORRECTION EXERCICES DE REVISION : LES ALCANES Exercice 1 (Monochloration du 2-méthylbutane) 1 Pour la réalisation d'une monochloration les alcanes
Fonction
organique Formule générale TerminaisonRègle de nomenclature Exemples
Alcool
olOn remplace le e final de l"alcane correspondant par ol précédé du numéro de position du groupe hydroxyde OH. OH a priorité pour la numérotation de chaîne.
Aldéhyde
R-CHO ...alOn remplace le e final de l"alcane
correspondant par al précédé .Ce groupement se trouve toujours
en bout de chaîne : pas de position à préciserCétone
...one On remplace le e final de l"alcane correspondant par one précédé du numéro de position du groupe carboxyle CO.CO a priorité pour la
numérotation de chaîne. Acide carboxyliq ue RCOOH ou RCO 2HAcide ... oïque
On remplace le e final de l"alcane
correspondant par oïque, le nom est précédé du mot acide.Ce groupement se trouve toujours
en bout de chaîne : pas de position à préciser.RCOOH a priorité pour la numérotation. EsterR1 - COO-R2
oate.. yle Partie1: R1-C On remplace le e final de l"alcane correspondant par oatePartie2 :
R2 On remplace le e
final de l"alcane correspondant par oyle.Associer les deux noms.
Amine R-NH2 ...
amine On ajoute au nom de l"alcane correspondant le motamine. Première S CH13 Nomenclature des molécules organiques page 201 2 Première S CH13 Nomenclature des molécules organiques page 201 3 Première S CH13 Nomenclature des molécules organiques page 201 4 Première S CH13 Nomenclature des molécules organiques page 201 5EXERCICES LES HYDROCARBURES
Exercice n° 1 :
Donner le nom des hydrocarbures suivants, indiquer pour chacun d"eux la famille d"hydrocarbure à laquelle il
appartient et vérifier si la formule brute du composé correspond bien à la formule générale de la famille.
C 2H5 a) CH3-CH2-CH3 b) CH3-CH-CH=CH2 c) CH3-CH=CH-C-CH2-CH3
CH3 CH3
C2H5 C2H5
d) CH3-CH-CH-CH2-CH3 e) CH3-CºC-CH-CH3 f) CH3-CH2-CH-CH-C-CH2-CH3
C2H5 CH3 CH3CH3CH3
Exercice n° 2 :
Donner la formule semi-développée des hydrocarbures dont les noms suivent : a) 2-méthylhex-3-ène b) 2,4-diméthylpentane c) 4,5-diéthyl-3-méthyloctane d) heptane e) 2-méthylpent-2-ène f) 2,2-diméthylbutane g) propène h) diméthylpropaneExercice n° 3 :
Donner la formule semi-développée des hydrocarbures dont les noms suivent : a) 3-méthylbut-1-yne b) 3-éthyl-2-méthylhex-3-ène c) 4-éthylhept-1-yned) 3-éthyl-2-méthylpentane e) 4,5-diméthylhex-2-yne f) 2-éthyl-3,4-diméthylpent-2-ène
Exercice n° 4 :
Donner le nom des hydrocarbures suivants :
CH3 C2H5 CH3 -CH2-CH2 C2H5
a) CH3-C=CH2-CH-CH3 b) CH3-CºC-CH- CH-CH3 c) CH3 -CH-CH -C-CH2-CH3
CH3 CH3 CH3 CH3
Exercice n° 5 :
Certains composés d"usage courant sont des hydrocarbures :1) L"acétylène est un gaz utilisé dans les chalumeaux oxyacétylènique qui comportent une bouteille d"acétylène
et une bouteille de dioxygène sous pression. a) Chercher l"autre nom et la formule de l"acétylène b) La flamme du chalumeau est bleue, écrire l"équation-bilan de la combustion correspondante.c) Quelle masse d"eau sera dégagée par la combustion de 0,5 L d"acétylène si on considère que sous pression
une mole d"acétylène occupe un volume de 10 L?2) Les liquides correcteurs portent la mention : sans trichloroéthane, contient du méthylcyclohexane
Donner la formule semi-developpée de ces molécules.3) Le gaz de ville contient du méthane. Lorsqu"il alimente une gazinière, un des deux feux qui n"a pas été nettoyé
depuis longtemps produit une flamme jaune alors que l"autre produit une flamme bleue. a) Expliquer la cause de la couleur jaune de la flamme pour le premier feu .b) Ecrire l"équation-bilan des deux combustions et calculer dans chaque cas le volume de dioxygène nécessaire
pour brûler 200 g de méthane. c) Première S CH13 Nomenclature des molécules organiques page 201 6Exercice n° 6 :
On réalise la combustion du butane en présence de dioxygène.1) Comment peut-on identifier visuellement le type de combustion ?
2) La combustion réalisée est une combustion complète.
a) Donner l"équation-bilan de cette réaction. b) Calculer la masse molaire du butane. c) Quelle est la masse d"eau obtenue à partir de 20 grammes de butane ? d) Quel volume de dioxygène est nécessaire à la combustion de 500 mL de butane ?Exercice n° 7 :Nommer un alcane
2. Nommer un alcène
CH3-CH2-CH2-CH3
CH3-CH-CH3
CH3CH3-CH2-CH-CH2-CH3
CH3CH3-CH-CH-CH2-CH2-CH3
CH3 C2H5
CH3-CH-CH2-CH-CH2-
CH 3 CH3 CH 3-C- CH 3 CH3 CH3-CH2-C---CH-CH2-CH2-CH3
CH3 C2H5
CH2=CH-CH2-CH3
CH2=C-CH3
CH3CH3-CH=CH-
CH3CH2=CH-CH2-CH2-CH3 CH2=CH-CH-CH3
CH3CH2=C-CH2-CH3
CH3CH3-CH=CH-CH2-CH3 CH3-C=CH-CH3
CH 3 Première S CH13 Nomenclature des molécules organiques page 201 73. Nommer un alcyne
4. Divers.
Exercice n° 8
1) Dans les molécules suivantes indiquer le nombre d"atomes de carbone tétravalents, tétragonaux, trigonaux,
digonaux. a) CH3-CH2-CH3 b) CH2=CH-CH3 c) CH3-C-CH2-CH3
d) CH3-CH-CH3 e) CH3-CH-C ºCH
2) Nommer les molécules a, b, d et e.
3) Déterminer leurs masses molaires moléculaires.
Exercice n°9 :
1) Ecrire la formule semi-développée des composés suivants :
a) heptane b) 2-méthylpent-2-ène c) 4-éthylhept-1-yne d) 2,2-diméthylbutane e) 3-éthyl-2-méthylpentane f) propène g) 4,5-diméthylhex-2-yne h) 3-éthyl-2-méthylhex-3-ène2) Indiquer leurs formules brutes et vérifier qu"elles correspondent à la formule générale du cours.
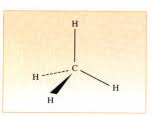
3) Représenter les molécules avec la convention de Cram.
OCH3 CH3
HCºC-CH2-CH3 CH3-CºC-CH3 HCºC-CH2-CH2-CH3HCºC-CH-CH3
CH3CH3-CºC-CH2-CH3
CH3 C2H5
CH3-CH2-CH--C-CH2-
CH 3CH3 CH3
CH2-CH=CH-C-CH2-CH3
CH3 CH3
CH2-CH2-CH2-C-CH=CH2
C2H5 CH3
CH3 CH3
CH2-CH2-CH2-C-CºCH
CH3CH3 CH3
CH2-CºC-C-CH2-CH3
C2H5 CH3
Première S CH13 Nomenclature des molécules organiques page 201 8Exercice n°10 :
1) Nommer les composés suivants :
a) CH3-C-CH3 b) CH3-CH2-CH=CH3 c) CH3-CH-CºCH2
2) Ecrire l"équation-bilan équilibrée de la réaction de combustion complète de chaque composé.
3) Calculer le volume de dioxygène produit par la combustion complète de 100 g de chaque composé.
4) Calculer la masse puis le volume d"eau ainsi produit.
5) Pour chaque molécule, rechercher la formule semi-développée d"un isomère et le nommer.
Exercice n°11 :
La combustion complète de 3,6g d"alcane produit 5,4g d"eau.1) Déterminer la formule brute et la masse molaire de cet alcane.
2) Donner les noms et les formules semi-développées des isomères de cet alcane.
DONNEES :
Volume molaire des gaz V
m=22,4L.mol-1Masse volumique de l"eau
r = 1000 g.L-1 CH3 CH3 C2H5 Première S CH13 Nomenclature des molécules organiques page 201 9 Exercices chimie organique Feuille Première SAlcanes, alcènes, alcynes
Exercice 1 Le craquage
Par craquage du cyclooctane C8H16, on obtient uniquement un composé non cyclique de formule C4H8.1. Ecrire l"équation chimique du craquage réalisé.
2. Donner tous les isomères de constitution du produit de craquage.
3. Parmi ces isomères, quels sont ceux qui présentent une isomérie Z/E ? Les dessiner en faisant apparaître
cette isomérie.Exercice 2 Test à l"eau de brome
Afin de déterminer la formule brute d"un alcène X, on mesure la quantité de dibrome consommée par réaction
d"addition. On observe que 2,1 g d"alcène décolorent complètement une solution contenant 8,0 g de dibrome.
1. Donner la formule générale d"un alcène.
2. Ecrire l"équation associée à la réaction d"addition.
3. La transformation a lieu dans des proportions stoechiométriques. En déduire la quantité de matière
d"alcène introduit, puis sa masse molaire.4. Donner la formule brute de X.
Données : M(Br
2)= 160.0 g.mol-1; M(C) = 12.0 g.mol-1; M(H)= 1.0 g.mol-1.
Exercice 3 Solvants chlorés
Le tableau ci dessous rassemble des données concernant quelques solvants chlorés.Solvant Formule
Température d"ébullition sous 1 bar
(°C) Production européenne en 1991 (t)Chlorométhane CH3Cl - 24 220 000
dichlorométhane CH2Cl2 40,1 234 000 trichlorométhane CHCl3 61 220 000 tétrachlorométhane CCl4 76 250 0001,1,2-trichloroéthylène Cl2C=CHCl 86,7 125 000
1,1,2,2-
tétrachloroéthylène Cl2C=CCl2 121,2 210 000
1,1,1-trichloroéthane H3C - CCl3 73,8 1980
Première S CH13 Nomenclature des molécules organiques page 201 101. Donner l"état physique des solvants du tableau à 25°C et sous 1 bar.
2. Le 1,1,2,2-tétrachloroéthylène peu être fabriqué par craquage d"un mélange de 1,1,2,2-tétrachloroéthane
Cl2HC - CHCl2 et de 1,1,1,2,2-pentachloroéthane Cl3C - CHCl2. Compléter les équations suivantes :
Cl2HC - CHCl2 --> Cl2C = CCl2 ......
Cl3C - CHCl2 --> Cl2C = CCl2 .......
3. Le chlorométhane CH
3Cl gazeux est synthétisé à 150 °C par action du chlorure d"hydrogène gazeux sur le
méthanol CH3OH gazeux, en présence d"alumine, qui sert de catalyseur. L"excès de chlorure d"hydrogène
est éliminé par passage dans une solution aqueuse d"hydroxyde de sodium. Le chlorométhane est ensuite
séché avec de l"acide sulfurique H2SO4, puis comprimé et liquéfié.
- Ecrire l"équation chimique de la transformation du méthanol en chlorométhane.- Par quel type de réaction de chlorure d"hydrogène en excès est-il éliminé ? Ecrire l"équation chimique de
cette transformation.- Calculer la quantité de matière de méthanol nécessaire à la production européenne de chlorométhane.
- Calculer en m3, le volume occupé par le chlorométhane formé s"il est stocké à 25°C, sous 1 bar.
Données : M (CH
3OH) = 32,0 g.mol-1.M (CH3Cl) = 50,5 g.mol-1.Volume molaire à 25°C sous 1 bar : Vm = 24,0
L.mol -1.Exercice 4
1. A partir de la formule brute C3H6O, combien peut-on construire de molécules ? On utilisera les règles de
l"octet et du duet pour déterminer les formules semi développées.2. Donner la géométrie autour de chaque atome de carbone.
Première S
Exercices chimie organique Feuille Première SCorrection exercice 1
C8H16 --> 2 C4H8. CH2=CH-CH
(CH3)2C=CH2 ; 2-méthylpropèneCorrection exercice 2
C nH2n. CnH2n + Br2 --> CnH2nBrQté matière Br2 : 8/ 160 = 0,05 mol donc 0,05 mol alcène de masse molaire 12 n + 2n = 14 n
Qté de matière (mol) = masse (g) / masse molaire (g/mol)0,05 = 2,1 / (14n) soit n = 3 C3H
Correction exercice 3
Gaz pour le chlorométhane ; liquide pour les autres à 25 °C sous 1 bar.Cl2HC - CHCl2 --> Cl2C = CCl2 + H2.
CH3OH + HCl --> CH3Cl + H2O
220 000 t = 2,2 1011 grammes
2,2 1011 / 35,5+12+3) = 4,36 109 mol
(12+4+16)* 4,36 109 =1,39 1011 g = 139 000 t volume chlorométhane (L) = Qté matière (mol) fois volume molaire (L/mol)4,36 109 *24 = 1,05 1011 L = 1,05 108 m
Correction exercice 4
CH3-CH2-CHO propanal ( aldehyde)
CH2=CH-CH2OH ; CHOH=CH
d"autres molécules :carbone tétragonal ( lié à 4 groupes d"atomes) :le carbone est au centre d"un tétraèdre et les quatre liaisons sont
dirigées vers les sommets du tétraèdrecarbone trigonal ( lié à 3 groupes d"atomes) : structure triangle plan ( angles proches de 120°)
Première S CH13 Nomenclature des molécules organiques page 201 Exercices chimie organique Feuille Première S CH2-CH3 but-1-ène ; CH3CH=CH-CH3 deux isomères Z et E du butBr2 ( dibromoalcane)
donc 0,05 mol alcène de masse molaire 12 n + 2n = 14 n Qté de matière (mol) = masse (g) / masse molaire (g/mol)H6 soit CH3-CH=CH2.(propène).
Gaz pour le chlorométhane ; liquide pour les autres à 25 °C sous 1 bar.Cl3C - CHCl2 --> Cl2C = CCl2+ HCl
Réaction acide base H3O+ + HO- --> 2H
n(mol) = m(g) / M (g/mol) m(méthanol)= M* n139 000 t.
volume chlorométhane (L) = Qté matière (mol) fois volume molaire (L/mol) m3.CH3-CO-CH3 acétone ou propanone ( cétone)
CHOH=CH-CH3 ( instable) ; CH2=C(OH)-CH3 (instable)carbone tétragonal ( lié à 4 groupes d"atomes) :le carbone est au centre d"un tétraèdre et les quatre liaisons sont
rbone trigonal ( lié à 3 groupes d"atomes) : structure triangle plan ( angles proches de 120°)
CH13 Nomenclature des molécules organiques page 201 11 Exercices chimie organique Feuille Première S deux isomères Z et E du but-2-ène donc 0,05 mol alcène de masse molaire 12 n + 2n = 14 n + HCl > 2H2O acétone ou propanone ( cétone) (instable)carbone tétragonal ( lié à 4 groupes d"atomes) :le carbone est au centre d"un tétraèdre et les quatre liaisons sont
rbone trigonal ( lié à 3 groupes d"atomes) : structure triangle plan ( angles proches de 120°)
quotesdbs_dbs21.pdfusesText_27[PDF] exercice nomenclature chimie organique licence
[PDF] exercice nomenclature terminale s pdf
[PDF] exercice nomenclature ts en ligne
[PDF] exercice nomenclature ts pdf
[PDF] exercice normalisation d un schéma relationnel
[PDF] exercice notion de fonction
[PDF] exercice notion de fonction seconde
[PDF] exercice nucléaire s5
[PDF] exercice numérisation de l'information terminale s
[PDF] exercice nutrition bactérienne
[PDF] exercice opération unitaire absorption
[PDF] exercice opération unitaire séchage
[PDF] exercice optimisation dérivée
[PDF] exercice optimisation secondaire 5
