 Oxydant Réducteur E0 (Volt)
Oxydant Réducteur E0 (Volt)
Table des potentiels standard Ox+ne-?Red à 25°C et à p=101kPa Cl2(g) +4 H2O ... Cl-+6OH-. 0.62. I2(aq)+2 e-. 2I-. 0.62. Hg2SO4+2 e-. 2Hg(l)+SO4.
 Potentiels standard de quelques couples oxydoréducteurs
Potentiels standard de quelques couples oxydoréducteurs
2 ClO- + 2H2O + 2e- <--> Cl2 + 4OH-. 163 vu à 1
 BREVET DE TECHNICIEN SUPÉRIEUR TRAITEMENTS DES
BREVET DE TECHNICIEN SUPÉRIEUR TRAITEMENTS DES
Potentiels standards apparents d'oxydoréduction à pH = 14 et T = 298 K : E°' (Cl2 / Cl–) le potentiel standard du couple Cl2 / Cl– et E°' (ClO– / Cl2) ...
 TD1 – Léquilibre rédox
TD1 – Léquilibre rédox
Données pour tout le TD : Potentiels standards de quelques couples rédox par rapport à l'électrode standard à hydrogène (ESH). E°(S2O8 E°(Cl2/Cl.
 ANNEXE POTENTIEL ET POUVOIR OXYDANT ECHELLE DE
ANNEXE POTENTIEL ET POUVOIR OXYDANT ECHELLE DE
En outre ce potentiel peut dépendre du contexte chimique Cl2 / Cl- ... électromotrice (Fem) de 1
 Diagrammes potentiel-pH
Diagrammes potentiel-pH
May 2 2018 potentiels standard des couples d'oxydoréduction : Couple. O2/H2O Cl2/Cl–. HClO/Cl2. HClO/Cl–. ClO–/Cl–. ClO–. 3/HClO ClO–.
 § 8 (suite) Equation de Nernst
§ 8 (suite) Equation de Nernst
Potentiel standard et équilibre. Nous avons vu au chapitre 5 que l'enthalpie libre standard de réaction ?Gr [Cl–]1 > [K+]1 [Cl–]2 < [K+]2.
 R6) Relation entre deux potentiels standard Déterminer par deux
R6) Relation entre deux potentiels standard Déterminer par deux
Données (25°C) : Couple. O2/H2O H2O/H2. Cl2(g)/Cl-. Na+/Na. E°/V. 123. 0. 1
 1 Couple Cu /Cu(s) 2 Système IO /I2 3 Couples de leau 4 Réactions
1 Couple Cu /Cu(s) 2 Système IO /I2 3 Couples de leau 4 Réactions
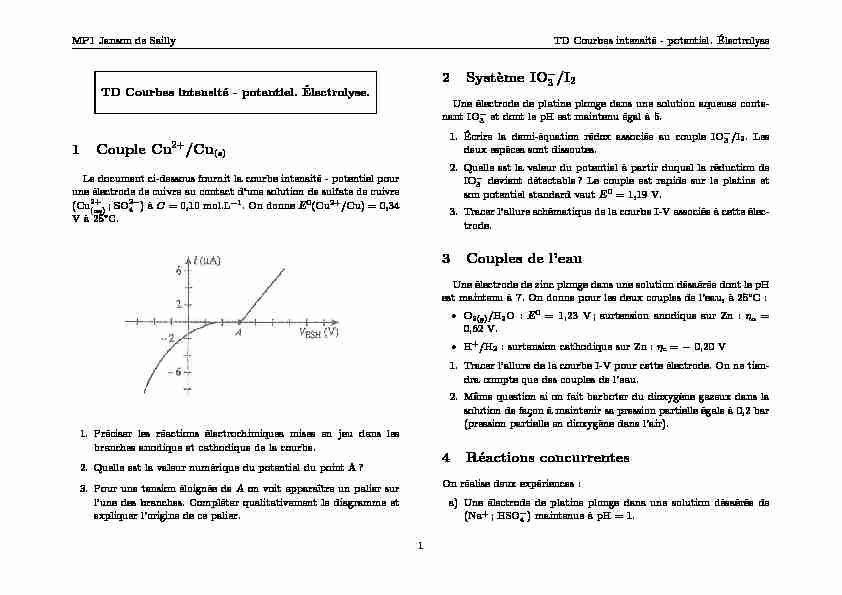
Le document ci-dessous fournit la courbe intensité - potentiel pour son potentiel standard vaut E0 = 119 V. ... couple Cl2/Cl? sur le platine.
 Travail dirigé : Loxydo-réduction
Travail dirigé : Loxydo-réduction
h/ As2S3 + Cl2 ? H3AsO4 + H2SO4 + HCl Leurs potentiels standards ... les conditions standard la fem de la pile vaut -0
 Tables des potentiels standards - Free
Tables des potentiels standards - Free
Tables des potentiels standards Chimie Supérieur www physiquechimie Page 1 sur 18 Document Table des potentiels standards Ce sont des données à 25°C et à 1 bar I – Classement par potentiel décroissant : Oxydant Réducteur Potentiel standard en V F2HF 305 F2F?287 O H2O 243 2? S2O8 HSO4208 O3O2207 Bi5+Bi3+200 2? S2O8 2?
 Searches related to potentiel standard cl2/cl PDF
Searches related to potentiel standard cl2/cl PDF
2 How to calculate the Standard Cell Potential for a redox reaction: Take the following reaction: Zn (s) + Cl 2(g)-> ZnCl 2(aq) a Assign oxidation numbers: • Zn (s) = 0 • Cl 2(g) = 0 • ZnCl 2: Cl = -1 Zn = +2 b Write oxidation and reduction half -reactions: Red: Cl2 (g) + 2e--> 2Cl-(aq) Ox: Zn (s)-> Zn 2+ (aq) + 2e-
What is a standard cell potential?
The potential of the cell under standard conditions (1 M for solutions, 1 atm for gases, pure solids or liquids for other substances) and at a fixed temperature (25°C) is called the standard cell potential (E° cell ). Only the difference between the potentials of two electrodes can be measured.
What is the standard electrode potential of a Zn 2+ / Zn couple?
Because the zinc electrode in this cell dissolves spontaneously to form Zn 2+ (aq) ions while H + (aq) ions are reduced to H 2 at the platinum surface, the standard electrode potential of the Zn 2+ /Zn couple is ?0.76 V. Although the reaction at the anode is an oxidation, by convention its tabulated E° value is reported as a reduction potential.
What is the standard electrode potential in aqueous solution at 25 degrees?
Standard Electrode Potentials in Aqueous Solution at 25°Cr Cathode (Reduction) Half-Reaction Standard Potential E°(volts) Li+(aq) + e--> Li(s)
What is Potentiel d'oxydoréduction?
Article principal : Potentiel d'oxydoréduction. La liste des potentiels standard, en volts, qui suit est relative à la tension obtenue avec l' électrode standard à hydrogène et est assemblée à partir de différents ouvrages ,,,,,,, . Les valeurs sont obtenues sous ces conditions :
MP1 Janson de SaillyTD Courbes intensité - potentiel. ÉlectrolyseTD Courbes intensité - potentiel. Électrolyse.
1 Couple Cu
2+/Cu(s)
Le document ci-dessous fournit la courbe intensité - potentiel pour une électrode de cuivre au contact d"une solution de sulfate de cuivre (Cu 2+ (aq); SO2-4) àC= 0,10 mol.L-1. On donneE0(Cu2+/Cu) = 0,34 V à 25°C.1.Préciser les réactions électro chimiquesmises en jeu dans les branches anodique et cathodique de la courbe. 2. Quelle est la v aleurn umériquedu p otentieldu p ointA ? 3. P ourune tension é loignéede Aon voit apparaître un palier sur l"une des branches. Compléter qualitativement le diagramme et expliquer l"origine de ce palier.2 Système IO -3/I2 Une électrode de platine plonge dans une solution aqueuse conte- nant IO -3et dont le pH est maintenu égal à 5. 1. Écrire l ademi-équation rédo xasso ciéeau couple IO -3/I2. Les deux espèces sont dissoutes. 2. Quelle est la v aleurdu p otentielà partir duquel la réduction de IO -3devient détectable? Le couple est rapide sur le platine et son potentiel standard vautE0= 1,19 V. 3. T racerl"allure sc hématiquede la courb eI-V asso ciéeà cette élec- trode.3 Couples de l"eau
Une électrode de zinc plonge dans une solution désaérée dont le pH est maintenu à 7. On donne pour les deux couples de l"eau, à 25°C : •O2(g)/H2O :E0= 1,23 V; surtension anodique sur Zn :ηa=0,62 V.
•H+/H2: surtension cathodique sur Zn :ηc=-0,20 V 1. T racerl"allure de la courb eI- Vp ourcette électro de.On ne tien- dra compte que des couples de l"eau. 2. Même question si on fait barb oterdu dio xygènegazeux dans la solution de façon à maintenir sa pression partielle égale à 0,2 bar (pression partielle en dioxygène dans l"air).4 Réactions concurrentes
On réalise deux expériences :
a) Une électro dede platine plonge dans une solution désaérée de (Na +; HSO-4) maintenue à pH = 1. 1MP1 Janson de SaillyTD Courbes intensité - potentiel. Électrolyseb)Une électro dede platine plonge dans une solution dégazée de
cholure de sodium (Na +; Cl-) dont le pH vaut 1.Données à 25°C:CoupleO
2(g)/H2Cl
2(g)/Cl-S
2O2-8/HSO-4E
0(V)1,231,362,08
Surt. anodique (V)0,60η
0rapide
1. T racersu ru nmême graphiqu eles allures des courb esI-V p ourles couples O2/H2O et S2O2-8/HSO-4correspondant à l"expérience
a). 2. P ourquoine p eut-onpas observ erl"o xydationde HSO -4? 3. Les courb esobten uesexp érimentalementdans les deux exp é- riences sont représentées sur la figure ci-dessous, superposées sur le même graphique.a)Indiquer les esp èceset le sréactions en jeu su rc haque courbe. b) Donner un or drede grandeur de la surtension à vide du couple Cl2/Cl-sur le platine.c)Expliquer p ourquoiil existe u npalier sur la courb eb). Com-
pléter la courbej(V)pour la solution de chlorure de sodium quandVESHvarie jusqu"à 2 V.5 Électrolyse du sulfate de cobalt
Données électrochimiques:
Potentiels standards d"oxydoréduction à 298 K classés par ordre croissant :CoupleCo2+/Co(s)H
3O+/H2(g)O
2(g)/H2OE
0(V)-0,2901,23
Constante de Faraday :F= 96 500 C.mol-1.
Surtensions aux électrodes:
c(H2) sur Al :-0,1 V;ηc(Co2+) sur Al :-0,1 V;ηa(O2) sur graphite : 0,7 V Une solution acide dont le pH est maintenu à 3 contient du sulfate de cobalt (Co2+; SO2-4) à la constration molaire de 0,18 mol.L-1.
Cette solution est totalement désaérée.
On réalise son électrolyse dans une cuve entre une anode (A) en graphite et une cathode (C) en aluminium. Les ions sulfates sont complètement inertes vis à vis de cette électrolyse. 1. Quelles son tles réactions c himiquesp ouvantapparaître à l"anode? À la cathode? Préciser pour chacune d"elles l"allure des courbes intensité - potentiel. Il est précisé que le tracé du couple H3O+/H2possède une pente beaucoup plus faible que celle des
autres couples. 2. Quelle tension minim umfaut-il appliquer p ourdébuter l"électro- lyse? Écrire l"équation-bilan du fonctionnement. 3. L"électrolyse est réalisée sous une tens ionde 3,5 V a vecune in- tensité constanteI= 10 kA. 2MP1 Janson de SaillyTD Courbes intensité - potentiel. Électrolysea)Calculer la masse théorique de cobalt métal obten ueà l"issue
d"un jour d"électrolyse si Co2+/Co(s)était le seul couple
réagissant à la cathode. Masse molaire du cobalt : M(Co) =58,9 g.mol
-1. b) La masse de cobalt réellemen tobten uejourn ellements"élèv e seulement à 256 kg. En déduire le rendement faradique. c) La c huteohmique dans l"élec trolyseurs"élèv eà 1,1 V Dé- terminer la consommation massique d"énergie, exprimée en kJ.kg -1, c"est à dire l"énergie nécessaire pour produire un kilogramme de cobalt6 Production d"étain
Données:
Potentiels standards d"oxydoréduction:CoupleO
2(g)/H2OSn
4+/Sn(s)H
3O+/H2(g)E
0(V)1,230,010
Surtensions sur le plomb:
Sn4+/Sn(s): rapide ; H3O+/H2(g):ηc=-1,0 V
Surtensions sur l"aluminium:
O2(g)/H2O :ηa= + 0,7 V
Constante de Faraday:F= 96 500 C.mol-1
Une technique pour obtenir de l"étain consiste à dissoudre de l"oxyde SnO2(s)avec de l"acide sulfurique (H3O+; SO2-4) pour ob-
tenir Sn4+à 0,1 mol.L-1puis à réaliser l"électrolyse de la solution
acide obtenue dont le pH vaut 3. L"anode est en aluminium Al (métal inerte ici) et la cathode est en plomb. On précise que les ions sulfates SO2-4sont inertes.1.Préciser les réactions aux électro des.
2. T racerl"allure des courb esin tensité- p otentielcompte ten udes données. 3. Préciser l aréaction d"électrolyse observ éeet estimer la tension minimale nécessaire pour démarrer cette électrolyse. 4. Calculer la masse d"étain dép oséeen τ= 10 minutes pour une densité de courantj= 400 A.m-2et une surface d"électrodeS= 10 cm2. On donneM(Sn) = 118,7 g.mol-1
7 Production du dichlore
Données : potentiels standard 25°C:CoupleO
2(g)/H2Cl
2(g)/Cl-H
+/H2Na +/NaE0(V)1,231,360-2,71Le dichlore est produit par électrolyse d"une solutuion aqueuse
concentrée de chlorure de sodium (la saumure). On étudie ici le pro- cédé des cellules à membrane. 1. Le pH e stmain tenuà 0. D"après les v aleursdes p otentielsstan - dard, quelles sont les demi-équations d"oxydoréduction possiblesà l"anode? À la cathode?
2. À quell eréaction d"o xydoréductionp ourrait-ons"attendre au cours de l"électrolyse en l"absence de surtensions au niveau desélectrodes?
Calculer la constante d"équilibre de cette réaction. 3MP1 Janson de SaillyTD Courbes intensité - potentiel. ÉlectrolyseUn schéma de principe d"une cellule à membrane, à compléter,
est donné ci-après.L"anode est de type DSA (Dimensionally Stables Anode) en ti- tane recouvert d"oxyde de titane et de ruthénium. La cathode est en nickel. La séparation entre les compartiments cathodique et anodique est constituée d"une membrane cationique (perméable aux cations).On obtient les courbes densité de courant - potentiel suivantes :3.Quelle est la réaction qui a e ffectivementlieu dans ce pro céde
pour une valeur de la densité de courant n"excédent pas les limites du tracé des courbes? 4. À l"aide des courb esdensité de couran t- p otentiel,donner un nom à chacune des cases numérotées de 1 à 8 sur le schéma de principe. 5. La densité de couran tjutilisée dans ce procédé est égale à4 kA.m
-2. Pourquoi préfère-t-on utiliser la densité de courant plutôt que l"intensité? Quelle est la valeur de la tension appli- quée aux bornes de l"électrolyseur?On donne :
•Résistance interne de l"électrolyseur :R= 0,3Ω. •Surface de chaque électrode :S= 10 cm2. 4quotesdbs_dbs30.pdfusesText_36[PDF] couple redox clo-/cl-
[PDF] demi equation clo-/cl-
[PDF] hclo/cl2
[PDF] demi equation redox sn2+/sn
[PDF] couple redox dichlore
[PDF] claforan iv
[PDF] claforan dilution
[PDF] claforan posologie
[PDF] claforan per os
[PDF] claforan cp
[PDF] claforan dci
[PDF] claforan 1g
[PDF] claforan comprimé
[PDF] reglage chasse d'eau villeroy et boch
