 Décembre 2014 EXERCICE N° 1 ÉNONCÉ Un médicament a été
Décembre 2014 EXERCICE N° 1 ÉNONCÉ Un médicament a été
d'après la pharmacopée européenne par spectrophotométrie à 238 nm selon le protocole suivant : 0
 Sujet officiel complet du bac S Physique-Chimie Spécialité 2012
Sujet officiel complet du bac S Physique-Chimie Spécialité 2012
Exercice II - Spectrophotométrie (55 points). La lumière est un «< outil 1ère partie : Lumière et spectrophotométrie. 1.1. 1.2. 1.3. 1.4. Donner les valeurs ...
 Une solution colorée (8 points) Exercice n°2 : Teinture pour
Une solution colorée (8 points) Exercice n°2 : Teinture pour
1ère S. 1. 2. 2. 2. 2. Page 2. 2) Déterminer le volume de solution mère à prélever pour fabriquer 20 mL de solution S1 de concentration. C1=50.10-‐3 mol.L-‐1
 Exercice III : Contrôles de la qualité dun lait (5 points)
Exercice III : Contrôles de la qualité dun lait (5 points)
On peut trouver expérimentalement un encadrement de la concentration en diiode de la solution S sans utiliser un spectrophotomètre. 2.1.1. Expliquer brièvement
 Exercice II: Spectrophotométrie (55 points)
Exercice II: Spectrophotométrie (55 points)
Ces solutions ont des colorations proches de celle de la solution S. Page 2. Données : Spectre d'absorption d'une solution aqueuse de diiode.
 Corrigé DS no 3 : Chimie : Dosage - Physique : Interactions
Corrigé DS no 3 : Chimie : Dosage - Physique : Interactions
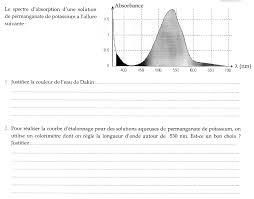
14. dec. 2019 ... spectrophotomètre au maximum d'absorbance donc à λ = 450 nm. (b) A l'aide des documents justifier la couleur orangée de la solution S. La ...
 Evaluation de Chimie/ Première S Exercice 1 : Titrage
Evaluation de Chimie/ Première S Exercice 1 : Titrage
Evaluation de Chimie/ Première S. Exercice 1 : Titrage colorimétrique du diiode (12 Exercice 2 : Spectrophotométrie (8 points). On désire déterminer la ...
 Première générale - Dosage par étalonnage - Exercices - Devoirs
Première générale - Dosage par étalonnage - Exercices - Devoirs
Quelle est la masse molaire de la caféine ? 2. A quelle longueur d'onde doit-on régler le spectrophotomètre ? 3.a. Représenter la courbe d'étalonnage.
 EXERCICE RÉSOLU 2 - Suivi dune réaction par spectrophotométrie
EXERCICE RÉSOLU 2 - Suivi dune réaction par spectrophotométrie
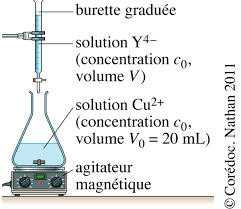
Énoncé. On s'intéresse à la réaction des ions cuivrique Cu2+ en solution aqueuse basique (de pH contrôlé) avec une espèce anionique appelée EDTA et
 Exercices du chapitre 2 : Dosage spectrophotométrique
Exercices du chapitre 2 : Dosage spectrophotométrique
1. okt. 2019 Exercice n°1. L'absorbance d'une solution S de permanganate de potassium de concentration molaire = 10 × 10−3 .
 EXERCICE RÉSOLU 2
EXERCICE RÉSOLU 2
On s'intéresse à la réaction des ions cuivrique Cu2+ en solution aqueuse basique (de d'un spectrophotomètre de longueur ? pour en mesurer l'absorbance A.
 Exercices du chapitre 2 : Dosage spectrophotométrique
Exercices du chapitre 2 : Dosage spectrophotométrique
1 oct. 2019 Exercice n°1. L'absorbance d'une solution S de permanganate de potassium de concentration molaire = 10 × 10?3 .
 Corrigé DS no 3 : Chimie : Dosage - Physique : Interactions
Corrigé DS no 3 : Chimie : Dosage - Physique : Interactions
1ère spécialité Physique-Chimie - Lycée d'adultes - Poisson Florian. 14 décembre 2019 Exercice 1 - Alcootest chimique (6 points).
 Exercices sur les matières colorées
Exercices sur les matières colorées
Exercices sur les matie res colore es Déduire quelles est/sont la/les couleur(s) absorbée(s) par leur pull ... Exercice 2 : Dichromate de potassium.
 EXERCICES
EXERCICES
Exercice 4. 3 Volume molaire d'un gaz. Exercice 1. Exercice 2. Exercice 3. Exercice 4. 4 Dosage spectro photométrique. Exercice 1. Exercice 2
 Exercices de révisions : Physique-chimie
Exercices de révisions : Physique-chimie
Exercice n°2 : Quantité de matière et tableau d'avancement Un surfeur couché sur la neige pense à ses cours de physique de 1ère S ! Après une très.
 Exercice III : Contrôles de la qualité dun lait (5 points)
Exercice III : Contrôles de la qualité dun lait (5 points)
Sans modifier les réglages du spectrophotomètre on mesure l'absorbance de la solution S0' : '. 0. S. A = 1
 Exercice II: Spectrophotométrie (55 points)
Exercice II: Spectrophotométrie (55 points)
Ces solutions ont des colorations proches de celle de la solution S. Page 2. Données : Spectre d'absorption d'une solution aqueuse de diiode.
 Evaluation de Chimie/ Première S Exercice 1 : Titrage
Evaluation de Chimie/ Première S Exercice 1 : Titrage
Exercice 2 : Spectrophotométrie (8 points). On désire déterminer la concentration en diiode dans S0 par un dosage par étalonnage. 1. pourquoi est – il aisé d'
 s-physique-chimie-obligatoire-2012-pondichery-sujet-officiel.pdf
s-physique-chimie-obligatoire-2012-pondichery-sujet-officiel.pdf
Exercice II: Spectrophotométrie (55 points). Exercice III: Nettoyants pour sols (4 points) 1ère partie : Le vol parabolique de l'airbus "A300 zéro G".
 Exercices du chapitre 2 : Dosage spectrophotométrique
Exercices du chapitre 2 : Dosage spectrophotométrique
Exercices du chapitre 2 : Dosage spectrophotométrique Exercice n°1 L’absorbance d’une solution S de permanganate de potassium de concentration molaire ????=10×10?3 ?1 placée dans une cuve de largeur =10 est égale à 18 à la longueur d’onde ????=520
 EXERCICE RÉSOLU 2 - Nathan
EXERCICE RÉSOLU 2 - Nathan
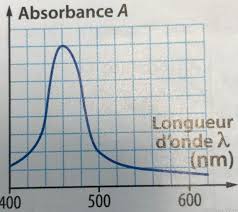
Exercice 2 : Spectrophotométrie 1 Le diiode étant une espèce colorée absorbe la lumière visible qui est utilisée en spectrophotométrie Il est donc aisé d'utiliser la spectrophotométrie 2 a La solution de diiode étant jaune elle absorbe la longueur d'onde complémentaire à sa couleur Il faut choisir la longueur d'onde de 470 nm
 EXERCICE II – Spectrophotométrie (55 points)
EXERCICE II – Spectrophotométrie (55 points)
Bac S Pondichéry 2012 Correction EXERCICE 2 : Spectrophotométrie (55 points) 1ère partie : Lumière et Spectrophotométrie 1 1 Les longueurs d’onde du spectre visible dans le vide sont comprises entre = 400 nm pour le violet et = 800 nm pour le rouge 1 2
 CONTRÔLE DE PHYSIQUE CHIMIE PREMIÈRE S Sujet 1
CONTRÔLE DE PHYSIQUE CHIMIE PREMIÈRE S Sujet 1
CONTRÔLE DE PHYSIQUE CHIMIE PREMIÈRE S Sujet 2 Tous les calculs et affirmations seront justifiés ! Attention aux chiffres significatifs ! Exercice n° 1 (4 points) Pour doser par spectrophotométrie une solution bleue de sulfate de cuivre Cu 2+ +SO 4 2- on a préparé 5 solutions de concentrations différentes La mesure de
 Spectrophotométrie
Spectrophotométrie
1ère STL – SPCL Chimie et développement durable Fiche technique – Spectrophotométrie 2 1 3 Loi de Beer-Lambert Spectre d’absorption d’une solution L’asorane A d’une solution limpide ontenant une espèe himique olorée est propotionnelle à sa concentration molaire C Cette loi est vérifiée si C est inférieure à 10-2 mol L-1
 Composition d’un Le dosage par spectrophotométrie système
Composition d’un Le dosage par spectrophotométrie système
Comment s'appelle cette opération ? Quels instruments de verrerie doit-on utiliser ? On dissous un solide dans un solvant c’est une dissolution il faut utiliser une fiole jaugée de 250 mL 5 Préparation des solutions filles Toutes les solutions sont préparées à partir de la solution S 0 a On réalise une solution S 1
 La spectrophotométrie
La spectrophotométrie
La spectrophotométrie 1- Définition La spectrophotométrie est une méthode analytique quantitative qui consiste à mesurer l’absorbance ou la densité optique d’une substance chimique donnée en solution Plus cette espèce est concentrée plus elle absorbe la lumière dans les limites de proportionnalités énoncées par la loi de
 TP - Dosage spectrophotométrique des bonbons schtroumpf
TP - Dosage spectrophotométrique des bonbons schtroumpf
-Préciser les calculs puis le protocole pour préparer la solution S 2 -Mesurer l’absorbance de chacune de ces solutions après avoir justifié la longueur d’onde choisie pour effectuer les mesures Solution S 0 S 1 S 2 S 3 S 4 S 5 Concentration (mol L-1) 10 10-6 90 10-6 70 10-6 50 10-6 30 10-6 10 10-6 Volume de S 0 à prélever (mL) A
 Spectrophotométrie
Spectrophotométrie
Spectrophotométrie Utilisée pour l’identification et le dosage de nombreuses molécules principes actifs ou impuretés c = 300 108 m/s 1eV = 16 10-19J
 1ère S – Devoir commun 2013 – Épreuve de Physique-Chimie
1ère S – Devoir commun 2013 – Épreuve de Physique-Chimie
Première S Devoir commun Mai 2013 PHYSIQUE-CHIMIE M GOLESTIN M TARGY M LABBÉ Durée de l'épreuve : 3 h L’usage de la calculatrice est autorisé Document autorisé : la classification périodique des éléments (à rendre à la fin de l’épreuve) Ce sujet comporte 12 pages numérotées Chaque partie est évaluée sur 10 points
 Searches related to exercices spectrophotométrie 1ere s filetype:pdf
Searches related to exercices spectrophotométrie 1ere s filetype:pdf
On s'intéresse à la cinétique de la réduction de Hg2+ par Fe2+: 2 Fe2++2 Hg2+=Hg 2 2++2 Fe3+ On suppose la réaction d'ordre p par rapport à Fe2+ et d'ordre q par rapport à Hg2+ On suit la réaction par spectrophotométrie pour différentes concentrations initiales [Fe2+] 0 et [Hg2+] 0 On obtient les résultats suivants :
Quelle est l’équation d’une réaction par spectrophotométrie ?
- échelles sur !le? graphique.? m 2 V EXERCICE? RÉSOLU? 2? Suivi? d’une? réaction? par? spectrophotométrie? Énocé On? s’intéresse? à? la? réaction? des? ions? cuivrique? Cu2+? en? solution? aqueuse? basique? (de? pH contrôlé)? avec? une? espèce? anionique? appelée? EDTA? et? symbolisée? par? la? formule? Y4?. L’équation? de? la? réaction? est? la?
Qu'est-ce que la spectrophotométrie?
- Spectrophotométrie La spetrophotométrie est une tehnique d’ analyse qui repose sur l’absorption de radiations lumineuses par une ou plusieurs espèces chimiques. 1. Le spectrophotomètre 1.1. Description de l'appareil
Quelle est la différence entre un spectrophotomètre et un monochromateur?
- Un spectrophotomètremesure l’absorbance d’une solution à une longueur d’onde donnée. Un dispositif monochromateur permet de générer, à partir d’une source de lumière visible ou ultraviolette, une lumière monochromatique, dont la longueur d’onde est choisie par l’utilisateur.
Qu'est-ce que la spectrophotométrie enocé ?
- spectrophotométrie? Énocé On? s’intéresse? à? la? réaction? des? ions? cuivrique? Cu2+? en? solution? aqueuse? basique? (de? pH contrôlé)? avec? une? espèce? anionique? appelée? EDTA? et? symbolisée? par? la? formule? Y4?. L’équation? de? la? réaction? est? la? suivante? Cu2+? Y4?? CuY2?. On? a? représenté? ci?dessous? les? spectres? d’absorption?

Bac S Pondichéry 2012
EXERCICE II Spectrophotométrie (5,5 points)
La lumière est un " outil » précieux en chimie analytique. En effet, toute espèce chimique est
susceptible dinteragir avec des radiations lumineuses. Par exemple, une espèce colorée X absorbe
certaines radiations visibles. Le principe de la spectrophotométrie repose sur la mesure de labsorbance A de lespèce X ensolution dans un solvant Y. Cette grandeur A est le résultat de la comparaison de deux intensités
lumineuses : celle dune radiation monochromatique ayant traversé une cuve transparentecontenant le solvant Y, et celle de la même radiation émergeant de la même cuve contenant la
solution de lespèce X dans le solvant Y. Schéma de principe dun spectrophotomètre à prisme1ère partie : Lumière et spectrophotométrie
1.1. Donner les valeurs limites des longueurs donde du spectre visible dans le vide et
les couleurs correspondantes.1.2. Situer, du point de vue de leur longueur donde, les rayonnements ultraviolets et
infrarouges par rapport au spectre visible.1.3. Le rôle du monochromateur dans un spectrophotomètre est de sélectionner une
radiation monochromatique particulière. Donner la définition dune lumière monochromatique.2ème partie : Dosage colorimétrique par étalonnage
On se propose de déterminer la concentration en diiode dans une teinture diodeofficinale. On commence par diluer 200 fois la teinture diode (trop concentrée pour une
étude spectrophotométrique directe). La solution aqueuse obtenue à lissue de cette
dilution est appelée solution S. Par ailleurs, on dispose dun ensemble de solutions aqueuses de diiode notées Di (D1, D2, etc.) de concentrations connues toutes différentes. Ces solutions ont des colorations proches de celle de la solution S.Données :
Spectre dabsorption dune solution aqueuse de diiode de concentration molaire c = 3,0 103 mol.L
1Masse molaire atomique de liode : 127 g.mol
1 Écart relatif entre une valeur expérimentale Gexp et une valeur attendue Ga dune grandeur quelconque G : exp a a GG G2.1. On peut trouver expérimentalement un encadrement de la concentration en
diiode de la solution S, sans utiliser un spectrophotomètre.2.1.1. Expliquer brièvement la méthode.
2.1.2. -il que les récipients
utilisés (tubes à essais ou béchers) soient tous identiques ?2.2. À laide dun spectrophotomètre, on mesure labsorbance Ai de chaque solution
Di de diiode, puis celle de la solution S.
2.2.1. Donner la valeur dune longueur donde qui vous paraît bien appropriée pour ces
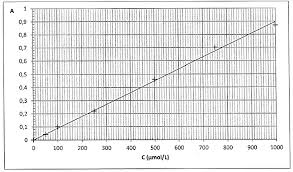
mesures. Justifier brièvement.2.2.2. On obtient les résultats suivants :
Concentration C de la solution en µmol.L
1 50 100 250 500 750 1000
Absorbance A de la solution 0,041 0,10 0,22 0,46 0,70 0,87Absorbance de la solution S : A = 0,78.
La courbe détalonnage de labsorbance en fonction de la concentration molaire C en diiode est fournie en annexe. La relation entre labsorbance A et la concentration C est appelée loi de Beer-Lambert.Elle sécrit : A = k
C avec k une constante et C la concentration molaire de lespècecolorée dans la solution. La courbe détalonnage obtenue est-elle en accord avec cette
loi ? Justifier.2.2.3. Déterminer graphiquement la concentration molaire CS.exp en diiode de la
solution S. En déduire la concentration molaire Cexp en diiode de la teinture diode officinale.2.3. La teinture diode officinale est étiquetée à 5,0 % en masse de diiode. Sa masse
volumique est = 9,0102 g.L
1.2.3.1. À partir de ces données, vérifier que la concentration massique Cm en diiode
attendue dans cette teinture est 45 g.L 1.2.3.2. En déduire la valeur de la concentration molaire attendue en diiode dans cette
teinture. On la notera Ca.2.3.3. Calculer lécart relatif entre la valeur expérimentale Cexp à la valeur Ca. Conclure.
Annexe de lexercice II à rendre avec la copie
Questions 2.2.2 et 2.2.3. : Courbes détalonnage :Bac S Pondichéry 2012 Correction
EXERCICE 2 : Spectrophotométrie (5,5 points)
1ère partie : Lumière et Spectrophotométrie
1.1. Les longueurs donde du spectre visible dans le vide sont comprises entre
= 400 nm pour le violet et = 800 nm pour le rouge.quotesdbs_dbs2.pdfusesText_3[PDF] exercices statistiques bivariées
[PDF] exercices statistiques psychologie l1
[PDF] exercices statistiques stmg
[PDF] exercices stmg
[PDF] exercices substituts cm1
[PDF] exercices substituts cycle 3
[PDF] exercices substituts nominaux et pronominaux
[PDF] exercices suites numériques mpsi
[PDF] exercices suites premiere es pdf
[PDF] exercices suites première s pdf
[PDF] exercices suites terminale es type bac
[PDF] exercices suites terminale s pdf
[PDF] exercices sur l absurde pdf
[PDF] exercices sur l'intensité du courant electrique
