 Chimie 6 : Cohésion de la matière
Chimie 6 : Cohésion de la matière
Chimie 6 : Cohésion de la matière. 1. Cohésion des solides. FIGURE 1.1: Le .CAZAYUS : COURS D'ENSEIGNEMENT SCIENTIFIQUE 1ÈRE 2020-2021 3. Définition 1.4 ...
 Chapitre 14 : Cohésion et solubilité despèces chimiques
Chapitre 14 : Cohésion et solubilité despèces chimiques
Au cours d'une dissolution il y a conservation de la matière et des charges électriques. Aℓ2(SO4)3(s) → 2 Aℓ3+. (aq) + 3 SO4. 2–. (aq). 3) Concentration d' ...
 Cours de première S - Module C1 : Cohésion et transformation de la
Cours de première S - Module C1 : Cohésion et transformation de la
Notions et contenus. Objectifs. La matière à différentes échelles : du noyau à. Connaître les ordres de grandeur des la galaxie.
 Résistance Des Matériaux
Résistance Des Matériaux
La matière est donc uniquement sollicitée en traction-compression suivant les 3 directions principales. Cette. Cours - Td - Tp page 22 sur 77. 26 octobre 2022
 Constitution et cohésion de la matière – Chapitre 1 : Modélisation
Constitution et cohésion de la matière – Chapitre 1 : Modélisation
Page 6. II. Introduction à la mécanique quantique. 1. Interaction lumière – matière - Les alcalins : 1ère colonne (excepté H) métaux pouvant perdre ...
 LC14 - Liaisons chimiques (Lycée)
LC14 - Liaisons chimiques (Lycée)
18 juin 2020 Physique-Chimie 1ère S Durupthy cours sur la cohésion de la matière. Physique-Chimie 2nde
 2 - C Chapitre 9 : Cohésion de la matière à létat solide (p. 151)
2 - C Chapitre 9 : Cohésion de la matière à létat solide (p. 151)
Page 3. 1èreS. Cours – PARTIE 2 - Chapitre 9 : Cohésion de la matière à l'état solide. 3/6. 2. La liaison polaire (p. 155). Lorsqu'il s'établit une liaison
 Review 01/2023: EU financing through cohesion policy and the
Review 01/2023: EU financing through cohesion policy and the
bien plus important au cours de la période 2021-2027 s'avérera particulièrement difficile122. 54 La pression pour l'absorption des fonds s'accroît vers la
 Chimie Générale (Chimie 1)
Chimie Générale (Chimie 1)
23 déc. 2020 Les premières raies étudiées se situent dans le domaine du visible. Elles appartiennent à la "série de. Balmer". Page 32. Cours de Chimie ...
 Chapitre XI: La cohésion des solides
Chapitre XI: La cohésion des solides
V/ La structure de la matière dans les 3 états physiques : « 1S 3 états de l'eau ». 1/ L'arrangement des particules (molécules ou ions) dans les 3 états
 Spé Physique 1ère - Chapitre 6 : Cohésion et dissolution des solides
Spé Physique 1ère - Chapitre 6 : Cohésion et dissolution des solides
Cependant chaque ion s'entoure d'ions de charges de signes contraires afin que les attractions l'emportent sur les répulsions. La cohésion d'un cristal ionique
 Cohésion et transformation de la matière : Solides 1. Cohésion des
Cohésion et transformation de la matière : Solides 1. Cohésion des
SMARTCOURS » 1ère » Physique-Chimie » Chimie » Cours » Cohésion et transformation de la matière : Solides www.smartcours.com - ennoia © page 1/5. Cohésion
 Cours de première S - Module C1 : Cohésion et transformation de la
Cours de première S - Module C1 : Cohésion et transformation de la
Notions et contenus. Objectifs. La matière à différentes échelles : du noyau à. Connaître les ordres de grandeur des la galaxie.
 Ch 7 - Cohésion de la matière
Ch 7 - Cohésion de la matière
Savoir que toute charge électrique peut s'exprimer en fonction de la charge élémentaire e. •. Associer à chaque édifice organisé
 Résistance Des Matériaux
Résistance Des Matériaux
Nov 11 2020 efforts de cohésion » de la matière et sont homogènes à une pression ... Notes de cours de Mécanique des matériaux solides de G. Cailletaud ...
 CH09 Cohésion de la matière
CH09 Cohésion de la matière
Sciences physiques Première S PC2 CH09 La cohésion de la matière page 131 Au cours d'une électrisation il y a modification du nombre d'électrons donc ...
 Cours de Chimie Structure de la matière
Cours de Chimie Structure de la matière
Cet ouvrage de « structure de la matière » s'adresse aux étudiants de Détermination de l'énergie de cohésion par nucléon : courbe d'Aston ………………..17.
 Cohésion et transformation de la matière : Noyau 1. La matière à
Cohésion et transformation de la matière : Noyau 1. La matière à
SMARTCOURS » 1ère » Physique-Chimie » Chimie » Cours » Cohésion et transformation de la matière : Noyau www.smartcours.com - ennoia © page 1/8. Cohésion et
 Cours de Mécanique Statique et RDM
Cours de Mécanique Statique et RDM
Continuité : la matière est supposée continue car son aspect moléculaire est trop torseur des efforts de cohésion s'expriment par.
 SPÉCIALITÉ PHYSIQUE CHIMIE COURS
SPÉCIALITÉ PHYSIQUE CHIMIE COURS
5 Structure cohésion des entités et solubilté/miscibilité d'espèces chimiques quantité de matière C s'obtient en isolant n dans la.
 [PDF] Spé Physique 1ère - Chapitre 6 : Cohésion et dissolution des solides
[PDF] Spé Physique 1ère - Chapitre 6 : Cohésion et dissolution des solides
Spé Physique 1ère - Chapitre 6 : Cohésion et dissolution des solides Thème : constitution et transformations de la matière I) Structure et cohésion d'un
 [PDF] Module C1 : Cohésion et transformation de la matière
[PDF] Module C1 : Cohésion et transformation de la matière
Cours sur le module C1 : Cohésion et transformations de la matière Notions et contenus Objectifs première S comme des particules élémentaires
 [PDF] Chimie 6 : Cohésion de la matière - lptms
[PDF] Chimie 6 : Cohésion de la matière - lptms
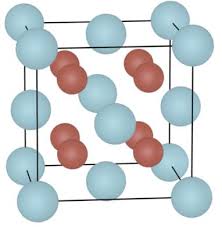
Dans les solides ioniques la cohésion est assurée par l'interaction électrostatique entre les différents ions Page 2 2 MRCAZA FIGURE 1 4: LA COHÉSION D'UN
 [PDF] Plan de travail PROPRIETES ET COHESION DE LA MATIERE
[PDF] Plan de travail PROPRIETES ET COHESION DE LA MATIERE
OBJECTIFS Expliquer la cohésion au sein de composés solides ioniques et moléculaires Modéliser au niveau macroscopique la dissolution d'un composé
 [PDF] Chapitre 5 : Cohésion et mélange despèces chimiques
[PDF] Chapitre 5 : Cohésion et mélange despèces chimiques
5 1 Cohésion des solides s'agence selon qu'il s'agisse d'un composé solide ou bien d'un mélange de liquides Spécialité Physique-Chimie 1ère
 [PDF] La cohésion de la matière - Société Chimique de France
[PDF] La cohésion de la matière - Société Chimique de France
Résumé L'enseignement de la cohésion de la matière liaisons covalentes intraparticulaires et interactions ioniques et moléculaires débute au lycée en
 [PDF] Chapitre XI: La cohésion des solides - Physique - Chimie
[PDF] Chapitre XI: La cohésion des solides - Physique - Chimie
? Une liaison covalente est apolaire quand elle relie 2 atomes identiques ou d'électronégativité proche Les électrons du doublet liant sont équitablement
 [PDF] Chapitre 14 : Cohésion et solubilité despèces chimiques
[PDF] Chapitre 14 : Cohésion et solubilité despèces chimiques
Chapitre 14 : Cohésion et solubilité d'espèces chimiques 1/6 Première Spécialité Thème : Constitution et transformations de la matière Cours
 1ère spé La cohésion de la matière (le cours) - YouTube
1ère spé La cohésion de la matière (le cours) - YouTube
12 mar 2020 · Erreur à 10:52 : la concentration est de 25 mol/L et non 0 025 mol/Llien vers toutes les vidéos de Durée : 13:00Postée : 12 mar 2020
 [PDF] Chimie Cohésion des solides ioniques et moléculaires
[PDF] Chimie Cohésion des solides ioniques et moléculaires
L'objectif de ce chapitre est de comprendre quelles interactions assurent la cohésion de la matière à l'état solide Nous n'étudierons pas cette année la
Comment expliquer la cohésion ?
La cohésion d'un solide moléculaire est assurée par deux types d'interactions d'origines électrostatiques : les interactions de van der Waals et les liaisons hydrogène. Les interactions de van der Waals sont des interactions électrostatiques attractives qui existent toujours entre les molécules.Comment expliquer la cohésion des solides ?
La cohésion d'un composé solide moléculaire. Le solide moléculaire est constitué d'un empilement compact et régulier de molécules. La cohésion des solides moléculaires est assurée par des interactions électrostatiques appelées interactions de Van der Waals. Parfois, des liaisons hydrogène s'ajoutent.Comment expliquer la cohésion d'un solide ionique ?
La cohésion d'un solide ionique est assurée par des forces de nature électrostatique entre les cations et les anions qui le constituent, conformément à la loi de Coulomb.- La cohésion du cristal ionique est assurée par une force attractive. Chaque ion est en interaction avec tous ceux qui l'entourent. Comparons les deux forces attractives pouvant s'exercer entre ions de charges opposées, par exemple un ion sodium et un ion chlorure.

1/ 4 Partie II - Chap. 7 : Cohésion de la matière
PARTIE II : COMPRENDRE
· Connaître les ordres de grandeur des dimensions des différentes structures des édifices organisés.
· Connaître l"ordre de grandeur des valeurs des masses d"un nucléon et de l"électron.· Savoir que toute charge électrique peut s"exprimer en fonction de la charge élémentaire e.
· Associer, à chaque édifice organisé, la ou les interactions fondamentales prédominantes.
· Utiliser la représentation symbolique
AZX ; définir l"isotopie et reconnaître des isotopes.Chapitre 7
Cohésion de la matière
I. Les particules qui composent la matière
I.1 Un peu d"histoire
»»» - 450 : Certains philosophes de la Grèce Antique (Leucippe, Démocrite...)
supposent que la matière ne peut se diviser indéfiniment et qu"elle doit être composée de petites particules insécables : les atomes (a - tomos).1906 : La preuve de l"existence de l"atome est enfin apportée mais on ne
connait alors encore rien de sa structure interne.1911 : Ernest Rutherford (physicien anglais) démontre expérimentalement
que l"atome est composé d"un petit noyau chargé positivement.1913 : Niels Bohr (physicien danois) propose un modèle de l"atome : noyau
chargé positivement avec autour des électrons chargés négativement.1932 : On met en évidence l"existence du neutron et on comprend que le noyau
de l"atome est composé de protons et de neutrons.1969 : On découvre que les nucléons sont eux-mêmes composés de sous-
particules : les quarks (dont il existe 6 "saveurs" : u, d, s, c, b, t).Questions :
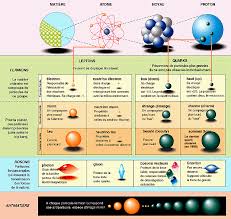
a) Nommer les 3 éléments numérotés de la figure 1. b) Que représentent les boules rouge de l"élément 1 ? c) Que représentent les boules bleues et vertes dans l"élément 2 ?d) Qu"est ce qu"un nucléon ? L"électron peut-il être qualifié de nucléon ? Justifier.
I.2 Modèle de l"atome
Pour mieux se représenter un atome, on utilise des modèles plus ou moins proches d"une réalité de l"atome insaisissable.
La matière "habituelle" est composée de trois particules dont les caractéristiques sont :Particule
Masse m (kg) Charge électrique q (Coulomb) Proton mp = 1,673 × 10 -27 qp = + 1,602 × 10 -19 CNeutron mn = 1,675 × 10 -27 qn = 0 C
Electron me- = 9,1 × 10 -31 qe- = - 1,602 × 10 -19 C ? Figure 1 : L"atome2/ 4 Partie II - Chap. 7 : Cohésion de la matière
Questions :
a) Quelle est, de ces trois particules, celle qui peut être qualifiée de particule élémentaire ? Justifier.
b) Que peut-on dire de la masse du proton et de celle du neutron ? c) Comparer la masse d"un nucléon à celle de l"électron.d) En physique, la charge élémentaire notée e est une charge électrique de valeur 1,602 × 10 -19 C. Déterminer la charge
électrique des trois particules du tableau en fonction de e.e) Sachant qu"un atome est toujours électriquement neutre, que penser de la quantité de protons et d"électrons dans un
atome ? Même question dans un ion.f) Cette électroneutralité de l"atome impose-t-elle une quantité précise de neutrons dans le noyau ?
g) A l"aide des informations précédentes, représenter un atome contenant entre autre 3 électrons et 4 neutrons.
Exercice :
On frotte une règle en plastique avec un pull en laine. On remarque alors que le pull et la règle s"électrisent : lors du frottement,
des électrons de la règle vont être arrachés par le pull. a) Quel sera le signe de la charge électrique QR de la règle ? b) Même question pour la charge QP du pull. c) Quelle relation mathématique existe-t-il entre QR et QP ?d) Pourquoi peut-on affirmer à l"aide de cette expérience qu"une charge électrique à notre échelle (charge du pull ou de la
règle) ne peut être égale qu"à un multiple entier de la charge élémentaire e ?e) On mesure la charge électrique stockée sur un morceau d"ambre électrisé : Q = 5,615 × 10 -17 C. Déterminer le nombre
d"électrons qui ont été arrachés lors du frottement. Ce résultat est-il possible ? Pourquoi ?
A retenir :
· Le proton et le neutron ont une masse quasi-identique de l"ordre de 10 -27 kg. · L"électron possède une masse environ 2000 fois plus petite que celle d"un nucléon.· La charge électrique du proton est + e
La charge électrique du neutron est nulle
La charge électrique de l"électron est - e
· Un noyau d"atome est représenté par le symbole : avec :A le nombre de nucléons dans le noyau
Z le nombre de protons du noyau
· Deux atomes sont dits ISOTOPES s"ils font parti du même élément chimique (même nombre de protons) mais s"ils
diffèrent par leur nombre de neutrons.Exercice :
a) Donner la notation des nucléides (noyaux d"atome) suivants : - Carbone 12 (6 protons, 6 neutrons) - Carbone 14 (6 électrons, 8 neutrons) - Carbone 13 - Oxygène 18 (8 protons, 10 neutrons) - Oxygène 16 - Hydrogène 1 (1 nucléon, 1 électron) - Uranium 235 (92 électrons) b) Comment qualifie-t-on des nucléides tels le carbone 12 et le carbone 14 ? X A Z nombre de masse numéro atomique symbole chimique3/ 4 Partie II - Chap. 7 : Cohésion de la matière
II. Les interactions fondamentales
II.1 Qu"est ce qu"une interaction fondamentale ?Les interactions fondamentales ont pour but d"expliquer l"origine de toutes les forces qui gouvernent notre Univers. Ainsi,
lorsque Isaac Newton a compris que les objets tombent vers le sol parce qu"ils sont attirés par la Terre et parce qu"ils attirent la
Terre, il a mis le doigt sur l"interaction gravitationnelle qui dit que tous les corps ayant une masse s"attirent entre eux. Cette interaction est entre autre responsable de la trajectoire des planètes autour du Soleil.L"interaction gravitationnelle est la première interaction fondamentale a avoir été découverte. Elle explique la force
gravitationnelle qui s"exerce entre tous les objets possédant une masse. Soient deux objets de masses m et m" distant de d : 2" d mmGF´´=L"interaction gravitationnelle est :
· toujours attractive
· de portée infinie et impossible à écranter.II.2 Pourquoi d"autres interactions ?
L"atome d"hydrogène est le plus simple qui existe. Il est composé d"un proton autour duquel tourne un électron.
Questions :
a) Calculer la force d"interaction gravitationnelle qui existe entre les deux particules qui composent cet atome sachant qu"elles sont distantes d"environ 5×10 -11 m. b) Que penser de l"intensité de cette force ? Semble-t-elle suffisante pour maintenir l"électron au voisinage du proton afin d"assurer la cohésion de l"atome ? c) Pourquoi est-il alors nécessaire d"invoquer une nouvelle interaction fondamentale ?L"interaction électromagnétique agit entre tous les objets possédant une charge électrique. Elle explique la force
électrique qui s"exerce entre deux objets de charges électriques q et Q et distant de d : 2d QqkFE´´=
L"interaction électromagnétique est :
· attractive (si charges de signe contraire) ou répulsive (si charges de même signe) · de portée infinie mais pouvant être écrantée. Le noyau de l"atome d"hélium 3 est composé de 2 protons et de 1 neutron (figure 5).Questions :
a) La force électrostatique entre les deux protons du noyau est-elle répulsive ou attractive ? b) Même question entre un proton du noyau et le neutron. c) Sachant que la force d"attraction gravitationnelle entre de telles particules est ultra-négligeable, un noyau d"atome peut-il être stable dans de telles conditions ? Justifier. d) Que doit-on alors supposer pour expliquer l"existence des noyaux d"atomes ?L"interaction nucléaire forte agit sur toutes les particules composées de quarks dont les protons et les neutrons. Elle
explique la cohésion du noyau d"un atome, mais aussi la cohésion des nucléons eux mêmes (car formés de quarks).
L"interaction nucléaire forte est de très courte portée (10-15 m, inférieure au diamètre du noyau d"un atome) et devient répulsive
pour des distances encore plus petites.L"interaction nucléaire faible est responsable de la désintégration radioactive de particules subatomiques (portée 10-17 m)
F en N
m et m" en kg d en m avec G la constante de gravitation universelleG = 6,67×10 -11 S.I.)
avec k une constante de valeur 9×109 S.I.)
FE en N
q et Q en C d en m proton électron ? Figure 3 : L"atome d"hydrogène m m" d F F- ? Figure 2 d ? Figure 4 ? Figure 5Loi de Coulomb
4/ 4 Partie II - Chap. 7 : Cohésion de la matière
III. De l"infiniment petit à l"infiniment grandIl existe donc dans la physique actuelle
4 interactions fondamentales qui expliquent les forces connues à l"oeuvre dans notre
Univers.
Ces interactions se font plus ou moins ressentir selon l"échelle à laquelle on considère la matière :
Ordre de grandeur Eléments Interactions dominantes10-15 m Noyau d"atome
nucléons, quarks10-10 m Atomes, molécules
10 0 m Homme, arbre, voiture...
10 6 m Gros astéroïdes
(> 500 km)10 7 m Planètes
10 21 m Galaxies
Question :
Si la terre avait la dimension d"un grain de sable, le Soleil aurait la taille d"une orange et l"une des plus grandes étoiles connues
aurait la taille d"un paquebot.Déterminer à l"aide de ces données, l"ordre de grandeur des plus grandes étoiles connues aujourd"hui.
L"interaction nucléaire forte domine.
L"interaction électromagnétique et l"interaction faible sont nettement plus faibles.L"interaction gravitationnelle est ultra-
négligeable.L"interaction électromagnétique domine.
Les interactions nucléaires ayant des portées très courtes n"existent plus à ces échelles.L"interaction gravitationnelle est encore ultra-
négligeable.L"interaction électromagnétique domine.
L"interaction gravitationnelle est négligeable
mais peut être déjà facilement mesurée.L"interaction gravitationnelle domine.
L"interaction électromagnétique n"a plus d"effets significatifs entre objets de cet ordre de grandeur.L"interaction gravitationnelle domine.
L"interaction électromagnétique et
l"interaction gravitationnelle jouent à jeu égal.La forme des gros astéroïdes est quasi
sphérique car la masse de ces corps devient suffisante pour que la gravité prenne le pas sur la force électromagnétique (qui, elle, permet à un objet d"avoir n"importe quelle forme). ? Figure 6quotesdbs_dbs29.pdfusesText_35[PDF] exercices corrigés sur les charges électriques
[PDF] cohésion des solides ioniques et moléculaires 1ere s
[PDF] chaine ramifiée
[PDF] formule generale de lalcool
[PDF] zerrouki physique
[PDF] cohésion de la matière ? l'état solide exercice
[PDF] exercice physique 1ere s cohésion de la matière
[PDF] cohérence cohésion définition
[PDF] les 4 règles de la cohérence textuelle
[PDF] cohérence textuelle définition
[PDF] cohésion du texte
[PDF] cohérence et cohésion d'un texte
[PDF] la cohérence et la cohésion textuelle pdf
[PDF] la cohérence et la cohésion textuelle exercices
