 Chimie 30S Devoir : Masse atomique moyenne 1. Les deux isotopes
Chimie 30S Devoir : Masse atomique moyenne 1. Les deux isotopes
isotopes : le. H. 1. 1 et le H. 2. 1 . Calcule le pourcentage d'abondance relative de chaque isotope d'après la masse atomique moyenne de l'hydrogène. x(1) +(1- ...
 Deuxieme Series
Deuxieme Series
Le tableau ci-dessous montre les pourcentages d'abondance relative des isotopes du néon. Calculer le nombre de moles du gaz néon dans l'échantillon (S). 5 ...
 Corrigé de la série 1 dAtomistique / SMPC
Corrigé de la série 1 dAtomistique / SMPC
parlons également d'abondance ou pourcentage isotopique. La masse molaire d b- La prépondérance naturelle des isotopes 29Si et 30Si se calcule en faisant l' ...
 FICHE RADIONUCLÉIDE Argent 110m et environnement
FICHE RADIONUCLÉIDE Argent 110m et environnement
L'argent 110m est un produit d'activation de l'isotope 109. Dans les Différents auteurs ont montré expérimentalement que le pourcentage d'argent fixé.
 Fiche de synthèse n° 2.a Isotopes et masse molaire
Fiche de synthèse n° 2.a Isotopes et masse molaire
Calcul de la masse molaire moyenne. La masse molaire d'un élément chimique Isotope du chlore. 35Cl. 37Cl. Proportions (%). 758 %. 24
 Chapitre I (Partie2); La structure de latome
Chapitre I (Partie2); La structure de latome
Le pourcentage de l'isotope le plus abondant est de 9991%. 1- Quelle est l'abondance du deuxième isotope. 2- Calculer la masse atomique moyenne du lanthane.
 Chimie générale et organique Séries de Travaux Dirigés et Solutions
Chimie générale et organique Séries de Travaux Dirigés et Solutions
Calculer la proportion massique des deux isotopes dans le carbone naturel. Le pourcentage (l'abondance naturelle) de chaque isotope de magnésium naturel est :.
 Les isotopes du Calcium: Développements analytiques. Application
Les isotopes du Calcium: Développements analytiques. Application
16 avr. 2009 ... abondance entre les différents isotopes d ... Figure II.3.6: Variations isotopiques en fonction du pourcentage cumulé de Ca élué dans une.
 Untitled
Untitled
16 juin 2011 8) Calculer le nombre d'atomes N dans un 1 gramme de potassium 40. a txxxx. 1pt. N = Лу. 19. 22. = 1.5×10 m/40K). 3996399) um
 I. Masse dun atome
I. Masse dun atome
Calculer le pourcentage de chacun de ses isotopes. Solution. D'après la formule : Masse atomique moyenne = (. ) 100.
 Chimie 30S Devoir : Masse atomique moyenne 1. Les deux isotopes
Chimie 30S Devoir : Masse atomique moyenne 1. Les deux isotopes
leur abondance relative et de leur masse atomique : le Si Calcule le pourcentage d'abondance relative de chaque isotope d'après la.
 Deuxieme Series
Deuxieme Series
2- Identifieren se basant sur la Remarque
 Atomistique Corrigé
Atomistique Corrigé
La masse molaire de l'élément antimoine se calcule en additionnant les masses molaires des différents isotopes affectés de leur abondance ; on sait de plus
 1. Quantités chimiques
1. Quantités chimiques
Isotopes. 17. Symbole de l'élément. Nombre de masse. = nombre de nucléons. Numéro atomique. = nombre de protons. E. A. Z. Noyau. Abondance naturelle.
 Chapitre 5 La mole
Chapitre 5 La mole
Ex.1 : Calcule la masse atomique moyenne du lithium selon les infos suivantes : Ex.2 : Calcule l'abondance relative de chaque isotope du bore selon les.
 LA METHODE ISOTOPIQUE
LA METHODE ISOTOPIQUE
ABONDANCE ISOTOPIQUE. (Pour les détails voir volume I). L'hydrogène et l'oxygène comportent un certain nombre d'isotopes
 Chimie 521 – Masse atomique
Chimie 521 – Masse atomique
Vous séparerez les atomes de chaque isotope et pour chaque isotope
 1. Déterminer la masse atomique moyenne du carbone sachant quil
1. Déterminer la masse atomique moyenne du carbone sachant quil
m.a.m. = (m 12C x % abondance) + (m 13C x % abondance) Isotope. Masse atomique. (u). % abondance ... Calculer la masse atomique moyenne du.
 Épreuve de Chimie Chimie Premier exercice : Les isotopes du zinc
Épreuve de Chimie Chimie Premier exercice : Les isotopes du zinc
l'abondance naturelle des isotopes du zinc (Z = 30). Pourcentage d'abondance (en %) Calculer le nombre de neutrons de cet isotope.
 UE - Éléments Chimiques TD1 : Latome
UE - Éléments Chimiques TD1 : Latome
2) Calculer l'abondance naturelle des deux isotopes de l'antimoine. Exercice 4. Le bore (B) a une masse atomique moyenne de 10811 u et un numéro atomique Z
Comment calculer le pourcentage d'abondance d'un isotope ?
Vous pouvez facilement rechercher le pourcentage d'abondance de chaque isotope dans un livre de chimie ou sur le Web, mais vous devrez peut-être calculer le pourcentage d'abondance à la main, par exemple, pour répondre à une question sur un test de chimie à l'école.
Comment calculer l'abondance d'un isotope ?
L'abondance relative de chaque isotope peut être déterminée à partir de la hauteur, ou intensité, du pic de rapport masse sur charge correspondant. Sur la simulation du spectre de masse, on suppose que chaque ion identifié par un pic est porteur d'une charge 1+ 1+, permettant ainsi de calculer la masse atomique de chaque isotope.
Qu'est-ce que l' abondance relative d'un isotope ?
Les atomes qui possèdent un même nombre de protons et d'électrons mais un nombre différent de neutrons sont appelés isotopes. Les isotopes possèdent des masses atomiques différentes. L' abondance relative d'un isotope correspond à la proportion sur Terre d'un même élément de masse atomique spécifique.
Comment définir un isotope en particulier ?
De la même façon que le numéro atomique définit l'élément, le nombre de masse définit l'isotope spécifique de cet élément en particulier. De fait, la façon la plus simple de définir un isotope en particulier est d'utiliser la notation "nom de l'élément - nombre de masse".
 1 0 10 20 30
1 0 10 20 3040
50
60
70
Magnésium (Z=12) Cuivre (Z=29)
Nombre de masse
Demi-pile (A) Demi-pile(B)
(B)6ϟΎόϟ ϡ7ϠόΗϟ1 Δ7ΑέΗϟ Γέί1
Δ7ΑέΗϠϟ ΔϣΎόϟ Δ7έ7Ωϣϟ Δργ1Ηϣϟ ΓΩΎ0ηϟ ΕΎϧΎΣΗϣ Δϧγ Γέ1Ω˻˹˹˽ ϻΎϧΛΗγΔ7ϹΗγΔ7ϟΎϣϛ
6ϓ ΔϘΑΎγϣ ΓΩΎϣ ˯Ύ7ϣ7ϛϟ
ΓΩϣϟ ΓΩΣ1 ΔϋΎγCette épreuve est constituée de trois exercices. Elle comporte deux pages numérotées 1 et 2.
Traiter les questions suivantes :
Premier exercice (7 points)
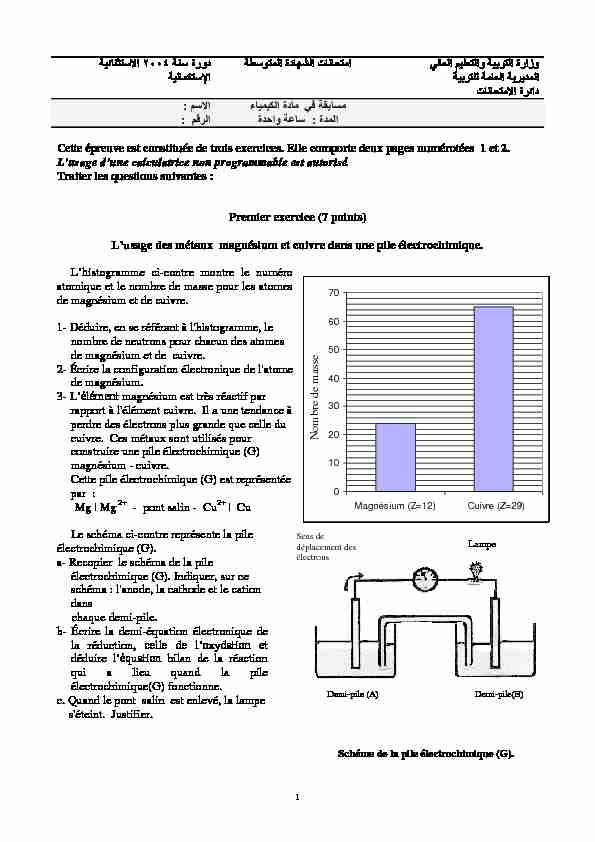
s métaux magnésium et cuivre dans une pile électrochimique. stogramme ci-contre montre le numéro atomique et le nombre de masse pour les atomes de magnésium et de cuivre.1- Déduire, en se référant à l'histogramme, le
nombre de neutrons pour chacun des atomes de magnésium et de cuivre.2- Écrire la configuration électronique de l'atome
de magnésium.3- L magnésium est très réactif par
rapport à l'élément cuivre. Il a une tendance à perdre des électrons plus grande que celle du cuivre. Ces métaux sont utilisés pour construire une pile électrochimique (G) magnésium - cuivre. Cette pile électrochimique (G) est représentée par :Mg | Mg 2+ - pont salin - Cu2+ | Cu
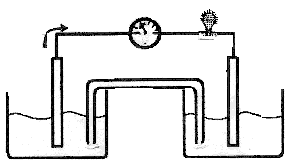
Le schéma ci-contre représente la pile
électrochimique (G).
a- Recopier le schéma de la pileélectrochimique (G). Indiquer, sur ce
schéma : l'anode, la cathode et le cation dans chaque demi-pile. b- Écrire la demi-équation électronique de la réduction déduire bilan de la réaction qui a lieu quand la pileélectrochimique(G) fonctionne.
c. Quand le pont salin est enlevé, la lampe s'éteint. Justifier.Sens de
déplacement desélectrons
LampeSchéma de la pile électrochimique (G).
2H H
H C - C - Cl
H Cl
La formule développée
de l'isomère (I)Deuxième exercice (6points)
Les gaz inertes
Les éléments du groupe VIII ( 18ème colonne) sont nommés gaz inertes. Ils ont diverses
utilisations. L'hélium (He, Z = 2) est non inflammable; il est utilisé pour gonfler des ballons . Le
néon (Ne, Z = 10) et l'argon (Ar, Z = 18) sont utilisés dans des lampes d'éclairage. Parfois, les
plongeurs sous-marins utilisent un mélange respiratoire constitué de dioxygène et d'hélium.
Le tableau ci-dessous montre les pourcentages d'abondance relative des isotopes du néon.1- Les trois isotopes du néon ont la même configuration électronique. Justifier.
2- Identifier,en se basant sur la Remarque isotope le plus lourd du néon mentionné dans le
tableau et donner son pourcentage d'abondance relative.3- Dire pourquoi les gaz inertes existent dans la nature comme gaz monoatomiques.
4- La masse d'un échantillon (S) du gaz néon est égale à 4 g. Calculer le nombre de moles du gaz
néon dans l'échantillon (S).5.-Relever du texte les utilisations de l'hélium.
Remarque : l'isotope le plus lourd dans son noyau. Donnée: la masse molaire du néon, M (Ne) = 20 g.mol-1Troisième exercice (7points)
Les halogénoalcanes
Les halogénométhanes sont des composés utilisés comme réfrigérants, solvants, anesthésiques Ils sont obtenus à partir de la réaction du méthane avec les dihalogènes CH3-H + X2 Lumière CH3-X + HX Où X2 est la formule d'une molécule de dihalogène comme Cl2 ou Br2.1- Justifier si la réaction, représentée ci-dessus, est une
réaction2- Donner les noms systématiques des composés suivants CH2Cl2 et CH3Br .
3- Les halogénoalcanes , comme le chlorométhane, sont obtenus à partir
des alcanes en remplaçant un ou plusieurs composé C2H4Cl2 a deux isomères (I) et (II). La formule développée (I) est donnée ci-contre : a) Écrire la formule développée (II) et donner son nom systématique. b) Identifier lequel des deux isomères (I) et (II) peut être obtenuéthène avec une molécule de
dichlore.4- Un étudiant a donné le nom 2-éthylbutane à un alcane (A) à chaîne carbonée ramifiée.
a) Écrire la formule semi-développée correspondant à ce nom. b) Montrer que ce nom est non correct. Donner le nom correct de l 5-Isotopes du néon
0.13 22Ne
7.82 21Ne
92.05 20Ne
3 Brevet Barème de Chimie 2ème session 2004Réponses attendues Notes Commentaires
Premier exercice (7 pts.)
1 stogramme, le nombre de masse du magnésium est
A = 24 et celui du cuivre A = 65
Z du magnésium est 12 et Z du cuivre est 29.
or N = A Z ; (N= nombre de neutrons).NMg = 24 12 = 12
NCu = 65 29 = 36
ACu 65 zéro
NCu décimal zéro
2 :Nombre de protons = nombre d= Z.
Pour Mg Z = 12 alors la configuration électronique est :K2L8M2
3 a- b Demi-équ :Mg AE Mg2+ + 2e-
Demi-équation électronique de réduction :Cu2+ + 2e- AE Cu
Equation bilan :
Cu2+ + Mg AE Cu + Mg 2+
c devient ouvert.2 ½
Schéma ½
anode ½ cathode ½ cation Mg2+ : ½ cation Cu2+ : ½Les porteurs de
charges cessent de circuler.Deuxième exercice (6 pts.)
1 élément ont le même numéro atomique Z.
Or dans un atome: =nombre de protons =Z,
donc ils ont la même configuration électronique. 1Half- Half- Cu2+
Mg2+Anode Cathode
4Réponses attendues Notes Commentaires
2 Le nombre :
A = Z + N alors N = A Z.
O, la plus grande valeur de A a le plus grand nombre de neutrons et est , lourd est 22Ne.Sve est : 0,13%.
1 ½
N = A Z
N = 22 10 = 12
N = 21 10 = 11
N = 20 10 = 10
alors 22Ne a le plus grand nombre de le plus lourd. (1 ½ )3 Les gaz inertes sont monoatomiques car leurs couches de
valence sont saturées par suite ils sont chimiquement stables. 1 Ils ont déjà un duet ou un octet.4 - n mol =
1mol.g
g M m ou g4x g20mol1 o n = 20 4 = 0,2 mol ou x = 20 1x4 = 0,2 molSans unité ¼
5 - - Gonfler des ballons.
- Mélange gazeux respiratoire.Troisième exercice (7 pts.)
1 Ou, un alcane est stable donc il ne fait pas une réaction1 Le nombre
pas augmenté.2 CH2Cl2 : dichlorométhane.
CH3Br : monobromométhane.
bromométhane est acceptable.3 a La formule dév :
ClCl HCCH HH son nom est : 1,2 - dichloroéthane b rompue et un atome de chlore s sur chaque atome de carbone. 1quotesdbs_dbs29.pdfusesText_35[PDF] calculateur de cylindrée moteur
[PDF] calcul de cylindrée en cm3
[PDF] calcul cylindrée moteur 2 temps
[PDF] calcul volume chambre de combustion
[PDF] formule alesage
[PDF] calcul alésage d'un cylindre
[PDF] calculer la course d'un moteur
[PDF] liposolubilité d'un médicament
[PDF] delai d'action d'un medicament definition
[PDF] voie d'excrétion des médicaments
[PDF] la dose de charge definition
[PDF] liste médicaments liposolubles
[PDF] diagonale parallélogramme angle
[PDF] parallélogramme diagonales perpendiculaires
