 § 7 (suite) Titrages acide-base
§ 7 (suite) Titrages acide-base
Lors d'un titrage acide-base on détecte le point d'équivalence (fin de la réaction de neutralisation) en mesurant le pH à l'aide d'un pH-mètre ou en
 Dosages pH-métriques : Méthode graphique de détermination du
Dosages pH-métriques : Méthode graphique de détermination du
Le premier point d'équivalence pH = f (V) de l'acide fort (puisqu'elle est interrompue ... la pente de la droite permet de calculer KA.
 Chapitre 1 Acides et bases
Chapitre 1 Acides et bases
L'équivalence est le point de la courbe où l'augmentation du pH par unité de calculer le pH d'une solution d'acide fort ou de base forte (d'après la ...
 LES REACTIONS ACIDE-BASE 1. Le pH 1.1 Définition Le pH
LES REACTIONS ACIDE-BASE 1. Le pH 1.1 Définition Le pH
Le pH est lié à la concentration en ions oxonium [H3O+] par la relation : Pour déterminer le point d'équivalence par la méthode des.
 Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Savoir repérer précisément l'équivalence dans un titrage pH-métrique (méthode Calculer l'écart relatif entre la masse mesurée et la masse annoncée par ...
 Equilibres chimiques et calcul du pH dune solution
Equilibres chimiques et calcul du pH dune solution
Equilibres chimiques et calcul du pH d'une solution. Introduction. Chimie des carbonates pH. ? points d'équivalence situés aux pK. Guy Munhoven.
 Dosage acide faible – base forte
Dosage acide faible – base forte
L'équivalence acido-basique est atteinte lorsque la quantité d'ions hydroxyde OH- versée Pour étudier la variation du pH en fonction de vb on utilise.
 Les acides et les bases NS
Les acides et les bases NS
Calcule le pH d'une solution neutre si Kw = 400 x 10 b) Estimez le pH au point d'équivalence pour le titrage de l'acide chlorhydrique par l'ammoniac et ...
 TP 6 chimie : Terminale Suivi pHmétrique de la réaction de lacide
TP 6 chimie : Terminale Suivi pHmétrique de la réaction de lacide
Etudier l'évolution du pH d'une solution d'acide éthanoïque CH3COOH lors de Repérer sur le graphe les coordonnées du point équivalent calculé dans ...
 Aucun titre de diapositive
Aucun titre de diapositive
On arrête le titrage quand on atteint le Point Equivalent. Le Point Equivalent est par en h pour pouvoir calculer le pH en tout point du titrage.
 Equilibres chimiques et calcul du pH d'une solution - uliegebe
Equilibres chimiques et calcul du pH d'une solution - uliegebe
Calcul du pH Equilibres chimiques ´Echelles de pH Sp´eciation Alcalinit´e Sp´eciation: Diagramme de Bjerrum (Bjerrum Plot) 2 4 6 8 10 12 pH-10-8-6-4-2 log 10 (conc(mol/kg)) pK * 1 = 5 85 pK * 2 T=25°C = 8 92 P=0 bar S=35 CO* 2(aq) HCO-3 CO2-3 Points d’´equivalence Guy Munhoven Equilibres chimiques et calcul du pH d’une solution
 § 7 (suite) Calcul du pH de solutions - EPFL
§ 7 (suite) Calcul du pH de solutions - EPFL
trations sont inconnues Le système de quatre équations à résoudre pour calculer le pH d’une solution d’un acide faible est le suivant: Equilibre de dissociation: K a = [A–]?[H 3O+] / ( [HA]?c0 )(1) Equilibre d’autoprotolyse: K e = [H 3O+]?[OH–] / (c0)2 (2) Bilan des charges: [H 3O+] = [A–] + [OH–] (3)
Vue d’ensemble
Dans la vie quotidienne, le pH est une échelle de mesure souvent utilisée pour décrire la neutralité ou l'absence de neutralité dans les éléments d'usage courant. En sciences, le pH est la mesure d'ions dans une solution. Si vous prenez ou suivez un cours de sciences ou de chimie, vous devrez savoir comment calculer le pH basé sur la concentration ...
Comprendre ce que c'est que le pH
Sachez ce que c'est que le pH. Le pH est la concentration en ions d'hydrogène présents dans une solution. Une solution avec une grande concentration d'ions d'hydrogène est considérée comme acide et une solution avec une faible quantité d'ions d'hydrogène est considérée comme basique ou alcaline
Utiliser la concentration pour calculer le pH
Souvenez-vous de l'équation du pH. L'équation du pH est la suivante : pH = -log [H3O
Comment calculer la dérivée du pH ?
La première alternative est donc le calcul de la dérivée du pH en fonction du volume versé dpH/dV. Au point d’inflexion (qui pour mémoire correspond au point équivalent), la dérivée qui correspond à la pente de la courbe sera maximale. Le sommet de la courbe correspond donc au point équivalent.
Quelle est la formule du pH?
Le calcul du pH se fait à partir de l'équation suivante : pH = -log [H3O + ]. Sachez ce que c'est que le pH. Le pH est la concentration en ions d'hydrogène présents dans une solution.
Comment calculer le pH d'une solution ?
En sciences, le pH est la mesure d'ions dans une solution. Si vous prenez ou suivez un cours de sciences ou de chimie, vous devrez savoir comment calculer le pH basé sur la concentration en ions des solutions. Le calcul du pH se fait à partir de l'équation suivante : pH = -log [H3O + ].
Comment calculer l'échelle de pH ?
L'échelle de pH est calculée par un cologarithme. Le cologarithme d'un nombre est défini comme le logarithme de l'inverse de ce nombre [5] . L'équation du pH ressemble à ceci : pH = -log [H3O +]. Parfois, l'équation peut être écrite de cette manière pH = -log [H + ]. Sachez qu'il s'agit de la même chose.
Past day
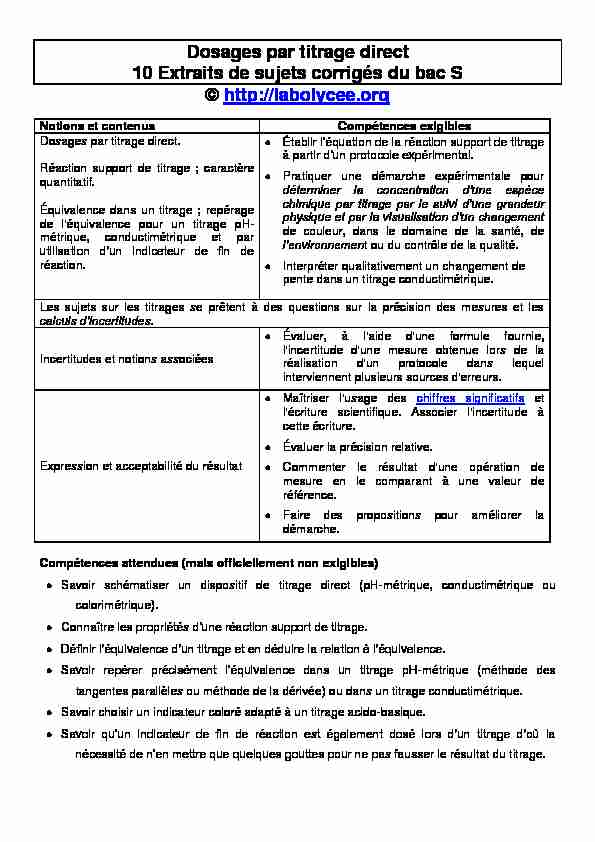
Dosages par titrage direct
10 Extraits de sujets corrigés du bac S
© http://labolycee.org
Notions et contenus Compétences exigibles
Dosages par titrage direct.
Réaction support de titrage ; caractère
quantitatif.Équivalence dans un titrage ; repérage
de l'équivalence pour un titrage pH- métrique, conductimétrique et par réaction.à part
Pratiquer une démarche expérimentale pour de couleur, dans le domaine de la santé, de t ou du contrôle de la qualité.Interpréter qualitativement un changement de
pente dans un titrage conductimétrique. Les sujets sur les titrages se prêtent à des questions sur la précision des mesures et lesIncertitudes et notions associées
Évaluer, à l'aide d'une formule fournie, l'incertitude d'une mesure obtenue lors de la réalisation d'un protocole dans lequel interviennent plusieurs sources d'erreurs.Expression et acceptabilité du résultat
Maîtriser l'usage des chiffres significatifs et l'écriture scientifique. Associer l'incertitude à cette écriture.Évaluer la précision relative.
Commenter le résultat d'une opération de mesure en le comparant à une valeur de référence.Faire des propositions pour améliorer la
démarche. Compétences attendues (mais officiellement non exigibles)Savoir schématiser un dispositif de titrage direct (pH-métrique, conductimétrique ou
colorimétrique).Connaître l
-métrique (méthode des tangentes parallèles ou méthode de la dérivée) ou dans un titrage conductimétrique. Savoir choisir un indicateur coloré adapté à un titrage acido-basique. usser le résultat du titrage. en autonomie, les étapes nécessaires à la par exemple).MÉTHODE :
- (placée dans la burette).- différencier le volume titré (prélèvement) du volume de la solution dont on cherche la
on !)- noter si la solution a été diluée avant le titrage : la concentration trouvée sera donc celle
de la solution fille et il faudra la multiplier par le facteur de dilution pour trouver la concentration
de la solution mère. étape indispensable à la résolution du problème)Mettre des indices aux grandeurs utilisées dans les relations (Vtitré, VE, V1, Vsolution, n(A)titré,
n(B)versé, CA mais pas V, n ou C tout court) Comme toujours, vérifier la cohérence de vos résultats. Les corrigés sont rédigés par les professeurs Ces corrigés sont accessibles gratuitement et sans inscription sur http://labolycee.org Contacts : https://twitter.com/Labolycee ; https://www.facebook.com/labolycee/ ; labolycee@labolycee.org Extrait 1 Bac S Antilles Guyane Session de remplacement 09/2013 http://labolycee.org EXERCICE 2 UN EXEMPLE DE CHIMIE VERTE : LA SYNTHÈSE DE LIBUPROFÈNEACCÈS CORRECTION
Troisième partie
ibuprofène 400 mg » : - on sépare la molécule active des excipients pa - ntenant une solution aqueuse +(aq) + HO(aq)) de concentration molaire apportée cb = 0,20 mol.L-1. Letitrage est suivi par pH-métrie (les courbes obtenues sont tracées dans le document 3 ci-après).
3.1. Réaliser un schéma du mont
3.3. On rentre dans un tableur-grapheur les différentes valeurs du pH mesurées en fonction du
volume Vb tés du tableur- grapheur pour dériver le pH par rapport à Vb, la grandeur obtenue est notée b dpH dV . Les courbes tracées suite au titrage pH-métrique sont pH = f(Vb) et b dpH dV = g(Vb) (document 8).3.3.1. Parmi les courbes 1 et 2, quelle est celle qui représente pH = f(Vb) et celle qui
représente b dpH dV = g(Vb) ? Justifier.3.3.2. Déterminer la valeur du volume équivalent VE par une méthode de votre choix.
COOH. ACCÈS CORRECTION
3.6. Quelles caractéristiques doit posséder une réaction chimique
titrage ? nE(HOi3.10. Déduire des résulta
à la valeur attendue.
3.12. Parmi les indicateurs colorés acido-basiques proposés dans le tableau ci-après, quel est
celui qui est le mieux adapté au titrage précédent ? Justifier. Indicateur coloré Couleur acide Zone de virage Couleur basiqueVert de bromocrésol jaune 3,8 5,4 bleu
Phénolphtaléine incolore 8,2 10 rose
jaune 10,1 12,0 rouge-orangéDonnées :
: M(C13H18O2) = 206 g.mol-1.ACCÈS CORRECTION
Extrait 2 : Bac S 2013 Polynésie http://labolycee.orgEXERCICE I.
ACCÈS CORRECTION
européenne. Celle- tartrique dans le vin.Dans cet exercice,
Les parties 1 et 2 sont indépendantes.
Données :
Masses molaires atomiques :
Élément H C O N S
M (g/mol) 1,00 12,0 16,0 14,0 32,1
2A : M(H2A) = 150 g.mol-1.
foncé. Les ions iodure I, les ions sulfate SO42 et le dioxyde de soufre en solution sont incolores.1. Dosage du dioxyde de soufre dans le vin.
SO2(aq)
diiode aqueux I2(aq). Pour cela, il introduit dans un erlenmeyer, un volume V1 = (20,000,05) mL de vin blanc
également incolore.
La solution titrante, de concentration en diiode C2 = (1,000,01)×102 mol.L-1 est ensuite
E = (6,28
0,05) mL de solution de
diiode. I2(aq) + SO2(aq) + 2H2O(l) 2I(aq) + SO42(aq) + 4H+(aq) ivalence.1.2. Déterminer la concentration molaire C1 en dioxyde de soufre de ce vin et en déduire que sa
concentration massique Cmexp en dioxyde de soufre est égale à 0,201 g.L-1. mexp mexp C dont on admet que, dans les conditions de 222mexpE2 mexp E 2
ǻquotesdbs_dbs30.pdfusesText_36
[PDF] calculer concentration en ions h3o+
[PDF] calculer concentration en ions oxonium
[PDF] calcul concentration h3o+ avec ph
[PDF] calcul centre de carène
[PDF] stabilité du navire pdf
[PDF] stabilité du navire pour les nuls
[PDF] courbe de stabilité navire
[PDF] calcul du tirant d'eau d'un navire
[PDF] equilibre d'un bateau
[PDF] exercice de stabilité d'un navire
[PDF] métacentre de carène
[PDF] calcul prix d'équilibre lait
[PDF] comment déterminer le prix de vente d'un produit
[PDF] fixation des prix de vente pdf
