 Formulaire de physique-1.pdf
Formulaire de physique-1.pdf
1ère loi de Kepler. Trajectoire = ellipse. 2ème loi de Kepler. Aires égales en h = 663.10-34 J .s ; constante de Planck m : masse de la particule (kg) v ...
 Calculer une quantité de matière
Calculer une quantité de matière
1 Rechercher la formule chimique de l'éthanol. 2 En déduire sa masse molaire. 3 Quelle est la masse volumique de l'éthanol ? 4 Calculer la quantité de matière
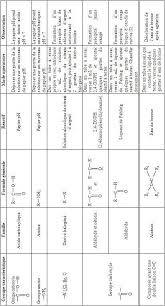 RAPPELS DE CHIMIE ORGANIQUE DE 1ERE S
RAPPELS DE CHIMIE ORGANIQUE DE 1ERE S
➢ La formule semi-développée : On ne fait plus apparaître les liaisons entre les atomes C N et O et l'atome H. Ex : C2H6O
 Chapitre 1 La quantité de matière la concentration molaire et le
Chapitre 1 La quantité de matière la concentration molaire et le
3 = 10 g.mL-1. Evidemment
 Les grandeurs physiques et leurs unités. (à connaître par cœur) Il ne
Les grandeurs physiques et leurs unités. (à connaître par cœur) Il ne
mesure et elle s'exprime avec une unité. Les expressions littérales « formules reliant différentes grandeurs physiques » (à connaître et à savoir utiliser).
 Exercices de physique-chimie Première Spécialité
Exercices de physique-chimie Première Spécialité
1/ Déterminer `a l'aide de la classification périodique les formules des ions présents dans ce solide. 2/ En déduire la formule chimique de ce solide ionique. 3
 THEME: CHIMIE ORGANIQUE TITRE DE LA LEÇON: LE BENZÈNE
THEME: CHIMIE ORGANIQUE TITRE DE LA LEÇON: LE BENZÈNE
Page 6. 6. Situation d'évaluation. Au cours d'une séance de travaux pratiques le professeur de Physique Chimie de la classe de 1ère D du L.M.Y.A. verse
 Programme de physique-chimie de première générale
Programme de physique-chimie de première générale
Le programme de physique-chimie de la classe de première s'inscrit dans la continuité de première que les élèves justifient la relation entre nom et formule ...
 PHY-144 : Introduction à la physique du génie Chapitre 6
PHY-144 : Introduction à la physique du génie Chapitre 6
Exemple 6.3 : Calculez la vitesse angulaire de rotation de la Terre sur son axe en rad/s. On sait que la Terre fait un tour complet en 1 jour : -5. 1 tour 2π
 Formulaire de physique-1.pdf
Formulaire de physique-1.pdf
Formules de physique 1ère loi. Si pas de force résultante MRU ou immobile. 2ème loi ... S (m2) b : coef. de dilatation superficielle (K-1) ;.
 LES ALCANES
LES ALCANES
6. Modèle de Lewis : C. L'atome de carbone peut avoir 4 liaisons covalentes simples Les alcanes sont des hydrocarbures de formule brute CnH2n+2.
 Chapitre 1 La quantité de matière la concentration molaire et le
Chapitre 1 La quantité de matière la concentration molaire et le
Cette année on va aller encore plus loin en ajoutant des formules ! Je vais grandeur physique (car mesurable) qui s'exprime en mole de symbole « mol ».
 Calculer une quantité de matière
Calculer une quantité de matière
1 Rechercher la formule chimique de l'éthanol. 2 En déduire sa masse molaire. 3 Quelle est la masse volumique de l'éthanol ? 4 Calculer la quantité de matière
 correction exercices Précis de Physique-Chimie chapitre1 à 4
correction exercices Précis de Physique-Chimie chapitre1 à 4
à formuler sur le contenu ou la présentation du Précis de Eléments de correction des exercices du chapitre 6 : oxydoréduction : application à la ...
 La mole Ce quil faut retenir La mole : Exercices dapplication niveau
La mole Ce quil faut retenir La mole : Exercices dapplication niveau
V : volume de l'échantillon en mL. Les formules suivantes sont à connaître : m= n M. N= n NA où NA est le nombre d'Avogadro (NA = 602.1023 mol-1).
 Rappel : les formules de chimie
Rappel : les formules de chimie
La masse molaire moléculaire s'obtient en ajoutant les masses molaires T et la quantité de matière d'un gaz sont reliés par une formule applicable.
 RAPPELS DE CHIMIE ORGANIQUE DE 1ERE S
RAPPELS DE CHIMIE ORGANIQUE DE 1ERE S
? La formule semi-développée : On ne fait plus apparaître les liaisons entre les atomes C N et O et l'atome H. Ex : C2H6O
 Cours doptique géométrique – femto-physique.fr
Cours doptique géométrique – femto-physique.fr
L'optique géométrique s'intéresse au trajet qu'empreinte la lumière à formules du grandissement permettent d'obtenir deux lois équiva- lentes :.
 22-Fascicule Physique chimie 1ère S IA PG-CDC Février 2020 (VF)
22-Fascicule Physique chimie 1ère S IA PG-CDC Février 2020 (VF)
Fascicule de Sciences Physiques de Première S /IA Pikine-Guediawaye /CDC - 2018 Déterminer la formule brute d'un composé à partir des résultats de ...
1EIE/TEIE
PASCAL ASMUSSEN LES ALCANES 1/5
LES ALCANES
1. Tétravalence du carbone
1.1. Rappel
L'atome de carbone a 6 électronsC12
6Modèle de Lewis : C
L'atome de carbone peut avoir 4 liaisons covalentes simplesLes atomes voisins forment alors un tétraèdre autour de l'atome de carbone qui est dit tétragonal.
1.2. Représentation perspective conventionnelle
Dans la molécule de méthane CH
4, l'atome de
carbone est situé au centre d'un tétraèdre régulier.Pour représenter sur un plan une structure
tridimensionnelle, il faut utiliser des notations conventionnelles ayant une signification spatiale telles celles de la représentation perspective. C H PrivH Priv H PrivH PrivPar convention, on représente :
• par un trait plein (-) , les liaisons situées dans le plan de figure, la valeur de l'angle entre ces liaisons
étant respectée ;
• par un trait pointillé (----) ou par un triangle allongé hachuré ( ), une liaison dirigée vers
l'arrière du plan de figure ; • par un triangle allongé plein ( ), une liaison dirigée vers l'avant du plan de figure.1.3. Les hydrocarbures
Les hydrocarbures sont des composés organiques ne contenant que les éléments hydrogène et carbone.
Leur formule brute est C
xHy.2. Les alcanes
2.1. Définition
Les alcanes sont des hydrocarbures de formule brute C nH2n+2. Tous leurs atomes de carbone sont tétragonaux. Le méthane CH4 est le plus simple des alcanes.
2.2. L'éthane : la liaison simple C - C
L'éthane, de formule brute C
2H6, est un alcane. La structure de la molécule d'éthane fait apparaître
• une liaison covalente simple entre les atomes de carbone tétragonaux ; • des liaisons covalences simples entre les atomes de carbone et les atomes d'hydrogène.Formule semi-développée :
H3C¾CH3 ou CH3 ¾ CH3
Formule développée :
C H PrivH Priv HPrivC H
Priv H PrivH Priv1EIE/TEIE
PASCAL ASMUSSEN LES ALCANES 2/5 Le groupe- CH3 s'appelle un groupe méthyle.Les deux groupes méthyle - CH3 peuvent tourner l'un par rapport à l'autre, l'axe de rotation étant l'axe
de la liaison C - C. Nous obtenons ainsi une infinité de dispositions spatiales de la molécule d'éthane.
Le phénomène vu sur le modèle moléculaire correspond à la réalité : à température ordinaire, la molécule
d'éthane passe continuellement d'une disposition, ou conformation, à une autre. Ce résultat est général
Dans les hydrocarbures, il y a libre rotation autour des liaisons simples C - C.2.3. La chaîne carbonée des alcanes
Remplaçons l'un des atomes d'hydrogène du modèle moléculaire de l'éthane par un groupe méthyle - CH3 ;
nous obtenons ainsi celui de la molécule de propane C3H8. En répétant celte opération, nous construisons
une série de composés : les alcanes.Les alcanes sont des hydrocarbures à chaîne carbonée dite saturée : toutes les liaisons C - C sont simples.
Pour la formule brute C4H10 , deux possibilités apparaissent :• un alcane à chaîne carbonée non ramifiée, dite aussi chaîne linéaire : le butane
H3C ¾ CH2 ¾ CH2 ¾ CH3
• un alcane à chaîne carbonée ramifiée : le méthylpropaneCH3CH CH3
CH 3Ces deux alcanes ont même formule brute C4H10 , mais leurs structures sont différentes : ce sont des
isomères de constitution. Comme ils ne diffèrent que par l'enchaînement de leurs atomes de carbone,
cette isomérie de constitution est appelée isomérie de chaîne.Des isomères de constitution ont même formule brute, mais des formules développées différentes. Ils ont
des propriétés physiques et chimiques différentes. Voir ci-dessous. Formule brute noms des isomères température d'ébullition butane -0,5 C 4H10 méthylpropane -10 pentane 36 méthylbutane 25 C 5H12 diméthylpropane 92.4. Formules développées et semi-développées
La formule brute étant insuffisante pour représenter deux isomères de constitution, on est amené à
utiliser des formules plus précises.• Dans une formule développée, toutes les liaisons sont représentées par des tirets. Notons que cette
formule, dite plane, ne représente pas la disposition spatiale des atomes : elle indique simplement quels
sont les atomes directement liés les uns aux autres. Pour préciser la disposition spatiale des atomes, il faut
utiliser la représentation en perspective.1EIE/TEIE
PASCAL ASMUSSEN LES ALCANES 3/5 • Dans une formule semi-développée, seules les liaisons carbone-carbone sont représentées par un tiret,
simple ou double selon la nature de la liaison. Les liaisons carbone-hydrogène ne sont pas représentées,
mais les atomes d'hydrogène sont, dans la formule, directement accolés aux atomes auxquels ils sont liés
2.5. Nomenclature des alcanes
La nomenclature des composés chimiques obéit à des règles définies par l'Union Internationale de Chimie
Pure et Appliquée (U.IC.P.A.).
· Alcanes à chaîne carbonée non ramifiéeLes quatre premiers alcanes (1 < n < 4) portent des noms consacrés par l'usage : méthane, éthane, propane,
butane. Les noms des alcanes linéaires suivants (n > 5) sont constitués d'un préfixe qui indique le nombre
d'atomes de carbone de la chaîne (gent-, hex-, hept-, oct-...) suivi de la terminaison -ane caractéristique
des alcanes.· groupes alkyles non ramifiés :
En retirant un atome d'hydrogène à un atome de carbone terminal d'un alcane linéaire, on obtient un
groupe alkyle dont le nom s'obtient en remplaçant la terminaison -ane de l'alcane par la terminaison -yle.
Exemple : méthyle - CH3 ; éthyle - CH2 - CH3 ou - C2H5. en généralisant CnH2n+2 peut s'écrire CnH2n+1 - HGroupe alkyle symbolisé par R -
Exemple : Groupe méthyle - CH
3 ; Groupe éthyle - CH2 - CH3 ou - C2H5. Groupe propyle : - C3H7
Un alcane peut donc s'écrire R - H
· alcane à chaîne carbonée ramifiéeLa chaîne carbonée la plus longue est appelée chaîne principale. Son nombre d'atomes de carbone
détermine le nom de l'alcane. Afin de pouvoir situer les ramifications, on numérote la chaîne principale de
façon à ce que le numéro du premier atome de carbone portant une ramification soit le plus petit possible.
Le nom complet de l'alcane est constitué des noms des ramifications alkyles précédés de leur indice de
position et suivis du nom de l'alcane linéaire de même chaîne principale.Dans les noms composés, on élide le -e final des ramifications et, si plusieurs d'entre elles sont identiques,
leur nombre est indiqué à l'aide d'un préfixe di, tri, tétra...CH3CH2CHCH2CH3
CH2 CH CH3CH3654
3 2 16 atomes de carbone : hexane
2 ramifications : 1 groupe méthyle en 2ème position
1 groupe éthyle en 4ème position
Nom de l'alcane : 4-éthyl-2-méthylhexane
Autres exemples :
CH3CCHCH3
CH31432CH3
CH3CH3CH2CHCH2CH3
CH2CH3 CH3654321
CHCH2CH
CH3871EIE/TEIE
PASCAL ASMUSSEN LES ALCANES 4/5 3. Les réactions de combustions Lors d'une réaction de combustion, il y a destruction des liaisons C- H et C- C.3.1. Combustion complète
La combustion est complète lorsqu'on est en excès d'oxygène.Expérience : Combustion du méthane
Le trou à la base de la cheminée est entrouvert, la flamme comporte un cône bleu surmonté d'une zone pâle.Écrivons l'équation-bilan de réaction.
CH4 + 2 O2 ¾® CO2 + 2 H20
Conclusion : en présence d'un excès de dioxygène, la combustion du méthane est complète et donne de l'eau et du dioxyde de carbone. Alcane + dioxygène ¾® dioxyde de carbone + eau
La réaction est exothermique. On définit le pouvoir calorifique comme étant la quantité de chaleur dégagée
par la combustion de 1 m3 de gaz mesuré dans les conditions normales de température et de pression.
La quantité de chaleur dégagée est de l'ordre de 37 000 kJ/m3.Combustion explosive
Si l'on place exactement un volume de méthane et deux volumes de dioxygène, la réaction est explosive.
Ceci peut se produire dans les mines où il y a des poches de méthane, une étincelle suffit pour provoquer la
réaction : c'est le coup de grisou souvent meurtrier.Généralisation
Lors d'une réaction complète, nous pouvons écrire l'équation-bilan suivante C nH2n+2 + (3n + 1) 2 O2 ¾® n CO2 + (n + 1) H2O
Application : écrire la réaction de combustion complète du propane et du butane. H2O et CO2
1EIE/TEIE
PASCAL ASMUSSEN LES ALCANES 5/5 3.2. Combustion incomplèteExpérience :
Le trou à la base de la cheminée est bouché par la virole, la flamme est jaune et éclairante.Conclusion : en présence d'un défaut de dioxygène, la combustion du méthane est incomplète et donne de l'eau et du carbone. CH
4 + O2 ¾® C + 2 H20
Alcane + dioxygène ¾® carbone + eau
Equation générale :
C nH2n+2 + n+1 2 O2 ¾® n C + (n + 1) H2O
4. Les réactions de substitution
Elles consistent à remplacer un atome d'hydrogène dans la molécule 'un alcane par un autre atome ou par
un groupe d'atomes. Il y a rupture des liaisons C -H et remplacement progressif des atomes d'hydrogène par des atomes d'éléments halogènes : Chlore, Brome...Les dérivés halogènes des alcanes sont des produits de base de nombreuses synthèses, ce sont aussi de
bons solvants.Exemples :
(1) : CH4 + Cl2 ¾® CH3Cl + HCl chlorométhane (gaz)
(2) : CH3Cl + Cl2 ¾® CH2Cl2 + HCl dichlorométhane (gaz)
(3) : CH3Cl2 + Cl2 ¾® CHCl3 + HCl trichlorométhane ou chloroforme (liquide)
(4) : CHCl3 + Cl2 ¾® CCl4 + HCl tétrachlorométhane (liquide) tétrachlorure de carbone
(1) : Synthèse des caoutchoucs, résines..(3) et (4) : solvants, préparation des dérivés fluorés (les fréons), gaz propulseur, fluide caloporteur.
H2O et C
quotesdbs_dbs19.pdfusesText_25[PDF] formule physique chimie 3eme pdf
[PDF] formule physique terminale s
[PDF] formule pour calculer la taille de l'échantillon pdf
[PDF] formule pour calculer le chiffre d'affaire
[PDF] formule pour calculer le surplus du producteur
[PDF] formule pour calculer une masse
[PDF] formule prix psychologique bac pro commerce
[PDF] formule probabilité terminale st2s
[PDF] formule probabilité totale term es
[PDF] formule prorata tva france
[PDF] formule puissance dissipée
[PDF] formule puissance mécanique
[PDF] formule puissance thermique
[PDF] formule sensibilité
