 Rappels chimie seconde
Rappels chimie seconde
RAPPELS DE SECONDE. FORMULAIRE DE CHIMIE. Utilisez les outils de l'analyse dimensionnelle pour mémoriser et contrôler ces relations ! La masse volumique ρ
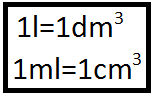 Les grandeurs physiques et leurs unités. (à connaître par cœur) Il ne
Les grandeurs physiques et leurs unités. (à connaître par cœur) Il ne
secondes. Page 3. Les expressions littérales « formules reliant différentes grandeurs physiques » (à connaître et à savoir utiliser). L'emploi de ces formules
 FORMULES DE PHYSIQUE-CHIMIE A CONNAITRE POUR LE
FORMULES DE PHYSIQUE-CHIMIE A CONNAITRE POUR LE
FORMULES DE PHYSIQUE-CHIMIE A CONNAITRE POUR LE BREVET. Formule à connaître : Formules « annexes » : Exemple : Page 1 sur 4
 Exercices de physique-chimie Seconde
Exercices de physique-chimie Seconde
`A partir de cette formule isolez la masse volumique ρ. 7/ Donner la valeur de la masse volumique de l'eau ρeau. Exercice 2. Le cyclohexane est
 Programme de physique-chimie de seconde générale et
Programme de physique-chimie de seconde générale et
Échelle microscopique : molécules atomes et ions
 Chapitre 1 La quantité de matière la concentration molaire et le
Chapitre 1 La quantité de matière la concentration molaire et le
Cette année on va aller encore plus loin en ajoutant des formules ! Je vais C'est une grandeur physique (car mesurable) qui s'exprime en mole de symbole ...
 Niveau : Seconde Type de ressources : Analyse documentaire
Niveau : Seconde Type de ressources : Analyse documentaire
Formules développées et semi-développées. •. Groupes caractéristiques. Capacités travaillées physique-chimie/enseignement/ressources- · documentaires/groupes ...
 Physique-Chimie-PSI-2020.pdf
Physique-Chimie-PSI-2020.pdf
9 juil. 2020 Le sujet comprend deux problèmes indépendants le premier de Physique et le second de. Chimie. • Les données et formules utiles à la résolution ...
 Fiche de révision de 3eme en physique chimie - DNB
Fiche de révision de 3eme en physique chimie - DNB
Formule chimique de l'ion g) Le son : fréquence. Un son est émis par la membrane d'un haut-parleur : Si la membrane vibre 1000 fois par seconde le son émis ...
 Rappels chimie seconde
Rappels chimie seconde
La densité d d'une espèce chimique solide ou liquide s'obtient en divisant sa masse volumique ? par celle de l'eau ?eau (les.
 Chapitre 0 - Révisions du programme de Seconde
Chapitre 0 - Révisions du programme de Seconde
programme de physique chimie en classe de seconde. Les principaux chapitres concernent la structure de l'atome et de la matière les formules de chimie
 FORMULES DE PHYSIQUE-CHIMIE A CONNAITRE POUR LE
FORMULES DE PHYSIQUE-CHIMIE A CONNAITRE POUR LE
FORMULES DE PHYSIQUE-CHIMIE A CONNAITRE POUR LE BREVET. Formule à connaître : Formules « annexes » : Exemple : Page 1 sur 4
 Les grandeurs physiques et leurs unités. (à connaître par cœur) Il ne
Les grandeurs physiques et leurs unités. (à connaître par cœur) Il ne
Il ne faut pas confondre une grandeur physique et son unité. peuvent se calculer en utilisant une expression littérale que l'on appelle formule.
 LIVRET DE REVISION SPECIALITE PHYSIQUE-CHIMIE
LIVRET DE REVISION SPECIALITE PHYSIQUE-CHIMIE
Vous pouvez retrouver des formules que vous allez aborder en 1ere spé qui n'ont pas été vu en seconde grâce aux unités ! À vous de jouer ! Grandeurs à trouver.
 DEVOIR SURVEILLE - SCIENCES PHYSIQUES
DEVOIR SURVEILLE - SCIENCES PHYSIQUES
Formule développée. Formule semi-développée sciences physiques et chimiques - Seconde http://cedric.despax.free.fr/physique.chimie/.
 Exercices de physique-chimie Seconde
Exercices de physique-chimie Seconde
`A partir de cette formule isolez la masse volumique ?. 7/ Donner la valeur de la masse volumique de l'eau ?eau. Exercice 2. Le cyclohexane est un solvant
 Physique Chimie
Physique Chimie
???/???/???? Physique Chimie Nathan pour le Cycle 4 ... Matériaux et propriétés physiques . ... Deuxième méthode :le coefficient de proportionnalité.
 La mole Ce quil faut retenir La mole : Exercices dapplication niveau
La mole Ce quil faut retenir La mole : Exercices dapplication niveau
Les formules suivantes sont à connaître : Chimie soutien seconde seconde. Exercice IV. Un flacon contient 800 mL de chlorododécane liquide de masse ...
 Chimie Premier exercice : Liaisons chimiques (65 points) Deuxième
Chimie Premier exercice : Liaisons chimiques (65 points) Deuxième
Écrire la formule ionique et la formule statistique de ce composé. 4. Expliquer la liaison chimique établie entre le phosphore et le chlore. Donner la formule.
Chapitre 0
Révisions du programme de Seconde0.1 Rappels de Mécanique . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .2
0.1.1 Définition . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
20.1.2 Référentiels . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
30.1.31èreloi de Newton (ou Principe d"Inertie) et3èmeloi de Newton (ou Principe
d"Action/Réaction) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 30.1.4 Interaction gravitationnelle . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
30.2 Constitution d"un atome . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
40.2.1 Définitions . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
40.2.2 Structure électronique . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
40.2.3 Ions . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
50.3 Les Molécules . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
50.3.1 Liaisons covalentes . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
50.3.2 Formules . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
60.3.3 Isomères . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
60.4 Quantité de matière : la mole . . . . . . . . . . . . . . . . . . . . . . . . . .
60.4.1 Formules . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
70.4.2 Dilution . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
70.5 Ondes et signaux périodiques . . . . . . . . . . . . . . . . . . . . . . . . . .
80.5.1 Signal périodique . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
80.5.2 Ondes électromagnétiques et mécaniques . . . . . . . . . . . . . . . . . . . . . .
80.5.3 Réflexion et réfraction de la lumière . . . . . . . . . . . . . . . . . . . . . . . .
90.5.4 Dispersion de la lumière . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
102Chapitre 0.Révisions du programme de SecondeD
ansce premier chapitre, on propose de rappeler l"ensemble des notions essentielles issues du programme de physique chimie en classe de seconde. Les principaux chapitres concernent lastructure de l"atome et de la matière, les formules de chimie, les mouvements et forces, les réactions
chimiques, les signaux périodiques et la lumière.0.1 Rappels de Mécanique
0.1.1 Définition
L"étude des mouvements et des forces s"inscrit dans un domaine de la physique appelé la Mécanique.
Plusieurs définitions sont essentielles lorsque l"on traite un problème de mécanique : le système étudié,
le référentiel d"étude, la trajectoire, la vitesse, et la notion de force.En mécanique, lesystèmeest le corps, la substance, la particule, dont on souhaite connaître et étudier
le mouvement. Il peut être solide, liquide ou gazeux, et constitué de plusieurs sous-systèmes.
Lemouvementse définit comme la position du système à tout instant. Il y donc une notion spatiale
(la trajectoire) et temporelle (la vitesse).Leréférentielest le système d"axes (ou repère en maths) par rapport auquel on décide de se placer
pour étudier le mouvement du système. Unréférentiel galiléenest un référentiel dans lequel la 1ère
loi de Newton s"applique (aussi appeléePrincipe d"Inertie) (voir plus loin).Latrajectoireest l"ensemble des points de l"espace par lequel passe le système au cours de son mouve-
ment. Les principaux adjectifs pour qualifier une trajectoire sont :rectiligne,circulaire,curviligne.Figure 1- Trois types de trajectoires à connaître
Pour qualifier la vitesse d"un objet, il convient d"employer les termesuniforme,accéléréouralenti.
Enfin, l"origine du mouvement d"un système provient de la résultante des forces qui s"exercent sur le
système. Uneforcese définit par un vecteur traduisant une action exercée sur le système. Elle possède
donc unedirection,un sens,une intensité(norme) ainsi qu"unpoint d"application. On distingue lesforces à distance(comme l"attraction gravitationnelle) et les forcesde contact (comme les frottements).Poisson Florian Spécialité Physique-Chimie 1ère
0.1.Rappels de Mécanique30.1.2 Référentiels
Il existe 3 référentiels supposés galiléens à connaître : Référentiel héliocentrique, ayant pour origine le centre du soleil et 3 axes fixes Référentiel géocentrique, ayant pour origine le centre de la Terre et 3 axes fixesRéférentiel terrestre, tout référentiel pris à la surface de la Terre avec trois axes suivant le
même mouvement de rotation que la Terre.0.1.31èreloi de Newton (ou Principe d"Inertie) et3èmeloi de Newton (ou Principe
d"Action/Réaction)1èreloi de Newton : Principe d"InertieDans un référentiel galiléen, la somme des forces extérieures s"appliquant sur un système est
nulle si et seulement si le mouvement est rectiligne uniforme ou immobile. -→Fext= 0??v?=cste?3èmeloi de Newton : Principe d"Action-RéactionTout corps A exerçant une force sur un corps B subit la même force de même direction, de
même intensité mais de sens contraire, de la part du corps B. -→FA/B=--→FB/A0.1.4 Interaction gravitationnelleL"interaction gravitationnelle, ou gravitation, est la force attractive à distance qui s"exerce entre deux
corps dès lors qu"ils possèdent une masse (donc constitués de matière).Figure 2- Schéma représentant l"interaction gravitationnelle entre deux corpsAetBInteraction gravitationnelle
FA/B=-GmA.mBd
2u?Avec :
G= 6,67.10-11N.m2.kg-2la constante gravitationnelle mAla masse du corps A
mBla masse du corps B
dla distance entre le centre de gravité de A et celui de B u?un vecteur unitaire dirigé de A vers BSpécialité Physique-Chimie 1èrePoisson Florian
4Chapitre 0.Révisions du programme de SecondeDans le cas particulier où l"on s"intéresse à l"interaction gravitationnelle ayant lieu entre la Terre et
un objet situé à sa surface, on appelle alors cette forcele poids, noté-→P:Poids P=mg?Avec :
mla masse de l"objet g?le champ de pesanteur, d"intensitég= 9,81m.s-2 -→Ple poids, vertical vers le bas0.2 Constitution d"un atome0.2.1 Définitions
Un atome est constitué d"un noyau qui contient des nucléons (protons et neutrons), et d"électrons qui
gravitent autour du noyau. L"atome est électriquement neutre.Figure 3- Schéma d"un atome On noteZle numéro atomique, ou nombre de protons;Nle nombre de neutrons; etAle nombre demasse ou nombre de nucléons. Les neutrons sont électriquement neutres, alors que les protons sont
chargés positivement et que les électrons sont chargés négativement. Pour assurer l"électroneutralité
de l"atome, il y a doncautant de protons que d"électrons. La charge d"un proton est appelée charge élémentaireet vaute= 1,6.10-19C(Coulomb). Celle d"un électron est donc de-e.L"ensemble des différents éléments chimiques connus sont rassemblés dans la classification périodique
des éléments. La notation usuelle pour un élément est AZX.Exemple:
126Cest l"atome de carbone 12, constitué de 12 nucléons dont 6 protons et 6 neutrons, et donc également
6 électrons.
On appelleisotopesdeux atomes ayant le même nombre de protonsZmais un nombre différents de neutrons, et donc de nucléonsA.0.2.2 Structure électronique
Les électrons d"un atome se répartissent sur des couches bien précises. Les trois premières couches
sont notéesK,L,Met contiennent respectivement 2 électrons, 8 et 8. L"ordre de remplissage se fait
en commençant par la coucheK, puis laLet enfin laM. La dernière couche contenant des électronsPoisson Florian Spécialité Physique-Chimie 1
ère
0.3.Les Molécules5est appeléecouche externeoucouche de valence. Les autres couches rassemblent les électrons
ditsde coeur.Exemples:
1.126C possède 6 protons donc 6 électrons. Sa structure électronique est donc :(K)2(L)4
2.3517Cl possède 17 électrons, d"où la structure électronique :(K)2(L)8(M)7
0.2.3 Ions
Les ions sont des espèces chargées obtenues lorsqu"un atome perd ou gagne un ou plusieurs électrons
sur sa couche externe. Les atomes qui perdent des électrons forment des cations chargés positivement,
alors que ceux qui en gagnent deviennent des anions, chargés négativement.Règles du duet et de l"octet
Un ion formé est stable lorsque sa structure électronique comporte une couche externe rempliecomme celle des éléments de la dernière colonne, celle des gaz rares (ou nobles). Les ions ainsi
formés sont obtenus en perdant ou en gagnant le nombre d"électrons le plus petit possible pour avoir une couche externe remplie.Exemples: 1.Le magnésium
2412Mg, de structure électronique(K)2(L)8(M)2, va ainsi perdre deux électrons
pour former l"ion Mg2+de structure électronique(K)2(L)8, comme le néon Ne
2.Le c hlore
3517Cl de structure électronique(K)2(L)8(M)7va quant à lui gagner un électron pour
former l"ion Cl -, qui possède la même structure électronique que l"argon Ar :(K)2(L)8(M)80.3 Les Molécules
0.3.1 Liaisons covalentes
Une molécule est un assemblage de plusieurs atomes, reliés entre eux par des liaisons qui peuvent
être de plusieurs natures. Laliaison covalenteest une liaison entre deux atomes faisant intervenir
un doublet d"électrons, chaque atome fournissant un électron de sa couche externe pour former cette
liaison, aussi appelée doublet liant. Pour former des molécules, les atomes respectent égalementla
règle du duet et de l"octet, c"est-à-dire qu"un atome va former un nombre de liaisons autour de lui
de sorte à être entouré par un nombre d"électrons correspondant à une couche externe remplie.
Deux atomes, en fonction de leur nature et du nombre d"électrons externes qu"ils possèdent, peuvent
former une liaison simple, double ou triple.Exemples:
1. Le c hlorured"h ydrogèneHClest formé par une liaison simple entre un atome d"hydrogène et un atome de chlore. 2. Le dio xygèneest formé par une double li aisonen tredeux atomes d"o xygène: OO.Spécialité Physique-Chimie 1
èrePoisson Florian
6Chapitre 0.Révisions du programme de SecondeAtomesSymboleStructure électroniqueNombre de liaisonsFormule
Hydrogène2
1H(K)11H
Magnésium24
12Mg(K)2(L)8(M)22Mg
Aluminium27
13Al(K)2(L)8(M)33Al
Carbone12
6C(K)2(L)44C
Azote14
7N(K)2(L)53N
Oxygène16
8O(K)2(L)62O
Azote35
17Cl(K)2(L)8(M)71Cl
0.3.2 Formules
Formule brute:La formule brute d"une molécule donne la nature des atomes qui la constituent ainsi que le nombre de chacun de ces atomes.Formule développée:La formule développée d"une molécule fait apparaitre toutes les liaisons entre
les atomes.Formule semi-développée:La formule développée d"une molécule fait apparaitre toutes les liaisons
entre les atomessauf les liaisons avec les atomes d"hydrogène.Exemple:
MoléculeFormule bruteFormule développéeFormule semi-développéeEthaneC
2H 6H 3CCH 3CH H HCH HH0.3.3 Isomères
Desisomèressont des molécules qui ont la même formule bute mais pas la même formule semi-
développée (ou développée). De telles molécules auront des propriétés physico-chimiques différentes.
Exemple:
H 3CCO CH 3H 3CCH 2CHO propanone propanal0.4 Quantité de matière : la mole
En chimie, la quantité de matière désigne le nombre d"entités (atomes, molécules, ions) présentes
dans un échantillon. Pour éviter d"avoir à manipuler des nombres trop grands, on utilise une unité
adaptée appeléela mole (mol).1molcorrespond à6,02.1023entités chimiques identiques. La réfé-
rence prise pour définir la mole est le carbone. Une mole correspond au nombre d"atomes de carbone
présents dans un échantillon de carbone de 12 grammes. On définit ainsi le nombre d"Avogadro,
N A= 6,02.1023mol-1.Poisson Florian Spécialité Physique-Chimie 1ère
0.4.Quantité de matière : la mole70.4.1 Formules
Diverses formules permettent de relier les différentes grandeurs utiles pour décrire un système chimique.
On peut ainsi relier laquantité de matièreà lamassegrâce à lamasse molaire; ou encorele
volume, lamasse volumique, laconcentration molaireouconcentration massique. Voici un résumé de toutes ces formules de bases en chimie :Quantité de matière n=NN A nla quantité de matière (en mol)Nle nombre d"entités
NA= 6,02.1023mol-1Masse molaire
M=mnMla masse molaire (eng.mol-1)
mla masse (en g)quotesdbs_dbs9.pdfusesText_15[PDF] formules ratios commerciaux
[PDF] formules remerciements thèse
[PDF] formules vecteurs seconde
[PDF] fort de loncin
[PDF] fort l'écluse
[PDF] forte personnalité pdf
[PDF] fortrainjobs
[PDF] fortuneo
[PDF] forum accompagnant educatif et social
[PDF] forum bourse de casablanca
[PDF] forum capeps interne
[PDF] forum capes anglais
[PDF] forum capes anglais 2018
[PDF] forum capes maths 2017
