 Cours n2 1S
Cours n2 1S
Exemple : Le chlorure de Sodium de formule statistique
 Accompagnement personnalisé – Physique-chimie Concentration
Accompagnement personnalisé – Physique-chimie Concentration
molaire effective en ions chlorure soit [Cl-]=0750 mol.L-1. 1-Écrire la formule du chlorure fer (III). 2-Écrire l'équation de la réaction de dissolution du
 TP 5 chimie : Terminale Comment déterminer les domaines de
TP 5 chimie : Terminale Comment déterminer les domaines de
concentration molaire effective en In- et l' absorbance A à différents pH. L'Acide borique de formule H3BO3 est un acide de pKA = 93. Faible toxicité.
 Mélange de solutions électrolytiques Exercice n°2
Mélange de solutions électrolytiques Exercice n°2
concentration molaire effective en ions chlorure soit [Cl-]=0750 mol.L-1. 1-Écrire la formule du chlorure fer (III). 2-Écrire l'équation de la réaction de
 Concentration et solutions électrolytiques Correction
Concentration et solutions électrolytiques Correction
2- Quels sont la concentration massique (titre) et la concentration en soluté apporté Concentration effective des ions 4 ... 1- Formules des ions :.
 Prof Nachit
Prof Nachit
Quelle est la concentration effective de l'espèce chimique existante dans la solution? 2- La concentration molaire effective des ions chlorure dans la
 Co ohésio on de e la m matièr re
Co ohésio on de e la m matièr re
a formule s quation de 3) Concentration molaire et concentration effective ... réaction donne des ions oxonium et des ions nitrate de formule NO3.
 Chimie 1re S - Livre du professeur
Chimie 1re S - Livre du professeur
ner la concentration molaire d'une solu- Concentration molaire effective des ions en solution ... A. Formule statistique du chlorure de sodium.
 Chlorure de fer (III) hexahydraté
Chlorure de fer (III) hexahydraté
Formule : FeCl3 6 H2O. Masse molaire : 270
 Données : Conductivités molaires ioniques ?(C6H5CO2 - ) = 324
Données : Conductivités molaires ioniques ?(C6H5CO2 - ) = 324
Etablir la formule permettant d'obtenir la concentration molaire effective de l'acide benzoïque en solution dans l'état d'équilibre. Calculer sa valeur.
 [PDF] Cours n°2 : Solutions électrolytiques et concentrations
[PDF] Cours n°2 : Solutions électrolytiques et concentrations
Pour l'ion X effectivement présent en solution la concentration molaire effective est notée [X] [ ] = é ( ) é = ( ) [X] : concentration en ions présents
 [PDF] Concentration et solutions électrolytiques Correction - AlloSchool
[PDF] Concentration et solutions électrolytiques Correction - AlloSchool
1- Quelle est la masse molaire du sulfate d'aluminium ? 2- Quels sont la concentration massique (titre) et la concentration en soluté apporté du sulfate
 [PDF] Solutions électrolytiques et concentrations - AlloSchool
[PDF] Solutions électrolytiques et concentrations - AlloSchool
Le cristal Les ions Sa formule Le modèle éclaté Le modèle compact La concentration molaire effective [ ] d'une espèce chimique dans une solution est
 [PDF] Physique-chimie Concentration/ Problème de spécialité En cas de
[PDF] Physique-chimie Concentration/ Problème de spécialité En cas de
1- Donner les formules et les noms des solides ioniques utilisés pour préparer les solutions S1 et S2 2- Calculer les concentrations molaires des espèces
 [PDF] Travail dirigé 5 : La concentration dune solution - AFO
[PDF] Travail dirigé 5 : La concentration dune solution - AFO
a) Calculer la concentration molaire de ce sel b) Calculer les concentrations molaires des ions résultant de la dissociation du sel dans l'eau (R: a)
 [DOC] Concentration molaire apportée en soluté
[DOC] Concentration molaire apportée en soluté
La concentration molaire apportée en soluté est la quantité de matière de soluté dissoute par unité de volume de solution Elle est notée c et s'exprime
 [PDF] Série :Les solutions électrolytiques et concentrations - E-monsite
[PDF] Série :Les solutions électrolytiques et concentrations - E-monsite
Calculer les concentrations molaires des ions présents dans le mélange Le sel de Mohr est un solide ionique de formule statistique: (NH4)2Fe(SO4)26H2O
 [PDF] Les solutions : pourcentage massique molarité normalité molalité
[PDF] Les solutions : pourcentage massique molarité normalité molalité
b- Quelle est la concentration molaire effective des ions de cette solution ? c- Quelle masse de ce solide faut-il dissoudre pour préparer cette solution ?
 Concentration molaire - Première - Cours - PDF à imprimer
Concentration molaire - Première - Cours - PDF à imprimer
La concentration molaire effective d'un ion X en solution est notée [X] elle est donnée par la relation : Avec [X] en mol L-1 ; n(X) la quantité de matière
Comment calculer la concentration molaire effective ?
La concentration efficace médiane (CE50 ou EC50 en anglais) est une mesure de la concentration d'un médicament, d'un anticorps ou d'un toxique qui induit une réponse à mi-chemin (médiane) entre la ligne de base et l'effet maximum après un certain temps d'exposition à celui-ci.C'est quoi la concentration effective ?
Si on divise les deux côtés de l'expression de �� �� par la concentration en ions hydrogène, on obtient une équation qui permet de déterminer la concentration en ions hydroxyde. On insère la valeur de �� �� et la valeur de la concentration en ions hydrogène donnée dans le problème.Comment calculer la concentration molaire effective des ions hydroxyde ?
Pour calculer simplement la quantité ou le poids d'une substance nécessaire pour une solution normale souhaitée, la formule suivante peut être utilisée : Poids en grammes = normalité souhaitée x volume nécessaire en litres x PMG/valence (W = N x V x PMg/valence).
 TP 5 chimie : Terminale Comment déterminer les domaines de prédominance des formes acide et basique d'un indicateur coloré en solution aqueuse : le bleu de bromothymol ?
TP 5 chimie : Terminale Comment déterminer les domaines de prédominance des formes acide et basique d'un indicateur coloré en solution aqueuse : le bleu de bromothymol ? Objectifs.
Réinvestir la méthode d'analyse par spectrophotométrie pour déterminer, en fonction du pH, les domaines de
prédominance d'un indicateur coloré acido-basique. I. LES POURCENTAGES DES FORMES ACIDE ET BASIQUE DU BBT DANS UNE SOLUTION AQUEUSE.
1. Présentation des deux formes acide et basique.
Le bleu de bromothymol (BBT) est un couple acido-basique (HIn/In ) dont la forme acide (HIn) a une couleur différente de la forme basique (In ) en solution aqueuse. La prédominance de l'une de ces formes en solution est observ able car la forme basique In - est bleue et la forme acide HIn est jaune.2. Comment accéder aux pourcentages des formes acide et basique du BBT en fonction du pH ?
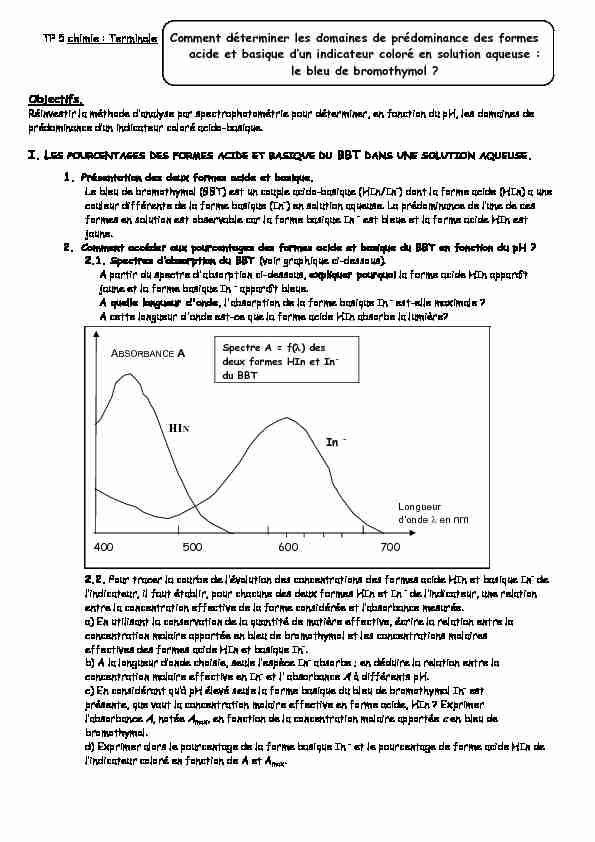
2.1. Spectres d'absorption du BBT (voir graphique ci-dessous).
A partir du spectre d'absorption ci-dessous, expliquer pourquoi la forme acide HIn apparaît jaune et la forme basique In apparaît bleue. A quelle longueur d'onde, l'absorption de la forme basique In est-elle maximale ?A cette longueur d'onde est-ce que la
forme acide HIn absorbe la lumière? b. Détermination des pourcentages des formes acide et basique.2.2. Pour tracer la courbe de l'évolution des concentrations des formes acide HIn et basique In-
de l'indicateur, il faut établir, pour chacune des deux formes HIn et In de l'indicateur, une relation entre la concentration effective de la forme considérée et l'absorbance mesurée.a) En utilisant la conservation de la quantité de matière effective, écrire la relation entre la
concentration molaire apportée en bleu de bromothymol et les concentrations molaires effectives des formes acide HIn et basique In- b) A la longueur d'onde choisie, seule l'espèce In absorbe ; en déduire la relation entre la concentration molaire effective en In et l' absorbance A à différents pH. c) En considérant qu'à pH élevé seule la forme basique du bleu de bromothymol In est présente, que vaut la concentration molaire effective en forme acide, HIn ? Exprimer l'absorbance A, notée A max , en fonction de la concentration molaire apportée c en bleu de bromothymol. d) Exprimer alors le pourcentage de la forme basique In et le pourcentage de forme acide HIn de l'indicateur coloré en fonction de A et A max HIN InLongueur
d'onde en nm ABSORBANCE A
400 500 600 700
Spectre A = f() des
deux formes HIn et In du BBTIII. Protocole
Chaque groupe prend en charge 1 ou 2 solutions : les résultats sont mis en commun et exploités par tous. Toutes
les mesures de pH sont effectuées avec le même pH-métre.1. Préparation de la solution S
iPrélever, dans un premier bécher, à l'aide de la pipette jaugée, un volume V = 20,0 mL de solution
de " Britton-Robinson » ;Ajouter, à la burette, le volume V
i de solution d'hydroxyde de sodium de concentration molaire1,00.10
-1 mol.L -1 selon les indications figurant dans le tableau ci-dessous ;Prélever 10,0 mL de chacune des solutions ainsi préparées dans un second bécher, y ajouter 1,00
mL de solution de bleu de bromothymol de concentration c = 3,00.10 -4 mol.L -1 ; soit S i la solution ainsi préparée2. Mesurer le pH de la solution S
i3. Mesure de l'absorbance de la solution S
ià l'aide d'un colorimètre unique :
régler la longueur d'onde = 655 nm du colorimètre et faire le blanc rincer la cuve avec la solution S i et mesurer l'absorbance4. Consigner dans le tableau général, les valeurs mesurées de l'absorbance et du pH ainsi que les couleurs
des solutions correspondantes : S i S 1 S 2 S 3 S 4 S 5 S 6 S 7 S 8 S 9 V i4,00 5,00 5,50 6,00 6,50 7,00 7,50 8,00 9,00
pHCouleur
A % In % HInIV. Exploitation des mesures.
1. Construire sur le même graphe les courbes représentatives de l'évolution des valeurs des pourcen-
tages de In et HIn en fonction du pH. En déduire les domaines de prédominance de chacune des deux formes In et HIn.2. Déterminer visuellement la zone de virage de l'indicateur coloré BBT en rassemblant toutes les so-
lutions sur le bureau.Déterminer graphiquement la zone de virage de l'indicateur coloré BBT sachant que la zone de vi-
rage d'un indicateur coloré est généralement définie par l'intervalle de pH dans lequel le rapport
des concentrations molaires des formes acide et basique est compris entre10][][
101InHIn ou
9,1 % % HIn 91 %.
3. Déterminer les coordonnées du point d'intersection.
V. Prolongement
Tracer la courbe pH = f( log (
HInIn pHLog(%In
/%HIn )Déterminer l'équation de la courbe obtenue.
Matériel
Rétroprojecteur + transparent tableau de résultats à compléterMatériel commun
- un colorimètre + cuves - un pH-métre + solutions tampon + papier Joseph - eau distillée - 2 burettes graduées de 25 mL au fond de la salle - solution dite de Britton-Robinson qui permettra d'ajuster le pH solution de Bleu de Bromothymol de c = 3,00 . 10 -4 mol.L -1 - solution d'hydroxyde de sodium (soude) de concentration c b = 0,100 mol.L -1Matériel par binôme
- agitateur magnétique - eau distillée- verrerie courante : pipettes jaugées de 10 mL, de 20 mL, pipette graduée de 1 mL, propipette,
2 béchers de 50 mL + bécher poubelle
Préparation de la solution de BRITTON-ROBINSON et de la solution de BBT. 1.Solution de BRITTON-ROBINSON.
Dans une fiole jaugée de 1,00 L, mélanger 12,5 mL d'acide phosphorique à 1,00 mol.L -1 , 12,5 mL d'acide étha- noïque à 1,00 mol.L -1 et 125 mL d'acide borique à 0,100 mol.L -1 (ou 6,19 g.L -1 ) et compléter à 1L. Informations concernant les réactifs utilisés et les précautions de manipulation : -Acide éthanoïque à 1,00 mol.L -1 : il peut être préparé à partir de l'acide éthanoïque pur, de concentration17,4 mol.L
-1. Il faut donc prélever 57,5 mL précisément (exclure l'éprouvette graduée) d'acide pur, les diluer
dans un bécher, les placer dans une fiole de 1000 mL et compléter à l'eau distillée ou déminéralisée. Le pK
A de l'acide éthanoïque est égal à 4,7.L'acide éthanoïque pur peut provoquer de graves brûlures. En cas d'inhalation, faire respirer de l'air
frais. En cas de contact avec les yeux, laver abondamment à l'eau, paupières écartées. En cas
d'ingestion, faire boire beaucoup sans chercher à neutraliser. -Acide phosphorique à 1,00 mol.L -1 : il peut être préparé à partir de l'acide phosphorique à 85%, de concentration égale à 14,8 mol.L -1 . Il faut donc prélever 67,4 mL précisément (exclure l'éprouvette graduée)d'acide, les diluer dans un bécher, verser le contenu du bécher dans une fiole jaugée de 1000 mL que l'on
complète avec de l'eau déminéralisée ou distillée.L'acide phosphorique est un triacide : pK
A1 = 2,0 ; pK A2 = 6,7 ; pK A3 = 12,0.L'acide phosphorique à 85 % peut provoquer de graves brûlures de la peau. En cas d'inhalation, faire
respirer de l'air frais. En cas de contact avec les yeux, laver abondamment à l'eau, paupières écar-
tées. Consulter un ophtalmologiste. En cas d'ingestion, faire boire beaucoup d'eau sans chercher à
neutraliser. -Acide borique de formule H 3 BO 3à 0,100 mol.L
-1 : peser exactement (l'acide borique pur est un solideblanc) 6,19 g d'acide, les introduire dans une fiole jaugée de 1000 mL. Compléter la fiole avec de l'eau déminé-
ralisée ou distillée. L'Acide borique de formule H 3 BO 3 est un acide de pK A = 9,3. Faible toxicité. Pas de précautions particulières.2. Solution de BBT à 3,00.10
- 4 mol.L -1 - 1,87 g de bleu de bromothymol de formule brute C 27H 28
Br 2 O 5
S (M = 624,41 g.mol
-1 ) sont dissous dans 530 mL d'éthanol à 95° et complétés à 1L. Cette solution à 3,00.10 - 3 mol.L -1 est ensuite diluée 10 fois dans l'eau. On peut aussi utiliser le composé de formule brute C 27H 27
Br 2 O 5
SNa (M = 646,39 g.mol
-1 - Si l'on veut tracer les spectres d'absorption A = f(), pour la forme acide HIn on fait une solution de BBT à 3,00.10 - 5 mol.L -1 dans l'acide chlorhydrique à 0,100 mol.L -1 et pour la forme basique In on fait une solution de BBT à 3,00.10 - 5 mol.L -1 dans la soude à 0,100 mol.L -1Un bécher
devant chaquequotesdbs_dbs29.pdfusesText_35[PDF] concentration molaire effective definition
[PDF] concentration ionique formule
[PDF] telecharger des maths ensemble et pour chacun
[PDF] concentration en soluté apporté et concentration effective
[PDF] hydrophilie
[PDF] concentration de soluté definition
[PDF] mole et concentration molaire seconde
[PDF] quelle est la quantité de matière n de soluté dans un volume
[PDF] n=c/v
[PDF] n=cxv unité
[PDF] définition concentration molaire
[PDF] dissolution définition chimie
[PDF] concentration molaire de l'ion calcium
[PDF] concentration molaire ca2+
