 Conductance et conductivité
Conductance et conductivité
1.2- On mesure une conductance = 796.10?6 pour une solution électrolytique . Calculer la conductivité en précisant clairement l'unité utilisée.
 Solution de Exercices de La conductance et la conductivité
Solution de Exercices de La conductance et la conductivité
1.2) La conductivité d'une partie d'une solution électrolytique dépend de la tension appliquée aux électrodes et au courant électrique qui passe dans le.
 CONDUCTIVITE DES SOLUTIONS 1. Electrolytes et conductivité 1.1
CONDUCTIVITE DES SOLUTIONS 1. Electrolytes et conductivité 1.1
Un électrolyte est une solution permettant le passage du courant. C'est une La conductance d'une solution est une grandeur qui traduit la capacité d'une.
 Chapitre 3 Conductimétrie
Chapitre 3 Conductimétrie
Plus G est élevée plus la solution électrolytique conduit le courant électrique. G : conductance en Siemens (S). R : résistance en Ohm (?). 2. Conductivité.
 Conductivité des électrolytes
Conductivité des électrolytes
Si on plonge les électrodes de la cellule dans une solution électrolytique on peut mesurer la conductance G. Page 3. III- Facteurs influençant la conductance.
 Conductimétrie - AlloSchool
Conductimétrie - AlloSchool
I – Conductance d'une solution électrolytique : 1 – Nature de courant électrique dans les solutions électrolytiques : On met dans un tube de forme un
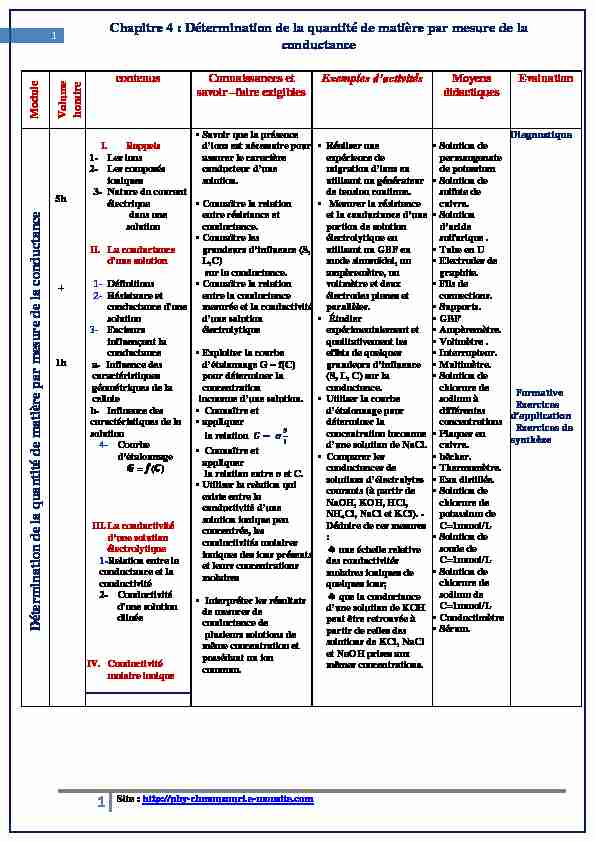
 Chapitre 4 : Détermination de la quantité de matière par mesure de
Chapitre 4 : Détermination de la quantité de matière par mesure de
d'une solution électrolytique. 1-Relation entre la conductance et la conductivité. 2- Conductivité d'une solution diluée. IV. Conductivité molaire ionique.
 Conductance dune portion de solution électrolytique
Conductance dune portion de solution électrolytique
Conductance d'une portion de solution électrolytique. Conductivité d'une solution. Conductivité molaire d'un soluté. Conductivité molaire ionique. Grandeur.
 Mesure de la conductance dune solution
Mesure de la conductance dune solution
A l'intérieur d'une solution électrolytique chaque ion apporte sa contribution au passage du courant électrique. La conductivité ionique de la solution est
 1- Rappels délectricité 2- Conductance dune portion de solution
1- Rappels délectricité 2- Conductance dune portion de solution
connaissant la conductivité molaire ionique et la 5- La conductivité de la solution ... 1.1- Courant électrique dans une solution électrolytique.
 [PDF] Conductivité des électrolytes - AlloSchool
[PDF] Conductivité des électrolytes - AlloSchool
Nature de l'électrolyte : La conductance d'une solution dépend de la nature du soluté c'est-à-dire des ions présents dans la solution La température : La
 [PDF] Conductance et conductivité - AlloSchool
[PDF] Conductance et conductivité - AlloSchool
1- Calculer la résistance de la portion d'électrolyte comprise entre les électrodes 2- Calculer la conductance en S 3- La conductivité de cette solution
 [PDF] CONDUCTIVITE DES SOLUTIONS 1 Electrolytes et conductivité 11
[PDF] CONDUCTIVITE DES SOLUTIONS 1 Electrolytes et conductivité 11
1 1 Définition Un électrolyte est une solution permettant le passage du courant C'est une conductivité de type ionique Les porteurs de charge sont les ions (
 [PDF] Conductivité-des-électrolytes-potentiométriepdf
[PDF] Conductivité-des-électrolytes-potentiométriepdf
Le transport du courant dans une solution électrolytique étant assuré par l'intermédiaire de tous les ions la conductivité d'une solution dépendra donc
 [PDF] Conductance dune portion de solution électrolytique
[PDF] Conductance dune portion de solution électrolytique
Conductance d'une portion de solution électrolytique Conductivité d'une solution Conductivité molaire d'un soluté Conductivité molaire ionique Grandeur
 [PDF] Cours 05 Chimie La conductance et la conductivité - A9lame
[PDF] Cours 05 Chimie La conductance et la conductivité - A9lame
La conductance d'une solution électrolytique est proportionnelle au rapport Le coefficient de proportionnalité représente la conductivité de la solution La
 [PDF] 08conductimetriepdf
[PDF] 08conductimetriepdf
Conductimétrie ? La conductimétrie permet de mesurer les propriétés conductrices des solutions électrolytiques A : Conductance d'une solution ionique
 [PDF] La conductivité des solutions délectrolytes forts et faibles - CPH405
[PDF] La conductivité des solutions délectrolytes forts et faibles - CPH405
Étudier la conductivité des solutions et appliquer la relation de Debye-Hückel- il est utile de définir la conductance (G) d'une solution qui correspond
 [PDF] Chapitre 3 Conductimétrie
[PDF] Chapitre 3 Conductimétrie
? La conductance G est l'inverse de la résistance R de la cellule de conductimétrie Plus G est élevée plus la solution électrolytique conduit le courant
 [PDF] solution-de-exercices-de-la-conductance-et-la-conductivitc3a9pdf
[PDF] solution-de-exercices-de-la-conductance-et-la-conductivitc3a9pdf
1 2) La conductivité d'une partie d'une solution électrolytique dépend de la tension appliquée aux électrodes et au courant électrique qui passe dans le
1 Site : http://phy-chmouzouri.e-monsite.com
1 Chapitre 4 : Détermination de la quantité de matière par mesure de la
conductanceModule
Volume horaire
contenus Connaissances et savoir faire exigiblesMoyens
didactiquesEvaluation
Détermination de la
quantité de matière par mesure de la conductance 6 5h 1hI. Rappels
1- Les ions
2- Les composés
ioniques3- Nature du courant
électrique
dans une solutionII. La conductance
d'une solution1- Définitions
2- Résistance et
conductance d'une solution3- Facteurs
influençant la conductance a- Influence des caractéristiques géométriques de la cellule b- Influence des caractéristiques de la solution4- Courbe
III. La conductivité
électrolytique
1-Relation entre la
conductance et la conductivité2- Conductivité
d'une solution diluéeIV. Conductivité
molaire ionique Savoir que la présence
assurer le caractère solution. Connaître la relation
entre résistance et conductance. Connaître les
L,C) sur la conductance. Connaître la relation
entre la conductance mesurée et la conductivitéélectrolytique
Exploiter la courbe
pour déterminer la concentration inconnue d Connaître et
appliquer
la relation ࡳൌ ࣌ࡿ Connaître et
appliquer Utiliser la relation qui
existe entre la solution ionique peu concentrée, les conductivités molaires ioniques des ions présents et leurs concentrations molaires Interpréter les résultats
de mesures de conductance de plusieurs solutions de même concentration et possédant un ion commun. Réaliser une
expérience de utilisant un générateur de tension continue. Mesurer la résistance
portion de solutionélectrolytique en
utilisant un GBF en mode sinusoïdal, un ampèremètre, un voltmètre et deuxélectrodes planes et
parallèles. Étudier
expérimentalement et qualitativement les effets de quelques (S, L, C) sur la conductance. Utiliser la courbe
déterminer la concentration inconnue Comparer les
conductances de courants (à partir deNaOH, KOH, HCl,
NH4Cl, NaCl et KCl). -
Déduire de ces mesures
une échelle relative des conductivités molaires ioniques de quelques ions; que la conductance peut être retrouvée à partir de celles des solutions de KCl, NaCl et NaOH prises aux mêmes concentrations. Solution de
permanganate de potassium Solution de
sulfate de cuivre. Solution
sulfurique . Tube en U
Electrodes de
graphite. Fils de
connections. Supports.
GBF
Ampèremètre.
Voltmètre .
Interrupteur.
Multimètre.
Solution de
chlorure de sodium à différentes concentrations Plaques en
cuivre. bêcher.
Thermomètre.
Eau distillée.
Solution de
chlorure de potassium deC=1mmol/L
Solution de
soude deC=1mmol/L
Solution de
chlorure de sodium deC=1mmol/L
Conductimètre
Sérum.
Diagnostique
Formative
Exercices
Exercices de
synthèse2 Site : http://phy-chmouzouri.e-monsite.com
2 Chapitre 4 : Détermination de la quantité de matière par mesure de la
conductanceI. Rappels
1- Les ions :
Un ion est une espèce chimique chargée électriquement, un atome ou une molécule ayant gagné ou perdu un ou plusieurs électrons. Les ions peuvent être monoatomiques, s'ils ne sont formés que d'un seul type d'atomes, ou polyatomiques s'ils contiennent des atomes différentsIons monoatomiques Na+ K+ Cl- O2- Mg2+ Ca2+
Ions polyatomiques HCO3- CO32- SO42- HO- NH4+ H3O+2- Les composés ioniques :
Qu'est-ce qu'un composé ionique?
Un composé ionique est un solide constitué par l'association d'anions ܻ ?et de cations ܺ électriquement neutre. Sa formule générale sécrit : ܺఉܻRemarque : Lorsqu'on écrit la formule chimique d'un composé ionique, on place la formule du cation avant celle de
l'anion.Exemples :
Sulfure de plomb II Pb2+ S2- PbS
Bromure de plomb II Pb2+ ࢘ି PbBr2
Chlorure de sodium Na+ ି ࡺࢇChlorure Al3+ ି AlCl3
Phosphate de calcium Ca2+ ࡼࡻି Ca3(PO4)23- Nature du courant électrique dans une solution :
a- Activité : Migration des ions https://youtu.be/CWHZ2Ojsq6k?t=141 Les ions cuivre Cu2+, de couleur bleue, se sont déplacés dans le sens du courant, vers la borne du générateur.Les ions permanganate MnO4
, de couleur violette, se sont déplacés dans le sens opposéà celui du courant, vers la borne +.
b- Conclusion :Le passage du courant électrique dans un solution résulte d'une double migration des anions et des cations
qui se déplacent en sens inverse On appelle ces solutions des solutions électrolytiquesLes corps purs solides qui se dissolvent dans des solvants en donnant des ions sont des "Electrolytes"
II- La conductance d'une solution :
1- Définitions :
-à-dire des solutions conductrices du courant électrique (solutions électrolytiques).3 Site : http://phy-chmouzouri.e-monsite.com
3 Chapitre 4 : Détermination de la quantité de matière par mesure de la
conductance2- Résistance et conductance d'une solution :
a- Cellule de mesure de la conductance : Cellule conductimétrique Elle est composée de deux plaques métalliques planes, de même une distance L. Lorsque cette cellule est complètement immergée dans un liquide, elle permet de mesurer la conductance G du volume de liquide compris entre les électrodes entre deux plaques b- Résistance et conductance d'une solution : On applique une tension alternative sinusoïdale de valeur efficace U (en V) entre les électrodes de la cellule conductimétrique solution.ȍ: ࡾLࢁ
u La conductance G, en siemens (1S = 1-1), de la portion de solution entre les électrodes est : U I RG 13- Facteurs influençant la conductance
a- Influence des caractéristiques géométriques de la cellule : .Activité expérimentale : On cherche à étudier qualitativement le rôle des On utilise les mêmes conditions (température, état de surf .Montage expérimental:
On réalise le montage ci-après : Le dispositif permet de faire varier la surface utile des électrodes (en réglant la hauteur h immergée : graduation sur l'électrode) et la distance L entre les deux électrodes.Remarque :
les cellule conductimétriqueÎ Influence de la surface:
GBF réglé pour délivré une tension efficace maintenue à U = 3 V de fréquence f = 500 Hz.
mesures faites avec une solution d'acide chlorhydrique de concentration co = 10-2 mol.L-1 et bécher 100 mL forme
basse.Résultats :
I (mA) 26.6 40.5 56.1 68.5
h (cm) 1 2 3 4S (cm²) 2 4 6 8
G (mS) 8.7 13.5 18.7 22.8
Î Influence de la distance entre les électrodes: mesures faites avec une solution d'acide chlorhydrique de concentration co = 10-2 mol.L-1 hauteur immergée des élecrodes : h = 2 cm.Résultats :
L (cm) 2 3 4 5
I (mA) 27.2 18.8 13.9 11.3
4 Site : http://phy-chmouzouri.e-monsite.com
4 Chapitre 4 : Détermination de la quantité de matière par mesure de la
conductanceG (mS) 9.1 6.3 4.6 3.8
Questions :
9 Quelle est l'influence de s sur la conductance de la solution ?
ª La conductance augmente avec la surface des électrodes9 Quelle est l'influence de l sur la conductance de la solution ?
ª La conductance diminue quand la distance entre électrode augmente.Conclusion :
Pour une solution électrolytique donnée, la conductance G de la colonne liquide située entre les plaques est :
ce l entre les plaques (la conductance G augmente quand la distance diminue).Le rapport ࡷLࡿ
quotesdbs_dbs31.pdfusesText_37
[PDF] conductivité d'une solution formule
[PDF] mesure de la conductivité d'une solution
[PDF] la conductance et la conductivité d'une solution électrolytique pdf
[PDF] mesure de la conductivité électrique
[PDF] conductimétrie cours terminale s
[PDF] conductimétrie principe
[PDF] conductimétrie exercices corrigés
[PDF] conductimétrie tp
[PDF] conductimétrie formule
[PDF] conductimétrie pdf
[PDF] conductivité de l'eau potable
[PDF] facteur de correction température conductivité
[PDF] influence de la température sur la conductivité de l'eau
[PDF] conversion conductivité salinité
